Escolar Documentos
Profissional Documentos
Cultura Documentos
Reporte de Termodinamica
Enviado por
Mauricio Baltazar PerezTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Reporte de Termodinamica
Enviado por
Mauricio Baltazar PerezDireitos autorais:
Formatos disponíveis
Datos. Los datos tomados en el laboratorio, fueron los reunidos en la tabla siguiente. Masa de muestra (g) 0.
7357 Delta T(K) -0,1354 -0,1432 -0,1447 -0,1438 -0,1420 -0,1399 0,9768 2,3142 2,5884 2,6681 2,6954 2,7020 2,7018 2,6984 2,6936 2,6885 2,6833 2,6781 2,6720
T0(K) 296,6139 Tiempo(min) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19
Resultados. Los resultados de la prctica se renen en la siguiente tabla. T0(K) PCS=9287,35137cal/g Aceite de palma.
PCScorr=9177.669724 cal/g Aceite de palma 296,6139 Tiempo(min) Delta T(K) Temperatura(K) 1 -0,1354 296,4785 2 -0,1432 296,4707 3 -0,1447 296,4692 4 -0,1438 296,4701 5 -0,1420 296,4719 6 -0,1399 296,474 7 0,9768 297,5907 8 2,3142 298,9281
9 10 11 12 13 14 15 16 17 18 19
2,5884 2,6681 2,6954 2,7020 2,7018 2,6984 2,6936 2,6885 2,6833 2,6781 2,6720
299,2023 299,282 299,3093 299,3159 299,3157 299,3123 299,3075 299,3024 299,2972 299,292 299,2859
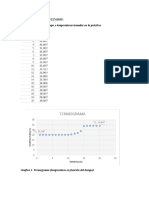
Clculos y cuestionario. 1. Represente mediante un grafico la relacin temperatura-tiempo y obtenga la ecuacin que rige dicho fenmeno, explique su comportamiento y determine para la etapa de combustin el T corregido y el obtenido por la diferencia entre el valor mximo y mnimo.
300 299,5 299 298,5 298 297,5 297 296,5 296 0 5 10
y = -2E-05x6 + 0,001x5 - 0,021x4 + 0,215x3 - 0,951x2 + 1,665x + 295,5 R = 0,969
Temperatura vrs tiempo Temperatura mnima de combustin Temperatura mxima de combustin Polinmica (Temperatura vrs tiempo)
15
20
La ecuacin que dio el mejor ajuste fue un polinomio de grado 6, aun as el coeficiente de correlacin no fue tan cercano a 1, la ecuacin predeca un brusco incremento para la parte de combustin. 2. Calcule el PCS de la muestra por medio de la ecuacin (1) y utilizando los valores de T corregido y el obtenido por el valor mximo y mnimo de la etapa de combustin. En base a estos resultados identifique cual de las sustancias dadas en la prctica corresponde a la muestra utilizada. Calcule el porcentaje de error del PCS para cada uno de los mtodos utilizados en el clculo de T. Para los clculos considere que: Csist=9936.6 J/K; Qext1=50 J; Qext2=0 J; Calculando el P C S, usando los valores de Tmin y Tmax de combustin.
PCS=38884.26587 kJ/kg Al convertir este valor a cal/g Nos da PCS=9287,35137cal/g
Usando el valor de T corregido da
PCS=9177.669724 cal/g
3. Proponga un modelo termodinmicamente reversible el cual pueda representar el proceso de transferencia de calor ocurrido en la combustin, indicando cual es aporte del poder calorfico de la sustancia en el fenmeno de combustin.
Reactivos a Tmin=296.4719 K
H total
Productos a Tmax=299.3159
H1 H2 Reactivos a 298 K Productos a 298 K
H3
El proceso representado por la trayectoria termodinmica es como sigue: Inicialmente se tienen los reactivos a 295.9138 K y a una presin P, y partiendo del principio de que la entalpia es funcin de estado, no importa que camino conecta el estado inicial y final para el H total, siempre dar el mismo valor, y se usan caminos donde se incluyan datos que se dispongan. El aporte del poder calorfico de la sustancia est reflejado en H2, que significa .
4. Explique por qu motivo la temperatura del agua se incrementa de manera bastante uniforme durante el proceso de pre-combustin. Podra aumentar la temperatura de forma indefinida? Explique su respuesta. La temperatura del agua se no se increment el proceso de pre-combustin, esto es debido a que las sustancias, en esta etapa consumen energa, para iniciar el proceso de la combustin. Y la temperatura no puede mantener una tendencia de forma indefinida, porque en algn momento iniciara la combustin, razn por la que el aumento de temperatura se disparara hasta un valor mximo. 5. Que observacin en el experimento les permite concluir que el poder calorfico obtenido es el PCS. Al final del experimento, cuando el instructor retiro el vaso de disgregacin se poda ver en las paredes de este la formacin de gotas de roco, es decir agua condensada. Resultados. 1. La ecuacin obtenida es: y = -2E-05x6 + 0,001x5 0,021x4 + 0,215x3 0,951x2 + 1,665x + 295,5 R = 0,969 Donde y representa el valor de la temperatura, x representa el valor de tiempo, siendo una ecuacin dependiente del tiempo. El cambio de temperatura predicho por la ecuacin es de 7.1054 K y por los valores dados por el calormetro es de 2.844 K. Siendo la temperatura mnima y mxima para los valores dados por el calormetro de 296.4719 K y de 299.3159 K respectivamente, para los valores descritos por la ecuacin son de 296.6125 K y de 303.7123 K.
2. El poder calorfico superior de la muestra usando los datos que proporciona el calormetro es de 9.28735137 kcal/g con un porcentaje de error de 0.457112, este valor calculado en base al valor del aceite de palma, que es aproximadamente el valor calculado. Usando los nuevos valores de T, se calcula el poder calorfico en 22.88722871 kcal/g, con un porcentaje de error de 145.30. Conclusiones. 1. La magnitud del poder calorfico calculada a partir de las magnitudes medidas en el laboratorio corresponden a el poder calorfico superior, porque al final cuando el instructor destap el vaso de disgregacin, este tena formadas gotas de agua, que corresponderan a la condensacin del vapor de agua, producido durante la combustin. 2. Los datos son demasiado dispersos, por lo que la ecuacin describe de una forma poco convincente el comportamiento de la temperatura en el tiempo, vindose reflejado esto en el valor del coeficiente de correlacin, aunque los valores dados por el calormetro podran no ser los valores correctos de Tmin y de Tmax, pues el calormetro no da valores continuos sino cada minuto, esta es la causa tambin del por qu el PCS calculado es aproximado a el valor ya tabulado, del aceite de palma, an as el valor calculado usando el delta de temperatura corregido nos da aproximadamente el valor del aceite de palma, por lo que la muestra desconocida era aceite de palma, y siendo ambos mtodos bastante buenos(usando los valores del calormetro y los valores del mtodo grfico), para la estimacin de poderes calorficos superiores. Bibliografa. 1. Smith, J. M, Van Ness, H. C, Abbott, Michael M; Introduccin a la termodinmica en ingeniera qumica, 5a edicin, 7 ed, 2007, MacGraw-Hill, Mxico, D.F. 2. Apuntes de termodinmica, disponible en http://www.uia.mx/campus/publicaciones/fisica/pdf/15termodinamica.pdf
Você também pode gostar
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSNo EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSNota: 4.5 de 5 estrelas4.5/5 (7)
- Ingeniería química. Soluciones a los problemas del tomo INo EverandIngeniería química. Soluciones a los problemas del tomo IAinda não há avaliações
- Problemario Quimica IndustrialDocumento31 páginasProblemario Quimica IndustrialDan CruzAinda não há avaliações
- Taller de Calor LatenteDocumento2 páginasTaller de Calor LatenteMaria VirginiaAinda não há avaliações
- Evaporador Doble Efecto Con Alimentación en RetrocesoDocumento23 páginasEvaporador Doble Efecto Con Alimentación en Retrocesogonzalezjulieta69% (13)
- Ejercicio 3. Indagación, Revisión de Datos y CálculosDocumento4 páginasEjercicio 3. Indagación, Revisión de Datos y CálculosAndrea Celis100% (2)
- Fisio 2 Funciones Secretoras Del Tubo DigestivoDocumento100 páginasFisio 2 Funciones Secretoras Del Tubo DigestivoAbnerOlvera100% (7)
- Determinación de La Razón Entre Las Capacidades Caloríficas de Los GasesDocumento8 páginasDeterminación de La Razón Entre Las Capacidades Caloríficas de Los GasesAlvaro Etcheverry67% (3)
- Calorimetria 11Documento8 páginasCalorimetria 11Jose Luis Cervantes LeonAinda não há avaliações
- Práctica 10 Calor de CombustiónDocumento8 páginasPráctica 10 Calor de CombustiónDaniel Rodriguez MonroyAinda não há avaliações
- ECAMPUS Practica 7Documento6 páginasECAMPUS Practica 7Jerome TarifaAinda não há avaliações
- CALORIMETRÍADocumento5 páginasCALORIMETRÍAVANESSA ARELIS HUARITA ADRIANAinda não há avaliações
- PA2 - 2024 - 10A - Colaborativo - Grupo 7Documento21 páginasPA2 - 2024 - 10A - Colaborativo - Grupo 7CESAR ALBERTO OCAS QUILICHEAinda não há avaliações
- Informe - Calor de Combustión CompletoDocumento8 páginasInforme - Calor de Combustión CompletoMeylinVanessaVillaMarencoAinda não há avaliações
- Analisis y Resultados FisicoquimicaDocumento3 páginasAnalisis y Resultados FisicoquimicaAngelo VarelaAinda não há avaliações
- Exp 7Documento4 páginasExp 7Gonzalvus Sandoval Riquelme100% (1)
- Proyecto Final TermodinamicaDocumento13 páginasProyecto Final TermodinamicaHarry RamosAinda não há avaliações
- Bombas JunkerDocumento8 páginasBombas JunkerjuancarlosjuaquinAinda não há avaliações
- Minievaporador INFORME 1 LAB I Rev RARSDocumento14 páginasMinievaporador INFORME 1 LAB I Rev RARSAnnie Duarte TarazonaAinda não há avaliações
- Informe 2 FisicaDocumento5 páginasInforme 2 FisicaElena A. GarayAinda não há avaliações
- Lab. de Fisica II. EtilenglicolDocumento11 páginasLab. de Fisica II. EtilenglicolJose Carlos Romero DíazAinda não há avaliações
- Equivalente ElectricoDocumento5 páginasEquivalente ElectricoJames StoutAinda não há avaliações
- Informe Capacid Cal FisicoquimicaDocumento3 páginasInforme Capacid Cal FisicoquimicaNICOLAS GOMEZ DAZAAinda não há avaliações
- Guias Mea 421Documento11 páginasGuias Mea 421gonzalo burgosAinda não há avaliações
- Informe #2 de FisicoquimciaDocumento4 páginasInforme #2 de FisicoquimciaEvelyn TapiaAinda não há avaliações
- Informe 2, Calor de Reacción en SoluciónDocumento23 páginasInforme 2, Calor de Reacción en Solucióncarlosmaba100% (2)
- Reporte 2 de Termodinámica de ProcesosDocumento4 páginasReporte 2 de Termodinámica de ProcesosEduardo Antonio MartinezAinda não há avaliações
- Informe. Calor de CombustiónDocumento6 páginasInforme. Calor de CombustiónJavier E. Verni BarruetaAinda não há avaliações
- Practica Calorimetria MadeDocumento11 páginasPractica Calorimetria MadeJerome TarifaAinda não há avaliações
- TERMOQUIMICADocumento20 páginasTERMOQUIMICAMerinoAlvan75% (8)
- Laboratorio de Termodinámica p5Documento4 páginasLaboratorio de Termodinámica p5Tassu 1001Ainda não há avaliações
- Inf2 Olima Fuentes Visconti V1Documento12 páginasInf2 Olima Fuentes Visconti V1Emilia BrandolinAinda não há avaliações
- Informe N° 3Documento2 páginasInforme N° 3Carolina Alejandra Cardenas JametAinda não há avaliações
- Calor Específico de Un MetalDocumento9 páginasCalor Específico de Un MetalBorja González CifuentesAinda não há avaliações
- U1901 Guia de Trabajos Prácticos Módulo III y IV 2020Documento22 páginasU1901 Guia de Trabajos Prácticos Módulo III y IV 2020Sebastian Lizarazo SotoAinda não há avaliações
- Efecto Calorífico de Las Reacciones QuímicasDocumento12 páginasEfecto Calorífico de Las Reacciones QuímicasDenisse GamarraAinda não há avaliações
- Calorimetria 11Documento9 páginasCalorimetria 11Jose Luis Cervantes LeonAinda não há avaliações
- Calor de Combustion de Acido BenzoicoDocumento12 páginasCalor de Combustion de Acido BenzoicoDaniel Raydan67% (3)
- Laboratorio 3Documento8 páginasLaboratorio 3Richard RodríguezAinda não há avaliações
- 1 CalorimetroDocumento4 páginas1 CalorimetroAndrea ParedesAinda não há avaliações
- P2. DensidadDocumento6 páginasP2. DensidadIsai Gómez BotelloAinda não há avaliações
- Practica CP CalorimetroDocumento7 páginasPractica CP CalorimetroJose Rene García AvendañoAinda não há avaliações
- Informe 2 Pancho-Nico Fis130Documento7 páginasInforme 2 Pancho-Nico Fis130Nico RebolledoAinda não há avaliações
- Aplicacion Termoquimica PDFDocumento20 páginasAplicacion Termoquimica PDFAnonymous hEjq4P3LAinda não há avaliações
- Práctica 2 FCQ PDFDocumento11 páginasPráctica 2 FCQ PDFJennifer TreviñoAinda não há avaliações
- Informe Calor de ReacciónDocumento6 páginasInforme Calor de ReacciónWilmar GrisalesAinda não há avaliações
- Informe 7 Calor de DisolucionDocumento5 páginasInforme 7 Calor de DisolucionArilu2010100% (2)
- Determinacion Del Calor Especifico Del EtanolDocumento5 páginasDeterminacion Del Calor Especifico Del EtanolEder Terres LeonAinda não há avaliações
- Laboratorio 1Documento30 páginasLaboratorio 1DanielaImañaGuzmanAinda não há avaliações
- TermoquimicaDocumento12 páginasTermoquimicaV Mendizabal JocelynAinda não há avaliações
- Termoqumica y Calor EspecificoDocumento8 páginasTermoqumica y Calor EspecificoSantiago ValenciaAinda não há avaliações
- Imforme Practca PresencialDocumento24 páginasImforme Practca PresencialNataly Fernanda CaranquiAinda não há avaliações
- Analisis CuantitativoDocumento8 páginasAnalisis CuantitativoEVCAinda não há avaliações
- Informe 4 Final FisicoQuimicaDocumento10 páginasInforme 4 Final FisicoQuimicaSebastián GuerreroAinda não há avaliações
- Determinación Del Calor Especifico de Los LíquidosDocumento4 páginasDeterminación Del Calor Especifico de Los LíquidosMaria RuizAinda não há avaliações
- Practica 5 Calor de NeutralizacionDocumento5 páginasPractica 5 Calor de NeutralizacionDiego JavierAinda não há avaliações
- Post Lab Práctica No 2 (Ecuación de Antoine y Clausius)Documento11 páginasPost Lab Práctica No 2 (Ecuación de Antoine y Clausius)Olguita PerezAinda não há avaliações
- Informe Calidad de Vapor en La Caldera, Termodinámica IIDocumento6 páginasInforme Calidad de Vapor en La Caldera, Termodinámica IIGeovanny Moisés PanchanaAinda não há avaliações
- Reporte CalorimetriaDocumento10 páginasReporte CalorimetriaGibran Meza CastrejonAinda não há avaliações
- Práctica de Laboratorio - Calor LatenteDocumento6 páginasPráctica de Laboratorio - Calor LatenteSergio Luis Castaño RodriguezAinda não há avaliações
- Aji Maya DefinitivoDocumento15 páginasAji Maya DefinitivoKike Vergara Palma0% (1)
- Práctico Nº3 Primer Principio Sistemas AbiertosDocumento4 páginasPráctico Nº3 Primer Principio Sistemas AbiertosSinNombre SinApellidoAinda não há avaliações
- Proyecto MuelleDocumento17 páginasProyecto MuellejavierAinda não há avaliações
- Res. 0001-2015 Estupefacientes Guía Del Usuario Empresa SicoqDocumento72 páginasRes. 0001-2015 Estupefacientes Guía Del Usuario Empresa SicoqDannyAinda não há avaliações
- Caracteisticas de Las CarnesDocumento8 páginasCaracteisticas de Las CarnesMarco AntonioAinda não há avaliações
- Hoja de Datos Nitrógeno GasDocumento6 páginasHoja de Datos Nitrógeno GasFernando MendezAinda não há avaliações
- Informe 2 de BadinhoDocumento16 páginasInforme 2 de BadinhoBadinho LopezAinda não há avaliações
- Actividad1 Química-1Documento11 páginasActividad1 Química-1veronica100% (1)
- ¿Cómo Se Hace Una Maceración de Hierbas Medicinales - Plantas para Curar - Propiedades y Usos de Las Plantas MedicinalesDocumento5 páginas¿Cómo Se Hace Una Maceración de Hierbas Medicinales - Plantas para Curar - Propiedades y Usos de Las Plantas Medicinalesanayenci montañezAinda não há avaliações
- Examen 1 de MineraDocumento5 páginasExamen 1 de MineraAlejandro Vasquez TorresAinda não há avaliações
- SM Noches de Crucero 10 - Sarah Mayberry - Deliciosamente TuyaDocumento114 páginasSM Noches de Crucero 10 - Sarah Mayberry - Deliciosamente Tuyacampodegirasoles100% (1)
- Aire Comprimido Dental PDFDocumento68 páginasAire Comprimido Dental PDFJose Torres0% (1)
- AnexoIII HallazgosFinalOctDocumento37 páginasAnexoIII HallazgosFinalOctCarlos Alfredo Lopez VegaAinda não há avaliações
- Taller de TermodinamicaDocumento3 páginasTaller de TermodinamicaMoises Estupiñan SanchezAinda não há avaliações
- FT-SAE 1045 TrefiladoDocumento2 páginasFT-SAE 1045 TrefiladoHector Muñoz BravoAinda não há avaliações
- Sol Parcial - F2 - 2014-II - Ejercicios PDFDocumento4 páginasSol Parcial - F2 - 2014-II - Ejercicios PDFAngie Zegarra RuedaAinda não há avaliações
- Taller de Repaso de Química de 3 Periodo 9°Documento4 páginasTaller de Repaso de Química de 3 Periodo 9°Quimica Sebastiana33% (3)
- GASES - Ejercicios Con ResultadosDocumento2 páginasGASES - Ejercicios Con ResultadosClaudio CALÍAinda não há avaliações
- Informe de Cromatografia de PapelDocumento4 páginasInforme de Cromatografia de PapelDiego Cerquera100% (1)
- Tema GeneralDocumento47 páginasTema GeneralTitoxd CastroAinda não há avaliações
- Cordinos de Alta ResistenciaDocumento2 páginasCordinos de Alta ResistenciajoseluisglezpeluAinda não há avaliações
- Ensayo Fisica para PDFDocumento16 páginasEnsayo Fisica para PDFmusculosjugi100% (1)
- Transporte de Residuos PeligrososDocumento4 páginasTransporte de Residuos PeligrososDaniza Rossetti SilvaAinda não há avaliações
- GRAFENODocumento2 páginasGRAFENOCristina Paz Urqueta MuñozAinda não há avaliações
- Evaluación de Biología. 9° - 10.08 - Molaridad, MolalidadDocumento1 páginaEvaluación de Biología. 9° - 10.08 - Molaridad, MolalidadJean Deli Gutiérrez VillarrealAinda não há avaliações
- Ciclo de Refrigeración Por GasDocumento3 páginasCiclo de Refrigeración Por GasDano VillamarAinda não há avaliações
- ECOTECNOLOGIASMARZO2018Documento62 páginasECOTECNOLOGIASMARZO2018Seli BastetAinda não há avaliações
- Actividad Numero 2 Buenas Prácticas AgricolasDocumento6 páginasActividad Numero 2 Buenas Prácticas AgricolasJulian David J BedoyaAinda não há avaliações
- INTRODUCCIÓNDocumento6 páginasINTRODUCCIÓNQuique RosasAinda não há avaliações