Escolar Documentos
Profissional Documentos
Cultura Documentos
Guia No 5 Soluciones 2011
Enviado por
Edward Sebastian Olivares SaavedraDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Guia No 5 Soluciones 2011
Enviado por
Edward Sebastian Olivares SaavedraDireitos autorais:
Formatos disponíveis
1
UNIVERSIDAD AUTONOMA DE CHILE CARRERA DE KINESIOLOGIA ASIGNATURA DE QUIMICA 2011 Prof. Germaine Jacob A. / Prof. Rowena Tllez N. GUIA DE EJERCICIOS N 5 SOLUCIONES Y PROPIEDADES COLIGATIVAS Al final del captulo, el alumno deber ser capaz de 1. Definir solucin, soluto y solvente. 2. Explicar el concepto de lo semejante disuelve lo semejante, a travs del proceso de disolucin de solutos inicos y polares en solventes polares y de solutos apolares en solventes apolares. 3. Definir solubilidad y solucin no saturada, saturada y sobresaturada. 4. Explicar la influencia de la naturaleza qumica del soluto y solvente, la temperatura y la presin sobre la solubilidad de solutos slidos, lquidos y gaseosos en solventes lquidos. 5. Definir concentracin de una solucin. 6. Definir las expresiones de concentracin % p/p, % p/v, molaridad (M), molalidad (m), normalidad (N) y fraccin molar. 7. Explicar cmo se prepara una solucin por pesada. 8. Transformar una expresin de concentracin en otra. 9. Utilizar la densidad de una solucin en transformaciones de expresiones de concentracin. 10. Explicar cmo se prepara una solucin diluida a partir de otra concentrada. Realizar los clculos al respecto. 11. Calcular concentraciones finales de soluciones preparadas por dilucin de soluciones concentradas. 12. Definir lo que se entiende por propiedades coligativas de las soluciones. 13. Explicar lo que se entiende por electrolito fuerte, electrolito dbil y no electrolito. 14. Calcular el nmero de partculas en solucin a partir de la concentracin molar de electrolitos fuertes y no electrolitos. 15. Explicar las propiedades coligativas de las soluciones: Disminucin de la presin de vapor Aumento en el punto de ebullicin Disminucin en el punto de congelacin Presin osmtica 16. Explicar el significado de la constante ebulloscpica y de la constante criocpica del solvente. 17. Calcular puntos de ebullicin y puntos de congelamiento de diversas soluciones acuosas de electrolitos fuertes y no electrolitos, conociendo las constantes ebulloscpica y crioscpica del agua y la concentracin de la solucin. 18. Calcular la presin osmtica de soluciones acuosas de electrolitos fuertes y no electrolitos. 19. Explicar los conceptos de osmolaridad y tonicidad de soluciones. Explicar qu se entiende por soluciones isotnicas, hipotnicas e hipertnicas en Biologa.
EJERCICIOS PA H = 1 C = 12 Cl = 35,5 O = 16 Na = 23 Mg = 24 P = 31 S = 32
A. EXPRESIONES DE CONCENTRACION Qu significa que una solucin sea A. 15 % p/p? B. 15 % p/v? C. 0,25 M?
D. 0,25 N?
E. 0,5 m?
B. CALCULO DE LA CANTIDAD DE SOLUTO EN UN VOLUMEN DADO DE SOLUCION Calcule los gramos, moles, milimoles (mmoles), eq-g y milieq-g (meq-g) de soluto que estn disueltos en 1. 1,5 litros de solucin de NaCl al 9 % p/v 2. 200 mL solucin de H2SO4 0,5 M 3. 100 mL de solucin de Mg(OH)2 0,15 N C. CALCULO DEL VOLUMEN DE SOLUCION QUE CONTIENE UNA DETERMINADA CANTIDAD DE SOLUTO Calcule el volumen de cada una de las siguientes soluciones de HCl que contiene 0,02 moles de soluto: 1. solucin al 2 % p/v 2. solucin 0,3 N 3. solucin 0,5 M D. CALCULO DE CONCENTRACION Calcule la concentracin en % p/v, M y N de una solucin que se prepar disolviendo 29,4 g de H3PO4 en agua y se complet 2000 mL de solucin. Esta solucin tiene una densidad de 1,2 g/mL. E. PREPARACION DE SOLUCIONES E1. Calcule cuntos gramos de soluto se necesitan para preparar las siguientes soluciones e explique cmo las preparara: 1. 500 gramos de solucin al 3 % p/p de NaHCO3 2. 100 mL de solucin de Na2SO4 0,25 N E2. Calcule el volumen de solucin concentrada necesario para preparar las siguientes soluciones diludas y explique cmo las preparara: 1. 150 mL de solucin de NaOH al 3 % p/v usando una solucin al 9 % p/V 2. 100 mL de solucin de Na2CO3 al 2 % p/v usando una solucin 1 M E3. Calcule el volumen de solucin de HCl concentrada al 37 % p/p y de densidad 1,18 g/mL necesarios para preparar 1000 mL de solucin 2 M. E4. Ud. necesita preparar 1,5 litros de solucin 0,05 M de HCl y dispone de 4 soluciones de HCl: solucin A: 5,5 litros 0,015 M solucin B: 0,5 litros 0,1 M solucin C: 3 litros 0,1 M solucin D: 0,8 litros 0,08 N Haga los clculos necesarios y determine cul o cules de las soluciones puede usar para preparar la solucin pedida. F. PROPIEDADES COLIGATIVAS F1. Calcule el punto de ebullicin y el punto de congelamiento de una
solucin acuosa de NaCl (electrolito fuerte) que contiene 0,8 moles de sal por Kg de agua. Constantes del agua: Keb = 0,512 C/mol ; Kc = 1,86 C/mol F2. Calcule la presin osmtica de las siguientes soluciones, todas a 20 C: 1. albmina (no electrolito) 0,015 M 2. NaCl (electrolito fuerte) 0,015 M 3. MgCl2 (electrolito fuerte) 0,015 M RESPUESTAS B1. 135 g, 2,3 moles, 2300 mmoles, 2,3 eq-g, 2300 meq-g B2. 9,8 g, 0,1 mol, 100 mmoles, 0,2 eq-g, 200 meq-g B3. 0,435 g, 0,0075 moles, 7,5 mmoles, 0,015 eq-g, 15 meq-g C1. 36,5 mL C2. 66,66 mL C3. 40 mL D. 1,47 % p/v, 0,15 M, 0,45 N, 1,225 % p/p, 0,1265 m E1.1. 15 g E1.2. 1,775 g E2.1. 50 mL E2.2. 18,87 mL E3. 167,2 mL E4. solucin C: 0,75 L F1. PE = 100,82C PC = -2,98C F2.1. 0,36 atm F2.2. 0,72 atm F2.3. 1,08 atm
Você também pode gostar
- Cdbuzzet Sec2 Pos0Documento11 páginasCdbuzzet Sec2 Pos0Edward Sebastian Olivares SaavedraAinda não há avaliações
- Clase Micro Arrays (060910) FinalDocumento71 páginasClase Micro Arrays (060910) FinalEdward Sebastian Olivares SaavedraAinda não há avaliações
- Salud PublicaDocumento501 páginasSalud PublicaRocio PerezAinda não há avaliações
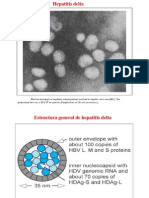
- Clase 9 Hepatitis D y FDocumento15 páginasClase 9 Hepatitis D y FEdward Sebastian Olivares SaavedraAinda não há avaliações
- Observables DerivadasDocumento1 páginaObservables DerivadasMartin CabreraAinda não há avaliações
- Foto 1Documento13 páginasFoto 1frankAinda não há avaliações
- 4 Saludos Protocolares y PresentacionesDocumento39 páginas4 Saludos Protocolares y PresentacioneslorenaAinda não há avaliações
- Procesos Cognitivos en Síntesis VisualDocumento2 páginasProcesos Cognitivos en Síntesis VisualKenny AngelAinda não há avaliações
- Dado Un Problema de Optimización Lineal Con RestriccionesDocumento2 páginasDado Un Problema de Optimización Lineal Con Restriccionesmirlo33033% (3)
- Purificación de Ácidos Grasos, Tocoferoles y EsterolesDocumento7 páginasPurificación de Ácidos Grasos, Tocoferoles y EsterolesLuidy Alfonso RodríguezAinda não há avaliações
- De Las Aguas de ChurínDocumento3 páginasDe Las Aguas de ChurínArlen MamaniAinda não há avaliações
- Geometría AnalíticaDocumento25 páginasGeometría AnalíticaSol de la Torre0% (2)
- Ejercicios Fluidos CanalesDocumento5 páginasEjercicios Fluidos CanalesBrenda Yadira SeñasAinda não há avaliações
- Atraccion InterpersonalDocumento4 páginasAtraccion InterpersonalAntonellaGodinezSalazarAinda não há avaliações
- Escalonado Acero 2016-2Documento15 páginasEscalonado Acero 2016-2Jesús J. Romero ValerianoAinda não há avaliações
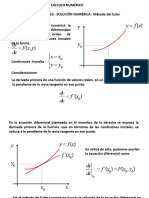
- Método de Euler. Ecuaciones Diferenciales - Solución NuméricaDocumento4 páginasMétodo de Euler. Ecuaciones Diferenciales - Solución NuméricaCris AcevedoAinda não há avaliações
- Amplificador Integrador y DerivadorDocumento9 páginasAmplificador Integrador y Derivadorcarlos100% (1)
- Sistemas Trifásicos DesbalanceadosDocumento42 páginasSistemas Trifásicos DesbalanceadosANDRES FELIPE INCHIMA LONGOAinda não há avaliações
- 1 - Ejercicios de MatricesDocumento1 página1 - Ejercicios de MatricesRobert Milton Vasquez VallejosAinda não há avaliações
- Informe TridilosaDocumento30 páginasInforme TridilosaYasuhiro Arias100% (3)
- Lista de CotejoDocumento4 páginasLista de CotejoMonicaAinda não há avaliações
- Proyecto 1Documento16 páginasProyecto 1Carlos CordobaAinda não há avaliações
- Clasificacion de Las MatricesDocumento3 páginasClasificacion de Las MatricesHebert AlvareezAinda não há avaliações
- 01 Expresiones Algebraicas Álgebra Segundo de SecundariaDocumento5 páginas01 Expresiones Algebraicas Álgebra Segundo de SecundariaCesar AnguloAinda não há avaliações
- Ensayo de Compresión de Cubos de MorteroDocumento3 páginasEnsayo de Compresión de Cubos de MorteroJulio Giron100% (2)
- Informe MaquinasDocumento5 páginasInforme MaquinasMarisol Medina100% (1)
- Máquinas TérmicasDocumento9 páginasMáquinas TérmicasAlexis Argoti100% (1)
- Trabajo de InvestigacionDocumento9 páginasTrabajo de InvestigacionJorge Luis Tuya ZambranoAinda não há avaliações
- Congelamiento de PlátanosDocumento10 páginasCongelamiento de PlátanosAnonymous Q0RE1QlhaRAinda não há avaliações
- Tres Colores AzulDocumento4 páginasTres Colores AzulGeorge CareAinda não há avaliações