Escolar Documentos
Profissional Documentos
Cultura Documentos
Azeótropo
Enviado por
Jorge LuizDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Azeótropo
Enviado por
Jorge LuizDireitos autorais:
Formatos disponíveis
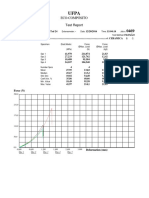
Azetropo uma mistura de duas ou mais substncias que, a uma certa composio, possui um ponto de ebulio constante e fixo,
, como se fosse uma substncia pura, no podendo, por isso, seus componentes serem separados por processo de destilao simples.[1] Principio Misturas comuns no tm ponto de ebulio constante, mas sim uma faixa de temperaturas na qual ocorre a mudana de fase, e nesse sentido o azetropo diferente, pois seu ponto de ebulio fixo. Este pode ferver a uma temperatura inferior, intermediria ou superior s temperaturas dos componentes da mistura quando puros. Quando inferior, chama-se azetropo de mnimo ponto de ebulio ou azetropo negativo. Quando superior, azetropo de mximo ponto de ebulio ou azetropo positivo. Isto se deve por desvios da lei de Raoult, que ocorrem por causa das fortes foras de atrao entre as molculas do composto. No desvio negativo, a atrao entre molculas diferentes so mais fortes do que nas iguais, e no positivo, a fora de atrao das molculas dos componentes so mais fracas do que entre molculas idnticas[2]. Outra caracterstica de um azetropo que a composio do lquido azetropo e do vapor em equilbrio com tal lquido a mesma. Por exemplo, se um azetropo composto de duas substncias, A e B, com propores respectivas de 60% e 40%, quando vaporizado resulta em um vapor com os mesmos 60% de A e 40% de B. Um exemplo comum de azetropo a mistura de lcool etlico a 95% e gua. O ponto de ebulio desse azetropo de 78,2 C. Compare com os pontos de ebulio da gua e do lcool etlico puros: Ponto de
Substncia gua pura lcool etlico puro lcool etlico (95%) / gua
ebulio (C) 100 78,4 78,2
A maior parte dos azetropos so azetropos de mnimo, formado geralmente por substncias imiscveis.
Na figura acima, existem diagramas T-x de trs misturas binrias. O grfico esquerda de uma mistura ideal de A e B, sem formao de azetropo, com as linhas de lquido e vapor saturados variando desde a temperatura de ebulio de A, a mais baixa, at a de B, a mais alta. O grfico central de uma mistura binria de C e D que forma um azetropo de mnimo. Veja que a temperatura no azetropo menor do que as temperaturas de ebulio de C e de D quando puros. O grfico direita de uma mistura binria E e F que forma um azetropo de mximo. A temperatura no azetropo maior do que as temperaturas de ebulio de E e F quando puros. Quebra do azetropo Quando, por meio de tcnicas especiais, consegue-se a purificao de um azetropo, chama-se tal fato de quebra do azetropo. Um azetropo no pode ser purificado por destilao comum. Veja em destilao azeotrpica para saber como quebr-lo. A destilao azeotrpica um processo de separao realizado quando a mistura contendo os componentes que precisam ser separados forma um azetropo ou apresentam baixa volatilidade relativa.[1] Em um dos processos, um componente chamado componente de arraste adicionado mistura original, formando um novo azetropo que deve ser do tipo heterogneo, ou seja, deve ocorrer a formao de duas fases lquidas. Normalmente utiliza-se a montagem do tipo Dean-Stark[2]. O novo azetropo formado retirado no topo (azetropo de mnimo) ou no fundo (azetropo de mximo ponto de ebulio) da coluna de destilao, enquanto que um dos componentes da mistura original obtido puro na outra extremidade da coluna. Uma segunda coluna deve ser utilizada para realizar a separao do componente de arraste. Outro mtodo de "quebra" do azetropo se baseia no fato que a composio deste depende da presso na qual feita a destilao, ou seja, deve-se mudar a presso na qual feita a destilao da mistura para alterar a sua composio.
Exemplos O lcool etlico e a gua formam um azetropo que possui 95,6 % de lcool. A adio de benzeno a mistura forma um outro azetropo que permite obter lcool anidro. Devido ao fato do benzeno ser txico e carcinognico, ele tem sido substitudo por outras substncias, tais como etilenoglicol, n-hexano, dentre outras. O cido clordrico forma um azetropo com a gua que possui cerca de 21% de HCl presso ambiente de 1 bar. Destilao a uma presso diferente pode ser percebida pela titulao do destilado. Referncias Kister, Henry Z.. Distillation Design. 1st Edition ed. [S.l.]: McGraw-Hill, 1992. ISBN 0-07-034909-6 Soares, Bluma Guenther; Souza, Nelson ngelo; Pires, Dario Xavier. Qumica Orgnica: Teoria e Tcnicas de Preparao, Purificao e Identificao de Compostos Orgnicos, Rio de Janeiro: Editora Guanabara S.A., 1988
Você também pode gostar
- Caracterização ArgilaDocumento1 páginaCaracterização ArgilaJorge LuizAinda não há avaliações
- Normas TCC FACET UFPADocumento11 páginasNormas TCC FACET UFPAAlexandre CesarAinda não há avaliações
- Grafico de Controle JorgeDocumento1 páginaGrafico de Controle JorgeJorge LuizAinda não há avaliações
- Quimica NaturezaDocumento70 páginasQuimica NaturezaquimicaleandroAinda não há avaliações
- Como Tirar o Virus Autorun e Recycler Do PenDocumento1 páginaComo Tirar o Virus Autorun e Recycler Do PenJorge LuizAinda não há avaliações
- Estrutura Laticínio Produção ManteigaDocumento4 páginasEstrutura Laticínio Produção ManteigaJorge LuizAinda não há avaliações
- 10-Termo Compro Kit AcadDocumento2 páginas10-Termo Compro Kit AcadJorge LuizAinda não há avaliações
- Apostila TaekwondoDocumento127 páginasApostila TaekwondoDudu Gomes100% (1)
- Relatório 10Documento5 páginasRelatório 10Jorge LuizAinda não há avaliações
- Cinetica AdrianoDocumento1 páginaCinetica AdrianoJorge LuizAinda não há avaliações
- Análise GravimétricaDocumento11 páginasAnálise GravimétricaJorge LuizAinda não há avaliações
- Prosab - Reatores AnaeróbiosDocumento406 páginasProsab - Reatores AnaeróbiosMario Foco Foca100% (2)
- Caracterização de CarbetosDocumento10 páginasCaracterização de Carbetosz DrakAinda não há avaliações
- Tratamento do sorriso gengival com toxina botulínicaDocumento7 páginasTratamento do sorriso gengival com toxina botulínicaIury CarvalhoAinda não há avaliações
- Química 12a Classe Exame Final 1a ChamadaDocumento4 páginasQuímica 12a Classe Exame Final 1a ChamadaEmanuel SemoAinda não há avaliações
- Lista de Exercicios....Documento3 páginasLista de Exercicios....RomeuComastriAbdalaAinda não há avaliações
- Microbiologia e Imunologia BacterianaDocumento44 páginasMicrobiologia e Imunologia BacterianaTarcizio FilhoAinda não há avaliações
- Ondas eletromagnéticas e suas propriedadesDocumento4 páginasOndas eletromagnéticas e suas propriedadesPatrik Lanes100% (2)
- Processos de produção de aço em usinas siderúrgicasDocumento210 páginasProcessos de produção de aço em usinas siderúrgicasDanilo HoskenAinda não há avaliações
- Física 1 - Prova 2 de 27/10/2018Documento5 páginasFísica 1 - Prova 2 de 27/10/2018Ana Beatriz SantanaAinda não há avaliações
- Os segredos para estudar e se preparar para provasDocumento114 páginasOs segredos para estudar e se preparar para provasVinícius Morais BredaAinda não há avaliações
- Norma Petrobras N1374Documento9 páginasNorma Petrobras N1374xataraAinda não há avaliações
- Cristalóides x ColóidesDocumento18 páginasCristalóides x ColóidesSarah Sella Langer100% (1)
- A História da Cal e seu Papel nas CivilizaçõesDocumento6 páginasA História da Cal e seu Papel nas CivilizaçõesCássio MuriloAinda não há avaliações
- Minitestes Biologia CelularDocumento9 páginasMinitestes Biologia CelularJOAO FRANCISCOAinda não há avaliações
- Execução e Acabamento Do Concreto Projetado - Especificação de Serviço.Documento11 páginasExecução e Acabamento Do Concreto Projetado - Especificação de Serviço.mdrygallaAinda não há avaliações
- Resistencia Ao FogoDocumento16 páginasResistencia Ao FogolubakyAinda não há avaliações
- Microstrip Line: Tecnologia de Linhas de Transmissão em Circuito ImpressoDocumento16 páginasMicrostrip Line: Tecnologia de Linhas de Transmissão em Circuito ImpressoCandice TerrellAinda não há avaliações
- Apostila Bactérias Microbiologia 18 1Documento9 páginasApostila Bactérias Microbiologia 18 1grazielastabileAinda não há avaliações
- Problemas Intrínsecos e Graves Da Expansão Mineral, Metalúrgica, Petrolífera, e Hidrelétrica Nas Amazônias - A. Oswaldo Sevá FoDocumento28 páginasProblemas Intrínsecos e Graves Da Expansão Mineral, Metalúrgica, Petrolífera, e Hidrelétrica Nas Amazônias - A. Oswaldo Sevá FoVivian PradoAinda não há avaliações
- Células e Material GenéticoDocumento15 páginasCélulas e Material GenéticoNatane S. GomesAinda não há avaliações
- TrabalhoDocumento4 páginasTrabalhoVictoria Rabelo FerrazAinda não há avaliações
- RDC N 08 2013 Aditivos Frutas e VegetaisDocumento18 páginasRDC N 08 2013 Aditivos Frutas e VegetaisLucas YokoyamaAinda não há avaliações
- Teste 9ºano CN 2 CorrecçãoDocumento4 páginasTeste 9ºano CN 2 CorrecçãoRita CardosoAinda não há avaliações
- Aula 1 - Propriedades Físicas Dos Fluidos e Sistemas de UnidadesDocumento16 páginasAula 1 - Propriedades Físicas Dos Fluidos e Sistemas de UnidadesvicentenetokindleAinda não há avaliações
- Apontamentos Hidrologia PDFDocumento143 páginasApontamentos Hidrologia PDFShirley100% (1)
- 6 Pop Fracionamento de Medicamentos PDFDocumento4 páginas6 Pop Fracionamento de Medicamentos PDFSandro PinheiroAinda não há avaliações
- H-A2FO-Bombas-HidráulicasDocumento78 páginasH-A2FO-Bombas-HidráulicasTadeu CascaAinda não há avaliações
- Química Orgânica Apostila 1Documento8 páginasQuímica Orgânica Apostila 1SamuelAinda não há avaliações
- Destilação fracionada mais eficiente para separar diclorometano e toluenoDocumento2 páginasDestilação fracionada mais eficiente para separar diclorometano e toluenoBrenda SilvaAinda não há avaliações
- Química Ambiental - Recursos HídricosDocumento50 páginasQuímica Ambiental - Recursos HídricosClayton05100% (1)