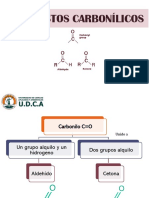
Escolar Documentos
Profissional Documentos
Cultura Documentos
Constantes de Disociacion para Acidos y Bases
Enviado por
Daniel E. CifuentesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Constantes de Disociacion para Acidos y Bases
Enviado por
Daniel E. CifuentesDireitos autorais:
Formatos disponíveis
1.
- CONSTANTES DE DISOCIACIN PARA CIDOS Y BASES
EQULIBRIOS ACIDO-BASE Se han expuesto diversas teoras para explicar las teoras acido-base de las substancias en agua y otros disolventes. Para los sistemas acuosos, las teoras de Arrenihus y de Bronsted explican adecuadamente el comportamiento de cidos bases .en la teora de Arrenihus un acido es cualquier sustancia que se ioniza (parcial o totalmente) en agua producindose de hidrogeno (que se asocian con el disolvente para dar iones hidronio H3 O+): HA + H 2 O H 3 O+ + A- . Una base se ioniza en agua para dar iones hidroxilo. Por lo general las bases dbiles (parcialmente ionizadas) se ionizan de la siguiente manera: B + H 2 O BH+ + OHLas bases fuertes, como los hidrxidos metlicos se disocian as: M (OH)n Mn + nOHUn acido es cualquier sustancia que pueda ceder un protn y base es cualquier sustancia que pueda aceptar un protn, por lo tanto un acido se ioniza produciendo un protn y una base: Acido = H+ + base. La pareja acido y base de la reaccin de iotizacin recibe el nombre de par conjugado, es decir, la base es la base conjugada del acido o viceversa, el acido es el acido conjugado de la base. EQUILIBRIOS ACIDO BASE EN AGUA De lo anterior se deduce que cuando un acido o base se disuelven en agua, este se disocia o ioniza y la cantidad de ionizacion depender de la fuerza de el acido, los electrolitos fuertes se ionizan totalmente, mientras que los electrolitos dbiles se ionizan parcialmente. En la siguiente tabla se presentan los electrolitos ms comunes, algunos de los cuales son fuertes y otros dbiles. FUERTE DEBIL HCl HClO4 H2SO4 a HNO3 NaOH NaC2H3O2 HC2 H3 O2 (acido actico) NH3 C6H5OH (fenol) HCHO2 (acido formico) C6H5NH2 (anilina)
Una vez disociados, los cationes o aniones de sales pueden reaccionar con agua; por ejemplo: el anion acetato del acetato disociado. El acido clorhdrico es un acido fuerte, y su ionizacion es total: HCl + H 2 O H3O+ + ClEl protn H+ existe en agua como ion hidratado, el ion hidronio H3O+, probablemente existan hidratos superiores, sobretodo H9 O4+, pero la mayora son monohidratos. El acido actico es un acido dbil, que se ioniza parcialmente: HOAc + H2O H3O+ + OAc-
La constante de equilibrio para la reaccin anterior es: K=
aH O+
3
OAC
a HOAC a H 2O
En donde K es la constante de acidez y a es la actividad de la especie que se indica. La actividad representa la concentracin efectiva de un ion: se define como sigue: ai = fi [ Ci ] En donde Ci es la concentracin molar de ion i y f1 es el coeficiente de actividad del ion. El coeficiente de actividad varia segn el numero total de iones en solucin , por ejemplo en solucin diluida 10-3 M , el coeficiente de actividad de un electrolito nico ser cercano a la unidad, y la actividad ser aproximadamente igual a la molaridad al aumentar la concentracin de un electrolito , el coeficiente de actividad suele disminuir y la actividad se hace menor que la molaridad , los efectos de los protones de las reacciones estn determinados por sus actividades y estas se miden usando el pH metro. En soluciones diluidas la actividad del agua permanece prcticamente constante, por tanto puede incorporarse en K representndose as: Ka =
a H 3O aOAc a HOAC
El agua pura se ioniza levemente, o experimenta autoprotolisis: 2H2O H3O+ + OHLa constante de equilibrio para la ecuacin es: K=
a H O + aOH
3
a 2 H 2O + aOH
Nuevamente la actividad del agua es constante en soluciones diluidas, por tanto: Kw = a a H 3O
En donde Kw es la constante de autoprotolisis o autoionizacin. Los clculos se hacen ms sencillos cuando no se toman en cuenta los coeficientes de actividad. Esta simplificacin provoca errores leves en soluciones diluidas; por tanto en todos los clculos se usaran las concentraciones molares. Esto ilustrara de manera satisfactoria los equilibrios que se establecen ; la mayora de las soluciones que se emplearan sern bastante diluidas y tambin se simplificaran las expresiones empleando H+ en ves de H3O+ . La concentracin molar se representara con un parntesis [ ] encerrando las especies. Las ecuaciones simplificadas para las reacciones anteriores son : HClH+ + ClHOAc H+ + OAc-
[ H + ][OAc ] Ka = [ HOAc]
H2O H+ + OHKw = [H+][OH-]
A 250c , Kw =1.0 + 10-14 , el producto de la concentracin de iones hidrogeno y la concentracin de ion hidroxilo en solucin acuosa siempre es igual a 1.0 x 10-14 a temperatura ambiente.
[H+][OH-] =1.0 X 10-14 Por tanto, en agua pura la concentracin de esas dos especies es igual ya que no hay otras fuentes de H+ OH- , excepto la disociacin del H2O : [H+] = [OH-] Por tanto: [H+][H+] = 1.0 x 10-14 [H+] = 1.0 x 10-7 M [OH-] Si se aade cido al agua , la concentracin de iones de hidroxilo se puede calcular si se conoce la concentracin de iones de hidrogeno del acido , exceptuando los casos en que la concentracin de ion hidrogeno del acido es muy baja , 10-6 M o menor , no es necesario tomar en cuenta la contribucin de [H+] procedente de la ionizacion del agua.
LA ESCALA DEL pH La concentracin de H+ u OH- en soluciones acuosas puede variar ampliamente , desde 1 M o ms , hasta 10-14 M o menos. Sera muy difcil trazar una grfica de la concentracin de H+ , con relacin de alguna variable en caso de que la concentracin cambiase, por ejemplo, de 10-1 M a 10-13 M , este rango de variacin es comn en las titulaciones, por lo cual es mas conveniente abreviar la escala de acidez expresndola mediante logaritmos , el pH de una solucin se expresa as : pH= log [H+] Se usa el signo menos porque la mayora de las concentraciones encontradas suelen ser menores de 1 M , y este signo da un numero positivo ( mas estrictamente , el pH se define como loga H+ , pero se empleara la definicin mas sencilla que es la anterior) en general , p de cualquier cosa es igual a loga H+ , en general , p de cualquier cosa es igual log de cualquier cosa , y este mtodo de representacin se empleara exclusivamente para otros nmeros que pueden variar ampliamente.
Para la concentracin de iones hidroxilo; puede emplearse una expresin semejante: pOH = -log [ OH- ] La ecuacin anterior se emplea para calcular la concentracin de iones hidroxilo cuando se conoce la concentracin de iones hidrgeno y viceversa. La ecuacin en forma logartmica para calcular ms directamente el pH pOH es la siguiente: - log KW = - log [H+ ] [OH- ] = -log [ H+ ] log [ OH- ] pKW = pH + Poh 14.00 = pH + Poh La concentracin de iones de hidrogeno en agua pura es de 10-7 M y el pH del agua es 7, por tanto, el pH de 7 es neutro , los valores de pH mayores son alcalinos y los valores de pH menores son cidos, puede decirse lo contrario para los valores de pOH ; el pOH de 7 tambin es neutro . Obsrvese que el producto de [H+] y [OH-] siempre es 10-14 a 250c y la suma de pH y pOH es siempre 14. El pH negativo significa que la concentracin de ion hidrgeno es mayor a 1M. En la prctica es poco comn encontrar pH negativos ya que an los cidos fuertes pueden estar parcialmente no disociados a concentraciones elevadas, adems se encuentra el concepto de actividad que a 25C
no se tiene en cuenta en las soluciones diluidas. Como en realidad el pH es logaritmo aH+ (cantidad que se mide con el pH metro), puede tenerse [H+] 1.5M, pero el pH puede ser positivo por que la actividad es menor de 1.0M. Esto se debe a que a concentraciones tan elevadas el coeficiente de actividad es menor que la unidad. No obstante, matemticamente no existen fundamentos para negar la existencia de los pH negativos (o pOH negativos), aunque casi nunca se observen en las soluciones analticas. En todo lo anterior en cuento a clculos nos referimos a cidos y bases fuertes. CIDOS Y BASES DBILES: Algunos electrlitos solubles manifiestan las propiedades de sus iones slo en una pequea extencin, debido a la pequea concentracin de sus iones. Los cidos y bases dbiles se ionizan slo parcialmente y puede emplearse la constante de ionizacin para calcular la cantidad ionizada y a partir de ella el pH. Por ejemplo: Las constantes de disociacin para cidos dbiles se representan como:
Ka =
[ H + ][ A ] [ HA]
En donde Ka es la constante de disociacin cida para el cido dbil. De igual manera la constante de disociacin bsica (hidrlisis de una base) para un cido dbil es:
Kb =
[ HA][OH ] [ A ]
Ntese que en ninguna de las dos ecuaciones aparece [H2O] ya que la concentracin del agua es muy grande en relacin con la concentracin del los cidos y bases dbiles, por lo que la disociacin no altera apreciablemente [H2O]. Igual que la derivacin de la constante del producto inico del agua, se incorpora en las constantes de equilibrio Ka y Kb.
2.- CONSTANTES DE DISOCIACIN PARA CIDOS Y BASES CONJUGADOS
Considrese la expresin de la constante de disociacin para el amoniaco y la expresin de la constante de disociacin para su cido conjugado, el ion amonio: NH3 + H2O NH4+ + OH-
Kb =
+ [ NH 4 ][OH ] [ NH 3 ]
NH + H2O NH3 + H3O
+ 4
[ NH 3 ][ H 3O + ] Ka = + [ NH 4 ]
Al multiplicar ambas constantes de disociacin se obtiene:
Ka Kb =
+ [ NH 3 ][ H 3O + ] NH 4 OH = H 3O + OH + [ NH 3 ] NH 4
][
] [
][
Pero :
KW = [ H3O+ ] [ OH- ]
Por lo tanto:
KW = KaKb
Esta relacin es general para todos los pares cido base conjugados. Muchas recopilaciones de datos de constantes de equilibrio slo incluyen las constantes de disociacin cidas ya que con la ecuacin anterior es fcil calcular las constantes de disociacin bsicas. Ejemplo: NH4 + H2O NH3 + H3O
+ +
Ka =
[ NH 3 ][ H 3O + ] = 5.70 10 10 + [ NH 4 ]
Y se puede escribir
NH3 + H2O NH4+ + OH-
Kb =
[ NH 4+ ][OH ] 1.00 10 14 = = 1.75 10 15 [ NH 3 ] 5.70 10 10
BIBLIOGRAFA: CHRISTIAN, GARY D. Qumica Analtica, 2 edicin, editorial LIMUSA, Mxico 1993. pp. 227-224 SKOOG DOUGLAS A. etal . Qumica Analtica, 7 edicin, editorial Mc Graw Hill, Mxico D.F. 2004. pp. 95-96
Você também pode gostar
- ProteínasDocumento2 páginasProteínasdisotomoreraAinda não há avaliações
- Determinaciones de Hierro y Calcio Por PermanganimetriaDocumento15 páginasDeterminaciones de Hierro y Calcio Por PermanganimetriaRomy ArenazasAinda não há avaliações
- Análisis Funcional Organico TerminadooDocumento24 páginasAnálisis Funcional Organico TerminadooLuisa Balderas100% (1)
- Esteres y Epoxidos - Reacciones (Pag33)Documento55 páginasEsteres y Epoxidos - Reacciones (Pag33)Jesus Dario Barrientos Coy100% (2)
- Informe Aislamiento de Glucógeno, Hidrólisis e Identificación de GlucosaDocumento6 páginasInforme Aislamiento de Glucógeno, Hidrólisis e Identificación de GlucosaJose Alfredo SanchezAinda não há avaliações
- Ligados AmbidentadosDocumento46 páginasLigados AmbidentadosLuz Marina Mollinedo ChiqueAinda não há avaliações
- Metodo de Analisis GravimetricoDocumento9 páginasMetodo de Analisis GravimetricoMikuito Angel Sanchez LopezAinda não há avaliações
- Cuestionario Lab 7Documento3 páginasCuestionario Lab 7Elvis Cocho100% (1)
- Reporte 1, Exactitud, Precisión y RepetibilidadDocumento11 páginasReporte 1, Exactitud, Precisión y RepetibilidadShanti Ramakrishna LoaizaAinda não há avaliações
- Examen Parcial Quimica Analitica 2020 - 2Documento2 páginasExamen Parcial Quimica Analitica 2020 - 2Alison Jhennifer CruzattAinda não há avaliações
- Metodo EdmanDocumento14 páginasMetodo EdmanFrancisco Alejandro Torres GarciaAinda não há avaliações
- Resumen Aldehídos y CetonasDocumento16 páginasResumen Aldehídos y CetonasCeleste HernándezAinda não há avaliações
- Repaso Aldehidos y CetonasDocumento50 páginasRepaso Aldehidos y CetonasJonathan Herrera PerezAinda não há avaliações
- Cationes Del Grupo II BDocumento10 páginasCationes Del Grupo II BNicolas MacasAinda não há avaliações
- Disolución y DisgregaciónDocumento8 páginasDisolución y DisgregaciónAndres LaufgangAinda não há avaliações
- ReaccionesDocumento7 páginasReaccionesNorberto Barragan DíazAinda não há avaliações
- Volumetrías RedoxDocumento2 páginasVolumetrías RedoxArnoldFabrizioMullisacaAinda não há avaliações
- Mecanismo Del Proceso de Saponificación de ÉsteresDocumento31 páginasMecanismo Del Proceso de Saponificación de ÉsteresPedro Gerardo Trejo Flores50% (2)
- Reacciones Vía Carbanión-EnolatoDocumento29 páginasReacciones Vía Carbanión-EnolatoJuan Jay CasalAinda não há avaliações
- Primer Examen Parcial Quimica Analitica 2020 1 PDFDocumento1 páginaPrimer Examen Parcial Quimica Analitica 2020 1 PDFMARIANA ALVAREZ RESTREPOAinda não há avaliações
- Qa Ibq3 Equipo#2 Pract#8 Co3 y Hco3Documento9 páginasQa Ibq3 Equipo#2 Pract#8 Co3 y Hco3Diana RomoAinda não há avaliações
- Extracción de La CafeínaDocumento9 páginasExtracción de La CafeínaRubén Gonzalo UsnayoAinda não há avaliações
- U3b MicroorganismosQuimiolitotrofos 20149 PDFDocumento26 páginasU3b MicroorganismosQuimiolitotrofos 20149 PDFIngJesusGutierrezZenilAinda não há avaliações
- Determinación Cuantitativa de CarbohidratosDocumento2 páginasDeterminación Cuantitativa de CarbohidratosMateo GomezAinda não há avaliações
- Azucares ReductoresDocumento3 páginasAzucares ReductoresJuan Chirinos AcuñaAinda não há avaliações
- Lab #3 Metodo de HittorfDocumento4 páginasLab #3 Metodo de HittorfMarco Fidel Mosquera Ramirez100% (1)
- UNIDAD 5 - Qca - Analitica I - IngDocumento17 páginasUNIDAD 5 - Qca - Analitica I - IngJuan Pablo Sará FoncecaAinda não há avaliações
- Informe N°05 de Química OrgánicaDocumento20 páginasInforme N°05 de Química OrgánicaEda Erika AlfaroAinda não há avaliações
- BenzofenonaDocumento18 páginasBenzofenonadominicAinda não há avaliações
- 3 Reacciones en Solucion Acuosa PDFDocumento54 páginas3 Reacciones en Solucion Acuosa PDFlaura garciaAinda não há avaliações
- Cationes 3Documento9 páginasCationes 3Alex Quispe CAinda não há avaliações
- Facultad de Ciencias: Título de La Práctica de LaboratorioDocumento7 páginasFacultad de Ciencias: Título de La Práctica de LaboratorioLaura Valentina Coral OcampoAinda não há avaliações
- PRACTICA #III Grupos FuncionalesDocumento6 páginasPRACTICA #III Grupos FuncionalesLina BeltranAinda não há avaliações
- AcetonaDocumento13 páginasAcetonaMiriam Llanque CallisayaAinda não há avaliações
- Reconocimiento de AlcoholesDocumento31 páginasReconocimiento de AlcoholesBenilde Rojas Ibarra0% (1)
- Limite de Detección Cu+2Documento13 páginasLimite de Detección Cu+2Lolo WestAinda não há avaliações
- Laboratorio Qaii Práctica6Documento8 páginasLaboratorio Qaii Práctica6Rushwalker :3Ainda não há avaliações
- Guia RedoxDocumento3 páginasGuia RedoxMatii VegaAinda não há avaliações
- Guia Practica 8, Volumetría Óx-Red, Determinacion Vitamina C I - 2023Documento11 páginasGuia Practica 8, Volumetría Óx-Red, Determinacion Vitamina C I - 2023Arce Rojas KatherinAinda não há avaliações
- Guia3.Lab VirtualDocumento4 páginasGuia3.Lab VirtualJennifer GallegoAinda não há avaliações
- Cerimetria 141124225006 Conversion Gate01Documento7 páginasCerimetria 141124225006 Conversion Gate01andres arteagaAinda não há avaliações
- EstequiometríaDocumento2 páginasEstequiometríaquimica_introduccionAinda não há avaliações
- Eteres y Compuestos Azufrados Aplicaciones Industriales PDFDocumento31 páginasEteres y Compuestos Azufrados Aplicaciones Industriales PDFrobrt2aAinda não há avaliações
- Práctica 1 - Etapa 1Documento5 páginasPráctica 1 - Etapa 1Isabel LópezAinda não há avaliações
- Pasar inDocumento3 páginasPasar inAlexander LeónAinda não há avaliações
- PermanganometriaDocumento7 páginasPermanganometriaJennifer MacaAinda não há avaliações
- Informe de Laboratorio 3Documento8 páginasInforme de Laboratorio 3Kinesis lduAinda não há avaliações
- Prueba de HaloformoDocumento2 páginasPrueba de Haloformoel b pesAinda não há avaliações
- Yodometria y Permanganimetria - CARLOS ANTONIO PROMOTOR RODRIGUEZ - 200520Documento4 páginasYodometria y Permanganimetria - CARLOS ANTONIO PROMOTOR RODRIGUEZ - 200520CARLOS ANTONIO PROMOTOR RODRIGUEZAinda não há avaliações
- Practica 3Documento3 páginasPractica 3jonatan_contreras93Ainda não há avaliações
- Características Químicas de Los Carbohidratos..Documento7 páginasCaracterísticas Químicas de Los Carbohidratos..Juan Sebastian BobadillaAinda não há avaliações
- Clasificación de Los LigandosDocumento2 páginasClasificación de Los LigandosDanielaPayaresN100% (3)
- Reacciones de Alquinos PDFDocumento2 páginasReacciones de Alquinos PDFKarla DelgadoAinda não há avaliações
- Determinacion de Humedad y Cenizas Informe #3Documento5 páginasDeterminacion de Humedad y Cenizas Informe #3Angelica Aponte MejiaAinda não há avaliações
- Informe LaboDocumento5 páginasInforme LaboMacarena VegaAinda não há avaliações
- CONFÓRMEROSDocumento24 páginasCONFÓRMEROSPriscila CruzAinda não há avaliações
- Titulaciones ArgentométricasDocumento4 páginasTitulaciones Argentométricasnata fallaAinda não há avaliações
- 12º Semana 2013-1, SOLUCION BUFFERDocumento36 páginas12º Semana 2013-1, SOLUCION BUFFERSarii Gonzales EspinozaAinda não há avaliações
- Acido y BaseDocumento63 páginasAcido y Basedarkwolf1003Ainda não há avaliações
- Equilibrio Homogéneo Parte 1Documento11 páginasEquilibrio Homogéneo Parte 1Dino P MoralesAinda não há avaliações
- Prueba de Elisa para La Deteccion de Ab Contra El Tripanosoma CruziDocumento10 páginasPrueba de Elisa para La Deteccion de Ab Contra El Tripanosoma Cruzi.:("*"BLacK BuLLeT"*"):.Ainda não há avaliações
- Viabilidad CelularDocumento8 páginasViabilidad Celular.:("*"BLacK BuLLeT"*"):.Ainda não há avaliações
- Prueba Usr para La Detección de T. PallidiumDocumento3 páginasPrueba Usr para La Detección de T. Pallidium.:("*"BLacK BuLLeT"*"):.Ainda não há avaliações
- Cultivo de Linfocitos de Sangre PeriféricaDocumento11 páginasCultivo de Linfocitos de Sangre Periférica.:("*"BLacK BuLLeT"*"):.89% (18)
- 3b. - Alelos MultiplesDocumento6 páginas3b. - Alelos Multiples.:("*"BLacK BuLLeT"*"):.71% (7)
- Prueba de Elisa para La Deteccion de Vih Tipo 1 y 2Documento9 páginasPrueba de Elisa para La Deteccion de Vih Tipo 1 y 2.:("*"BLacK BuLLeT"*"):.100% (1)
- Interpretación de La Reaccion en Cadena de La PolimerasaDocumento7 páginasInterpretación de La Reaccion en Cadena de La Polimerasa.:("*"BLacK BuLLeT"*"):.100% (3)
- Temas Selectos de InmunologíaDocumento31 páginasTemas Selectos de Inmunología.:("*"BLacK BuLLeT"*"):.100% (2)
- Extraccion de DNA Con DNAzolDocumento5 páginasExtraccion de DNA Con DNAzol.:("*"BLacK BuLLeT"*"):.100% (1)
- Determinacion Cuantitativa de Creatinina en SueroDocumento12 páginasDeterminacion Cuantitativa de Creatinina en Suero.:("*"BLacK BuLLeT"*"):.100% (8)
- Induccion de La Respuesta InmuneDocumento26 páginasInduccion de La Respuesta Inmune.:("*"BLacK BuLLeT"*"):.100% (1)
- Determinación Cuantitativa de Glucosa en SueroDocumento10 páginasDeterminación Cuantitativa de Glucosa en Suero.:("*"BLacK BuLLeT"*"):.90% (21)
- Cromatina X de La Mucosa BucalDocumento4 páginasCromatina X de La Mucosa Bucal.:("*"BLacK BuLLeT"*"):.Ainda não há avaliações
- Determinacion Cuantitativa de Urea en SueroDocumento13 páginasDeterminacion Cuantitativa de Urea en Suero.:("*"BLacK BuLLeT"*"):.86% (28)
- Métodos Estadisticos en Analisis ClinicosDocumento9 páginasMétodos Estadisticos en Analisis Clinicos.:("*"BLacK BuLLeT"*"):.Ainda não há avaliações
- Identificación Del Nucleo CelularDocumento8 páginasIdentificación Del Nucleo Celular.:("*"BLacK BuLLeT"*"):.75% (4)
- Mitosis y MeiosisDocumento8 páginasMitosis y Meiosis.:("*"BLacK BuLLeT"*"):.100% (4)
- Celulas Implicadas en La InmunidadDocumento16 páginasCelulas Implicadas en La Inmunidad.:("*"BLacK BuLLeT"*"):.100% (3)
- FABRICACIÓN DE CÁPSULAS DE CLORFENIRAMINA MALEATO 4 MGDocumento12 páginasFABRICACIÓN DE CÁPSULAS DE CLORFENIRAMINA MALEATO 4 MG.:("*"BLacK BuLLeT"*"):.50% (2)
- Introduccion A La InmunologíaDocumento13 páginasIntroduccion A La Inmunología.:("*"BLacK BuLLeT"*"):.100% (1)
- Formación de CumarinaDocumento6 páginasFormación de Cumarina.:("*"BLacK BuLLeT"*"):.100% (3)
- AntígenoDocumento3 páginasAntígeno.:("*"BLacK BuLLeT"*"):.100% (1)
- Formación de PirazolesDocumento6 páginasFormación de Pirazoles.:("*"BLacK BuLLeT"*"):.100% (13)
- Formación de PiridinasDocumento8 páginasFormación de Piridinas.:("*"BLacK BuLLeT"*"):.100% (6)
- Aromatización de DihidropiridinasDocumento6 páginasAromatización de Dihidropiridinas.:("*"BLacK BuLLeT"*"):.0% (1)
- Sintesis de OxiranoDocumento13 páginasSintesis de Oxirano.:("*"BLacK BuLLeT"*"):.100% (1)
- Sistema de Desecación de GranuladosDocumento18 páginasSistema de Desecación de Granulados.:("*"BLacK BuLLeT"*"):.100% (3)
- Formacion de HidantoinasDocumento7 páginasFormacion de Hidantoinas.:("*"BLacK BuLLeT"*"):.89% (9)
- Formación de IsoxazolesDocumento10 páginasFormación de Isoxazoles.:("*"BLacK BuLLeT"*"):.50% (2)
- EnterobacteriaceaeDocumento22 páginasEnterobacteriaceae.:("*"BLacK BuLLeT"*"):.100% (11)