Escolar Documentos
Profissional Documentos
Cultura Documentos
SUBTEMA 1.4.4. Capacidad Calorifica: CP Y CV
Enviado por
Alfredo RicañoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
SUBTEMA 1.4.4. Capacidad Calorifica: CP Y CV
Enviado por
Alfredo RicañoDireitos autorais:
Formatos disponíveis
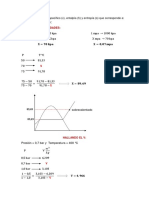
SUBTEMA 1.4.4. CAPACIDAD CALORIFICA: CP Y CV.
La capacidad calorfica de una sustancia es el calor necesario para elevar, en una unidad termomtrica, la temperatura de una unidad de masa de dicha sustancia. En el cuadro siguiente se dan las capacidades calorficas de algunas sustancias.
Capacidad calorfica o calor especfico de algunas sustancias. (a presin constante)
Sustancia Agua Cuerpo humano Etanol Parafina Hielo Vapor Aluminio Vidrio Hierro Cobre Mercurio Plomo Plata
cal/gr C 1.00 0.83 0.55 0.51 0.50 0.46 0.21 0.1-0.2 0.11 0.093 0.033 0.031 0.056
Calores especficos de gases a presin y volumen constantes (Cp y Cv)
Gas Cv Cp Helio 0.75 1.25 Argn 0.075 0.125 Oxgeno 0.155 0.218 Nitrgeno 0.177 0.248 Bixido de 0.153 0.199 Carbono. Agua (a 200 C) 0.359 0.471 Calor especfico de gases a 15C; en cal/grC.
Del cuadro anterior se puede concluir
que la capacidad calorfica o calor especficos de los gases es mayor a presin constante (proceso isobrico) comparado con un proceso a volumen constante (proceso isocrico).
A partir de experimentos se ha observado que
al suministrar la misma cantidad de calor a dos sustancias diferentes, el aumento de temperatura no es el mismo. Por consiguiente, para conocer el aumento de temperatura que tiene una sustancia cuando recibe calor, emplearemos su capacidad calorfica, la cual se define como la relacin existente entre la cantidad de calor Q que recibe y su correspondiente elevacin de temperatura T. C = Q/ T.
Como
el calor puede ser expresado en caloras, kcal, joule, erg o Btu; y la temperatura en C, K, o F; las unidades de la capacidad calorfica pueden ser en: cal/C, kcal/C, J/C, J/K, erg/C, Btu/F. En la determinacin de la capacidad calorfica de una sustancia debe especificarse si se hace a presin o a volumen constante y se indicar de la siguiente manera: Cp si es a presin constante, Cv si es a volumen constante.
La
capacidad calorfica de una sustancia tiene un valor mayor si se lleva a cabo a presin constante, que si es realizada a volumen constante. Toda vez que al aplicar presin constante a una sustancia, sta sufre un aumento en su volumen, lo que provoca una disminucin en su temperatura y, consecuentemente, necesitar ms calor para elevarla.
volumen constante, todo el calor suministrado a la sustancia pasa a aumentar la energa cintica de las molculas, por lo tanto la temperatura se incrementa con mayor facilidad. Es evidente que mientras ms alto sea el valor de la capacidad calorfica de una sustancia, requiere mayor cantidad de calor para elevar su temperatura.
Puesto que la capacidad calorfica de una
sustancia es la relacin entre el calor recibido y su variacin de temperatura; si calentamos diferentes masas de una misma sustancia, observaremos que su capacidad calorfica es distinta. Por ejemplo, al calentar dos trozos de hierro, uno de 2 kg y otro de 10 kg, la relacin Q/T = C es diferente entre los dos trozos, aunque se trata de la misma sustancia.
Você também pode gostar
- Calor EspecificoDocumento18 páginasCalor Especificoamigot380% (10)
- Capacidad Calorifica de Los GasesDocumento18 páginasCapacidad Calorifica de Los GasesJose Ronald CondoriAinda não há avaliações
- Calor EspecificoDocumento9 páginasCalor EspecificoROGER IVAN CCENTE ANCCASIAinda não há avaliações
- Calor Latente y Calor SensibleDocumento22 páginasCalor Latente y Calor SensibleANAAinda não há avaliações
- Calor Específico - EcuRed PDFDocumento3 páginasCalor Específico - EcuRed PDFJulio ReboAinda não há avaliações
- CalorEsp:CtdCaloríaGramoKelvinDocumento3 páginasCalorEsp:CtdCaloríaGramoKelvinJulio ReboAinda não há avaliações
- Rendimiento de Una HornillaDocumento7 páginasRendimiento de Una HornillaKatherinneBlancoCastilloAinda não há avaliações
- Capacidad Calórica, Calor Específico, Calor Sencible y LatenteDocumento40 páginasCapacidad Calórica, Calor Específico, Calor Sencible y LatenteJuan Guerrero MartinezAinda não há avaliações
- Calorimetría para hallar calor específico y calor de reacciónDocumento2 páginasCalorimetría para hallar calor específico y calor de reacciónJaffetGalindoAinda não há avaliações
- Trabajo para Fin de SemanaCALORDocumento7 páginasTrabajo para Fin de SemanaCALORZergiio CarreónAinda não há avaliações
- Calor EspecificoDocumento4 páginasCalor EspecificoJuan Carlos AlquingaAinda não há avaliações
- Determinacion Del Calor Específico de LiquidosDocumento10 páginasDeterminacion Del Calor Específico de LiquidosAnamariaRoblesrivasAinda não há avaliações
- N°10 Calorimetria FisDocumento4 páginasN°10 Calorimetria FisAdriana Sthefany Rodas BarjaAinda não há avaliações
- CalorEspSolidosLiqDocumento4 páginasCalorEspSolidosLiqJuan Carlos AlquingaAinda não há avaliações
- Capacidad CaloríficaDocumento6 páginasCapacidad CaloríficaJulian De La CruzAinda não há avaliações
- Balance de Energia Caloria Calor Especifico y Capacidad CalorificaDocumento4 páginasBalance de Energia Caloria Calor Especifico y Capacidad Calorificamarina190210% (1)
- Informe 1Documento13 páginasInforme 1Juan Contreras PanizoAinda não há avaliações
- Seminario Sobre Uso Racional de La EnergiaDocumento363 páginasSeminario Sobre Uso Racional de La EnergiaMarcela DianaAinda não há avaliações
- Ejercicios TemperaturaDocumento5 páginasEjercicios TemperaturaMonica Hernandez JimenezAinda não há avaliações
- Informe de Laboratorio N°9Documento18 páginasInforme de Laboratorio N°9DiegoAinda não há avaliações
- Calor SensibleDocumento10 páginasCalor SensiblePlays Tonix100% (3)
- CALOR y Temperatura MioDocumento32 páginasCALOR y Temperatura MioSteffi Lok's100% (1)
- Determinación Del Calor Especifico de Un CalorímetroDocumento20 páginasDeterminación Del Calor Especifico de Un CalorímetroJohn Alexander Taquio YangaliAinda não há avaliações
- Medición Del Calor y Cambio de Fase, Karina Sanchez EnzastigaDocumento27 páginasMedición Del Calor y Cambio de Fase, Karina Sanchez EnzastigaRoberto LagunaAinda não há avaliações
- Capacidad Calorífica Molar de Una SustanciaDocumento6 páginasCapacidad Calorífica Molar de Una SustanciaMarlenyAinda não há avaliações
- Practica 2 Capacidad Calorifica de Los SolidosDocumento8 páginasPractica 2 Capacidad Calorifica de Los Solidosjavier33% (3)
- Práctica #1 - Capacidades CaloríficasDocumento7 páginasPráctica #1 - Capacidades CaloríficasDann YlönenAinda não há avaliações
- Practica Nº 02Documento5 páginasPractica Nº 02fernandourielsarAinda não há avaliações
- TP 1-B - Calorimetría-Calor EspecíficoDocumento4 páginasTP 1-B - Calorimetría-Calor EspecíficogabrielbajachAinda não há avaliações
- Term Odin A MicaDocumento46 páginasTerm Odin A MicaAdrian Jose Cabrera ReyesAinda não há avaliações
- Ejercicios Resueltos Quimica CalorimetriDocumento14 páginasEjercicios Resueltos Quimica CalorimetriIsmael Trejo NuñezAinda não há avaliações
- FisicaDocumento27 páginasFisicaJuan Carlos MartínezAinda não há avaliações
- Capacidad Calorífica EspecíficaDocumento3 páginasCapacidad Calorífica EspecíficaAlexis UlcuangoAinda não há avaliações
- Capacidades Caloríficas de La MateriaDocumento4 páginasCapacidades Caloríficas de La MateriaMateo MoreiraAinda não há avaliações
- CALORIMETRIADocumento14 páginasCALORIMETRIAIsmael Trejo NuñezAinda não há avaliações
- Laboratorio 5 Fisica 2 UNIDocumento16 páginasLaboratorio 5 Fisica 2 UNIPercy Kenny Patiño RamosAinda não há avaliações
- CUESTIONARIO - FisicoQuimicaDocumento4 páginasCUESTIONARIO - FisicoQuimicaJose Flores GasparAinda não há avaliações
- Calor EspecíficoDocumento5 páginasCalor EspecíficoJulian Urrea100% (1)
- Lab 02Documento10 páginasLab 02Ŕôňäĺďô Gúzman0% (1)
- Informe de Laboratorio Calor Especifico de Los SolidosDocumento22 páginasInforme de Laboratorio Calor Especifico de Los Solidosretiforme85% (79)
- Calor Especifico de LiquidosDocumento8 páginasCalor Especifico de Liquidos708170Ainda não há avaliações
- Actividad # 6Documento4 páginasActividad # 6FRANCISCO JAVIER FUNDADOR RODRIGUEZAinda não há avaliações
- Informe de Laboratorio Capacidad CalorificaDocumento4 páginasInforme de Laboratorio Capacidad CalorificaBrayan JimenezAinda não há avaliações
- Determinación de la capacidad calorífica de sólidosDocumento11 páginasDeterminación de la capacidad calorífica de sólidosJuan Pablo Cantú GasconAinda não há avaliações
- Capacidad Calorifica de Un SolidoDocumento8 páginasCapacidad Calorifica de Un SolidoEliiana ColónAinda não há avaliações
- Curva calentamiento agua alcohol bencenoDocumento6 páginasCurva calentamiento agua alcohol bencenovanessa villarreal33% (6)
- Curvas de CalentamientoDocumento7 páginasCurvas de CalentamientoLuis Vaca100% (3)
- Informe 8Documento6 páginasInforme 8HenrySolórzanoMartelAinda não há avaliações
- Informe #8 "Determinación de La Capacidad Calorífica de Un Calorímetro y Calores Específicos de Líquidos"Documento12 páginasInforme #8 "Determinación de La Capacidad Calorífica de Un Calorímetro y Calores Específicos de Líquidos"J J Carlos Salazar25% (4)
- CalorimetriaDocumento6 páginasCalorimetriaDaniela Mita JimenezAinda não há avaliações
- Calor específico de sustanciasDocumento17 páginasCalor específico de sustanciasNeLson MenDozaAinda não há avaliações
- C T 4 Temperatura y CalorDocumento3 páginasC T 4 Temperatura y Calorramon martinezAinda não há avaliações
- Termodinamica CalorDocumento6 páginasTermodinamica CalordaianaAinda não há avaliações
- Modelo mecánico molecular de los estados de la materia y su relación con la energía internaDocumento19 páginasModelo mecánico molecular de los estados de la materia y su relación con la energía internaAntonio Montalvo CorreaAinda não há avaliações
- Trabajo de CalorimetriaDocumento16 páginasTrabajo de CalorimetriaParrucho Ecb100% (1)
- Calorimetría y Calor EspecíficoDocumento12 páginasCalorimetría y Calor EspecíficoCamilo MoralesAinda não há avaliações
- Calor, temperatura y cambios de estadoDocumento35 páginasCalor, temperatura y cambios de estadoWalv VerliebtAinda não há avaliações
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108No EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108Ainda não há avaliações
- Eficiencia energética en las instalaciones de calefacción y acs en los edificios. ENAC0108No EverandEficiencia energética en las instalaciones de calefacción y acs en los edificios. ENAC0108Ainda não há avaliações
- Memoria Descriptiva Instalaciones SanitariasDocumento11 páginasMemoria Descriptiva Instalaciones Sanitariascampoalegregranja6Ainda não há avaliações
- Fisica 2Documento19 páginasFisica 2JulianaAinda não há avaliações
- Guia Enlace. SolucionarioDocumento14 páginasGuia Enlace. SolucionarioConstanza Baquedano GonzálezAinda não há avaliações
- Fuerza Gravitacional, Roce y ElásticaDocumento20 páginasFuerza Gravitacional, Roce y ElásticaPaulaAinda não há avaliações
- Concreto ArmandoDocumento21 páginasConcreto ArmandoLuisinho HerreraAinda não há avaliações
- Practica Turbinade GasDocumento4 páginasPractica Turbinade GasJuan Manuel CruzAinda não há avaliações
- Sistemas Aguas-Parámetros-DosificaciónDocumento2 páginasSistemas Aguas-Parámetros-DosificaciónCesar RiscoAinda não há avaliações
- Informe de Equilibrio de Un Cuerpo RigidoDocumento19 páginasInforme de Equilibrio de Un Cuerpo Rigidopedrito100% (1)
- Brochure Quimica Johanleez VazquezDocumento2 páginasBrochure Quimica Johanleez VazquezPablo JesúsAinda não há avaliações
- Diseño de Celdas de Electrocoagulación para Una Empresa Lactea El Pedregal (Grupo 1)Documento29 páginasDiseño de Celdas de Electrocoagulación para Una Empresa Lactea El Pedregal (Grupo 1)LOMPARTE GOMEZ THIAGO ORLANDO SALVATTOREAinda não há avaliações
- ResilienciaDocumento4 páginasResiliencialuz ZabaletaAinda não há avaliações
- CAPILARIDADDocumento19 páginasCAPILARIDAD01-IC-HU-CRISTIAM RICARDO POMALAZA RODRIGUEZAinda não há avaliações
- Catálisis Enzimática PDFDocumento6 páginasCatálisis Enzimática PDFClaudia RadaAinda não há avaliações
- Mecánica de Fluidos AQUAMANESDocumento9 páginasMecánica de Fluidos AQUAMANESHalver de lacruzAinda não há avaliações
- Problemario 3Documento6 páginasProblemario 3jonathanAinda não há avaliações
- Resistencia de materiales: examen final con 4 problemas de cálculo de esfuerzosDocumento3 páginasResistencia de materiales: examen final con 4 problemas de cálculo de esfuerzosJose Mendez zuñigaAinda não há avaliações
- ENERGÍADocumento26 páginasENERGÍAElioAguilarFLoresAinda não há avaliações
- Principio de Bernoulli ModificadoDocumento19 páginasPrincipio de Bernoulli ModificadoladyAinda não há avaliações
- Taller 2 D1 Fisica 11 Mov ArmonicoDocumento5 páginasTaller 2 D1 Fisica 11 Mov Armonicokim henaoAinda não há avaliações
- Practica 1 Deter Humedad GranoDocumento8 páginasPractica 1 Deter Humedad GranojhoswelinAinda não há avaliações
- Capas de La TierraDocumento45 páginasCapas de La TierraCarlos EnriqueAinda não há avaliações
- Informe de Ley de Hooke y Modulo de YoungDocumento8 páginasInforme de Ley de Hooke y Modulo de YoungGiovany GomajoaAinda não há avaliações
- Estruct y Sist PeriodicoDocumento2 páginasEstruct y Sist PeriodicoAndresAinda não há avaliações
- Fisica - 5to - Capitulos 6 y 7 PDFDocumento30 páginasFisica - 5to - Capitulos 6 y 7 PDFmaximorichardAinda não há avaliações
- Manual de Laboratorio Mecanica de FluidosDocumento51 páginasManual de Laboratorio Mecanica de FluidosRolandAvilaJulcaAinda não há avaliações
- 2° Informe Fisica IiDocumento16 páginas2° Informe Fisica Iiomarchappa1888% (25)
- Cge - Diseño Lineas de TransmisionDocumento24 páginasCge - Diseño Lineas de TransmisioncabelmarAinda não há avaliações
- El Ciclo Estacional de Un LagoDocumento2 páginasEl Ciclo Estacional de Un LagoFabian CastilloAinda não há avaliações
- PTS-004 Procedimiento SoldadurasDocumento8 páginasPTS-004 Procedimiento SoldadurasXenia VelosoAinda não há avaliações
- 1Documento14 páginas1chaito0% (1)