Escolar Documentos
Profissional Documentos
Cultura Documentos
Expoenzimafinal
Enviado por
Luis F AlvaradoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Expoenzimafinal
Enviado por
Luis F AlvaradoDireitos autorais:
Formatos disponíveis
ENZIMAS
Ferrer Lavado, Lurdes
Bonilla Collao, David
Gonzales Tarrillo, Jos
Toledo Suarez, Javier
Las enzimas son protenas
Catalizan reacciones qumicas necesarias
para la sobrevivencia celular
Sin las enzimas los procesos biolgicos
seran tan lentos que las clulas no podran
existir.
Las enzimas pueden actuar dentro de la
clula , fuera de sta, y en el tubo de ensayo.
E + S ESEP E + P
E
E E E
ALGUNAS CARACTERISTICAS
En su gran mayora de naturaleza
proteica
Suceptibles de desnaturalizacin
Alto peso molecular
Gran poder cataltico
Actan en bajas concentraciones
No alteran las constantes
termodinmicas
Enzima - Catalizador
Tanto la enzima como el catalizador
aceleran la velocidad de una reaccin
qumica.
Una enzima puede transformar 1000
molculas de sustrato/ segundo
Las enzimas tienen 3 propiedades que los
catalizadores NO tienen
Especificidad por el sustrato
Se inactivan por desnaturacin
Pueden ser reguladas
Eficiencia Cataltica
La enzima disminuye la energa de
activacin
Tiempo de la reaccin
E + S
E + P
Sin enzima
Con enzima
La Ea de la hidrlisis de la urea
baja de 30 a 11 kcal/mol con la
accin de las enzimas, acelerando
la reaccin 10
14
x
El aumento de temperatura
necesario para producir la reaccin
no catalizada seria de 529C
Sin catalizador
Con catalizador
Las enzimas se unen a los reactivos
(sustratos) reduciendo la energa de
activacin
Cada enzima tiene una forma nica
con un sitio o centro activo en el que
se une al sustrato
Despus de la reaccin, enzimas y
productos se separan.
Las molculas enzimticas no han
cambiado despus de participar en la
reaccin
SITIO ACTIVO
Las enzimas contienen hendiduras o
cavidades denominadas sitio activo.
Est formado por las cadenas laterales
de residuos especficos, lo que
ocasiona que tenga un arreglo
tridimensional particular, diferente al
resto de la protena. Este sitio es afn
por la estructura tridimensional del
sustrato:
Enzimas
Los siguientes hechos:
Especificidad de la reaccin enzimtica
Carcter heterogneo de la catlisis enzimtica
Nos llevan a postular la existencia de un Centro
Activo en la molcula de enzima, capaz de:
Fijar especficamente al substrato
Transformarlo catalticamente.
Enzima
Sitio activo
Sustrato
Complementariedad geomtrica
Complementariedad de cargas, uniones
inicas
Modelos:
Encaje inducido
Llave cerradura.
Estado de transicin
La unin del sustrato es muy
especfica
Teoras de la accin enzimtica, 1
Modelo de Llave y Cerradura (Emil Fischer)
Substrato y enzima se acoplan de forma estereospecfica,
de la misma manera que una llave se ajusta a su
cerradura.
Modelo aceptado durante mucho tiempo; hoy se
considera insuficiente al no explicar algunos fenmenos
de la inhibicin enzimtica
Teoras de la accin enzimtica, 2
Modelo de Ajuste Inducido (Koshland)
Tanto la enzima como el substrato sufren una alteracin
en su estructura por el hecho fsico de la unin.
Est mucho ms de acuerdo con todos los datos
experimentales conocidos hasta el momento.
Especificidad Enzimtica
Especificidad Absoluta
Una enzima reconoce un nico compuesto como
su sustrato
Especificidad Relativa
Una enzima puede reconocer a varios
compuestos que tengan similaridad estructural
como sus sustratos.
Mostrar afinidad diferente por cada uno de ellos
Clasificacin y
nomenclatura de enzimas
EC 2.7.1.1
Nmero Enzyme Commission:
Enzyme
Comission
Grupo
Subgrupo
Nombre comn (sustrato+asa): Hexokinasa
Clasificacin y nomenclatura
ATP: hexosa fosfotransferasa
Nombre sistemtico:
Donador Aceptor
Grupo transferido
Tipo de reaccin catalizada
Grupos
qumicos
Enzimas
EC 1.x Oxidorreductasas
EC 2.x Transferasas
EC 3.x Hidrolasas
EC 4.x Liasas
EC 5.x Isomerasas
EC 6.x Ligasas
Clasificacin de enzimas por Grupos
Clasificacin y nomenclatura
Grupo 1 - Oxidoreductasas
Catalizan reacciones de xido reduccin
Frecuentemente requieren como
cofactor NAD o FAD
Las ms frecuentes son :
Deshidrogenasas
Oxidasas
Grupo 1: Oxidorreductasas
Catalizan reacciones de oxidorreduccin, en que tomos de
oxigeno hidrogeno son trasladados entre molculas:
En las reacciones redox, siempre tienen que estar presentes a
la vez el aceptor y el dador electrnico.
AH
2
+ B A + BH
2
Clasificacin y nomenclatura
A
red
+ B
ox
A
ox
+ B
red
Nombre: Dador:Aceptor oxidorreductasa
Nombre comn:
Glucosa oxidasa
|-D-Glucosa : O
2
1-oxidorreductasa
Dador Aceptor
EC 1.1.3.4
Clasificacin y nomenclatura
Grupo 1: Oxidorreductasas
Nomenclatura del subgrupo en oxidorreductasas:
EC 1.1.x - Deshidrogenasas
EC 1.2.x - Oxidasas
EC 1.3.x - Peroxidasas
EC 1.4.x - Oxigenasas
EC 1.5.x - Hidroxilasas
EC 1.6.x - Reductasas
etc.
Clasificacin y nomenclatura
Grupo 1: Oxidorreductasas
Aplicaciones: Ensayos de diagnostico clnico (glucosa oxidasa y colesterol oxidasa
Deslignificacin Bioblanqueamiento
A-X + B
A + B-X
Grupo 2: Transferasas
Catalizan reacciones de transferencia de tomos
grupo de tomos entre molculas:
Dador: Aceptor Grupo transferido - transferasa
ATP: D-Hexosa Fosfotransferasa
EC 2.7.1.1
Nombre comn: hexokinasa
Clasificacin y nomenclatura
Grupo 2 - Transferasas
Catalizan reacciones de transferencia de
grupos qumicos
-NH2 Aminotransferasas
-CH3 Transmetilasas etc
Las ms frecuentes son :
Quinasas o Cinasas
Fosforilasas
Clasificacin de subgrupo de las transferasas:
EC 2.1.x - Grupos monocarbonados
EC 2.2.x - Grupos aldehido o ceto
EC 2.3.x - Aciltransferasas
EC 2.4.x - Glicosiltransferasas
EC 2.5.x - Alquil- o Ariltransferasas
EC 2.6.x - Grupos nitrogenados
EC 2.7.x - Grupos fosfato
EC 2.8.x - Grupos sulfato
EC 2.9.x - Grupos selenio
Clasificacin y nomenclatura
Grupo 2: Transferasas
Aplicaciones: Sntesis de oligosacridos
Grupo 3 - Hidrolasas
Catalizan reacciones de hidrlisis
(ruptura de enlaces con participacin
directa del agua)
Son las ms abundantes
En las reacciones, el agua figura como
reactante
En este grupo se encuentran las
fosfatasas
Grupo 3: Hidrolasas
Catalizan reacciones de hidrlisis y tambin su reverso. Son
las ms comunes en el dominio de la tecnologa enzimtica:
A-B + H
2
O A-OH + H-B
No se suelen utilizar nombres sistemticos en las
hidrolasas. Muchas de ellas conservan el nombre
Primitivo. Ejemplo: Quimosina EC 3.4.23.4.
Clasificacin y nomenclatura
Clasificacin de las hidrolasas:
3.1.-.- Esterasas (carboxilesterasas, fosfoesterasas, sulfoesterasas)
3.2.-.- Glicosidasas
3.3.-.- ter hidrolasas
3.4.-.- Pptido hidrolasas
3.5.-.- Acil anhdrido hidrolasas
etc.
Grupo 3: Hidrolasas
Clasificacin y nomenclatura
Aplicaciones: Lipasas Sntesis de tensioactivos
Proteasas Fabrico de quesos
Glicosidasas Clarificacin de jugos; liberacin de aromas en los
vinos; aplicaciones textiles
Caso particular Pptido hidrolasas: clasificacin comn (no
sistemtica)
I. Segn la situacin del enlace atacado:
- Exopeptidasas (extremos de la cadena) (Peptidasas)
- Endopeptidasas (interior de la cadena) (Proteinasas)
II. Segn el mecanismo cataltico:
- Serin proteinasas
- Tiol proteinasas
- Aspartil proteinasas
- Metaloproteinasas
Grupo 3: Hidrolasas
Clasificacin y nomenclatura
Grupo 4: Liasas
Catalizan reacciones reversibles de remocin de grupo de
tomos del sustrato (este grupo no incluye las hidrolasas):
A-B A + B
Clasificacin y nomenclatura
Ejemplo
Nombre sistemtico:
Histidina amonio-liasa (EC 4.3.1.3)
Nombre comn:
Histidasa
Clasificacin de las liasas:
4.1.x - Actan sobre enlaces C-C
4.2.x - Actan sobre enlaces C-O
4.3.x - Actan sobre enlaces C-N
4.4.x - Actan sobre enlaces C-S
4.5.x - Actan sobre enlaces C-Haluro (S
-
, Cl
-
, Br
-
, I
-
At
-
)
4.6.x - Actan sobre enlaces P-O
4.99.x - Otras liases
Clasificacin y nomenclatura
Aplicaciones: Pectato liasa Remueve los compuestos indeseables (ceras,
pectinas, protenas) en fibras en la industria textil bioscouring
Grupo 4: Liasas
Grupo 5: Isomerasas
Catalizan reacciones de isomerizacin moleculares
Clasificacin y nomenclatura
A B
Ejemplo:
Glucosa isomerasa (EC 5.3.1.5)
5.1.x - Rasemasas y Epimerasas
5.2.x - cis-Trans-Isomerasas
5.3.x - Oxidoreductasas Intramolecular
5.4.x - Transferasas Intramoleculares (mutases)
5.5.x - Liasas Intramoleculares
5.99.x - Otras Isomerasas
Grupo 5: Isomerasas
Clasificacin y nomenclatura
Clasificacin de las isomerasas:
Grupo 6: Ligasas
Catalizan la unin de dos grupos qumicos a expensas
de la hidrlisis de un nucletido trifosfato (ATP, GTP, etc.).
A + B + ATP A-B + ADP + P
i
Clasificacin y nomenclatura
Ejemplo: Glutationa sintasa (EC 6.2.2.3)
Nombre sistmico:
G-L-glutamilo-L-cisteina:glicina ligase
Grupo 6: Ligasas
Clasificacin y nomenclatura
Clasificacin de las ligasas:
6.1.x - Forman enlaces C-O
6.2.x - Forman enlaces C-S
6.3.x - Forman enlaces C-N
6.4.x - Forman enlaces C-C
6.5.x - Forman enlaces steres fosfricos
6.6.x - Actan sobre enlaces N-metal
Clasificacin de Enzimas
Segn la necesidad de activacin
1) Enzimas que no requieren
activacin (centro activo formado y su
actividad cataltica depende dependen
slo de la estructura y conformacin del
centro activo)
2) Zimgenos o Proenzimas
3) Enzimas que requieren Cofactor
2) Zimgenos o Proenzimas
Enzimas que son sintetizadas por la clula al
estado inactivo
Requieren ciertas condiciones en el medio
para poder pasar al estado activo
( generalmente por un proceso de Activacin
proteoltica
Existen zimgenos que disponen del centro
activobloqueado o que no disponen centr
activo
2) Zimgenos o Proenzimas
+ HCl
Pepsingeno
Pepsina
Jugo gstrico
Polipptido
44 aa
Cintica Enzimtica
Cintica Enzimtica
La cintica enzimtica es el anlisis cuantitativo del efecto
de cada uno de los factores que intervienen en la actividad
enzimtica, que se evala a travs de la velocidad de la
reaccin catalizada.
Las variables ms importantes son:
Concentracin de enzima, sustratos y productos
(incluyendo inhibidores y/o activadores)
pH
Temperatura
Ella est basada en la medicin de la velocidad de reaccin. As en la reaccin:
Se tendr:
Como se observa en la figura, la velocidad de reaccin (pendiente) disminuye
continuamente a partir de un valor mximo inicial. Esto se puede deber a:
Desaturacin de la enzima con sustrato, por disminucin de la
concentracin del sustrato
Inactivacin de la enzima por su inherente inestabilidad
Inhibicin por el producto
Desplazamiento del equilibrio, si la reaccin es reversible
dt
ds
dt
dp
v = =
E
S P
Baja
concentracin
de sustrato
ALTA
concentracin
de sustrato
SATURACION
v
[s]
Efecto de la concentracin de substrato
.
.
.
.
.
. .
.
dt
t
s
p
[ ]
Concepto de velocidad inicial
d[P]
v =
, t 0
E + S
ES E + P
k
+1
k
-1
k
+2
Una cintica hiperblica implica un proceso saturante:
Hay un nmero limitado de sitios en la enzima
para fijar substrato; una vez que estn ocupados
todos, por mucho que aumente la concentracin
de substrato, la velocidad permanecer constante
tendiendo a un valor asinttico
El sistema de ecuaciones diferenciales que describe la dinmica
del sistema
E + S
ES E + P
k
+1
k
-1
k
+2
Sistema No admite solucin analtica.
- Simulaciones numricas
- Hiptesis que lo simplifiquen
Hiptesis de Michaelis - Menten
E + S
ES E + P
k
+1
k
-1
k
+2
- La primera parte del mecanismo,
E + S
ES
k
+1
k
-1
Tiene lugar mucho ms rpidamente que la segunda:
ES E + P
k
+2
| || |
| |
( )
K
E S
ES
es
x
e x s
x
m
= = =
0
x
e s
K s
m
=
+
0
v
k e s
K s
m
=
+
+2 0
k e V
+
=
2 0 max
v
V s
K s
m
=
+
max
Hiptesis de
Michaelis-Menten
Equilibrio rpido
v k x =
+2
Hiptesis de estado estacionario
Segn veamos en la simulacin numrica, hay un tiempo
relativamente prolongado en el curso de la reaccin en el
que la variacin de complejo [ES] es prcticamente igual
a cero:
dx/dt = k
+1
es - (k
-1
+ k
+2
) x = 0
A partir de esta expresin podemos llegar a obtener una
expresin que nos da la velocidad para la concentracin
de substrato
( )
dx
dt
k es k k x = = +
+ +
0
1 1 2
( ) ( ) k es k e x s k k x
+ + +
= = +
1 1 0 1 2
x
e s
k k
k
s
e s
K s
m
=
+
+
=
+
+
+
0
1 2
1
0
v
V s
K s
m
=
+
max
v k x =
+2
k e V
+
=
2 0 max
Hiptesis de
estado estacionario
A partir de las suposiciones de Michaelis-Menten y
Estado estacionario, llegamos a la ecuacin
K
m
+ s
v =
V
max *
s
La nica diferencia radica en el significado de K
m
:
K
m
= k
-1
/k
+1
en mecanismo de M.M.
K
m
= (k
-1
+ k
+2
)/k
+1
en mecanismo de E.E.
Significado de la constante K
m
1. Constante de equilibrio de disociacin del complejo ES
(en condiciones de equilibrio rpido)
2. Medida inversa de la afinidad de la enzima por el substrato
(en condiciones de equilibrio rpido)
3. Mide la funcin de fijacin (en cond.de equilibrio rpido)
4. Concentracin de substrato para la que la velocidad se hace
igual a la mitad de la mxima (s
0.5
)
5. Se define para una pareja enzima-substrato
6. Se mide en unidades de concentracin
Significado de la constante V
max
= k
+2
e
0
1. Velocidad asinttica para s
2. Directamente proporcional a la concentracin de
enzima (hoy se prefiere caracterizar a la enzima
por k
+2
)
3. Mide funcin de transformacin cataltica
4. Se expresa en unidades de velocidad
Relacin entre Km y Vmax
Michaelis y Menten
Concentracin de Sustrato [S]
V
e
l
o
c
i
d
a
d
d
e
l
a
r
e
a
c
c
i
n
(
v
)
Km
Vmax
Vmax/2
La Km es la concentracin de sustrato
donde se obtiene la mitad de la Vmax
Concentracin de Sustrato [S]
V
e
l
o
c
i
d
a
d
d
e
l
a
r
e
a
c
c
i
n
(
v
)
Km
Vmax
Vmax/2
A mayor Km, menor es la afinidad de la enzima por el sustrato
A menor Km mayor es la afinidad de la enzima por el sustrato
Representacin directa
s
0 20 40 60 80 100
v
0
20
40
60
80
100
K
m
V
max
v
V s
K s
mx
m
=
+
Representacin recproca doble
(Lineweaver - Burk)
1/s
-0.4 -0.2 0.0 0.2 0.4 0.6
1/v
0.00
0.01
0.02
0.03
0.04
1 1 1
v
K
V s V
m
mx mx
= +
-1/K
m
1/V
max
Representacin Lineweaver-Burke
Representacin s -s/v
(Eadie - Hofstee)
s
-20 0 20 40 60 80 100 120
s/v
0.0
0.2
0.4
0.6
0.8
1.0
1.2
s
v V
s
K
V
mx
m
mx
= +
1
-K
m
Representacin Hanes
Representacin v/s - v
(Wong - Hanes)
v/s
0 2 4 6 8 10 12 14 16
v
0
20
40
60
80
100
v K
v
s
V
m mx
= +
V
max
Representacin de Eadie-Hofstee
Mtodos de linealizacin para determinacin
parmetros cinticos
Mtodo Eje Y Eje X Intercepto
Eje Y
Intercepto
Eje x
Pendiente
Lineweaver-
Burke
1/v 1/s 1/V -1/K K/V
Hanes s/v s K/V -K 1/V
Eadie-
Hofstee
v v/s V V/K -K
Definicin Actividad Enzimtica
Es el nmero de moles de sustrato que
reaccionan para formar producto, por mol de
enzima y por unidad de tiempo. Esto supone
que la enzima est plenamente saturada con
sustrato y por tanto que la reaccin se efecta
con su mxima rapidez
El ndice de recambio muestra la eficiencia
impresionante de la catlisis enzimtica
A fin de normalizar la medicin de la actividad, se ocupa el valor de
la velocidad inicial de reaccin, donde eses factores son
despreciables. As,
Esta velocidad inicial no se espera que sea observada en un proceso
enzimtico donde, debido a los elevados tiempos de operacin, es
razonable suponer que esos factores ejercern su influencia.
0 0
0
|
.
|
\
|
=
|
.
|
\
|
= =
t t
t
dt
ds
dt
dp
v a
Clculo de Actividad Enzimtica
La velocidad de reaccin catalizada por 0,1ml
de una dilucin 1:100 de Fosfatasa Alcalina es
0,3umoles / min. de producto. Cul es su
actividad enzimtica?
0,1ml-------- 0,3umoles producto / min.
1,0ml------------3,0umoles producto / min.
dil 1:100-------------300umoles producto / min.
Respuesta: 300U/ml
Nmero o ndice de Recambio
Es til definir una constante de velocidad ms
general, k
cat
, para describir la velocidad
limitante de cualquier reaccin enzimtica a
saturacin
k
cat
x E
t
= V
mx
V
0
= k
cat
x E
t
x [S] / K
M
+ [S];
K
cat
es una constante de velocidad de 1
er
orden con unidades de tiempo
-1
, tambin
llamada Nmero de Recambio
Efecto del pH en la ENZIMA
Cada enzima tiene un pH ptimo para su actividad
El pH afecta las interacciones inicas
1. Sobre la fijacin del substrato al centro activo:
- Grupos disociables de la enzima
- Grupos disociables del substrato
2. Sobre la transformacin cataltica del substrato
3. Sobre la estructura de la protena enzimtica
Efecto del pH
En el efecto de la temperatura hay dos componentes:
1. Aceleracin de la reaccin segn la ecuacin
de Arrhenius
k = A exp (-E
a
/RT)
2. Desnaturalizacin trmica de la protena
Efecto de la temperatura en la ENZIMA
Cada enzima tiene una temperatura ptima.
Temperatura
15 40 75
Aumento de la
velocidad
Desnaturacin
por calor
Você também pode gostar
- PERUDocumento10 páginasPERULuis F AlvaradoAinda não há avaliações
- En Ese Estudio Buscamos Establecer Nuevas Rutas de Recolección de Residuos Solidos en El Distrito de Caleta de Carquin en La Provincia de HuauraDocumento3 páginasEn Ese Estudio Buscamos Establecer Nuevas Rutas de Recolección de Residuos Solidos en El Distrito de Caleta de Carquin en La Provincia de HuauraLuis F AlvaradoAinda não há avaliações
- No Se Lo Que Sera Solo Lo Puse Por Que Necesitaba DescargarDocumento5 páginasNo Se Lo Que Sera Solo Lo Puse Por Que Necesitaba DescargarLuis F AlvaradoAinda não há avaliações
- PERUDocumento10 páginasPERULuis F AlvaradoAinda não há avaliações
- Politica de SeguridadDocumento1 páginaPolitica de SeguridadLuis F AlvaradoAinda não há avaliações
- OFICi ODocumento1 páginaOFICi OLuis F AlvaradoAinda não há avaliações
- Cap IIIDocumento5 páginasCap IIILuis F AlvaradoAinda não há avaliações
- Declaración Jurada de Manipulador de ExplosivosDocumento3 páginasDeclaración Jurada de Manipulador de ExplosivosLuis F AlvaradoAinda não há avaliações
- Análisis de SusceptibilidadDocumento2 páginasAnálisis de SusceptibilidadLuis F AlvaradoAinda não há avaliações
- Tarea 8 Alvarado PradoDocumento7 páginasTarea 8 Alvarado PradoLuis F AlvaradoAinda não há avaliações
- Matadero Frigorifico Valle Verde 04-01-17Documento39 páginasMatadero Frigorifico Valle Verde 04-01-17Luis F Alvarado0% (1)
- Procedimiento Escrito para Labores en VerticalDocumento2 páginasProcedimiento Escrito para Labores en VerticalLuis F AlvaradoAinda não há avaliações
- Trabajo 01 CesapDocumento1 páginaTrabajo 01 CesapLuis F AlvaradoAinda não há avaliações
- Luis Fernando Alvarado Prado Trabajo01 SSOMADocumento1 páginaLuis Fernando Alvarado Prado Trabajo01 SSOMALuis F AlvaradoAinda não há avaliações
- SomaDocumento1 páginaSomaLuis F AlvaradoAinda não há avaliações
- Plan de ContingenciaDocumento6 páginasPlan de ContingenciaLuis F Alvarado100% (1)
- Apuntes Digitales Cuaderno de ObraDocumento6 páginasApuntes Digitales Cuaderno de ObraLuis F AlvaradoAinda não há avaliações
- Inversiones RDZG EIRLDocumento6 páginasInversiones RDZG EIRLLuis F AlvaradoAinda não há avaliações
- Plan de ContingenciaDocumento6 páginasPlan de ContingenciaLuis F Alvarado100% (1)
- Antecedentes Tesis 2Documento4 páginasAntecedentes Tesis 2Luis F AlvaradoAinda não há avaliações
- Recomendaciones para Ser Una Empresa Exportadora Con Éxito en EE UUDocumento1 páginaRecomendaciones para Ser Una Empresa Exportadora Con Éxito en EE UULuis F AlvaradoAinda não há avaliações
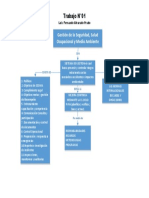
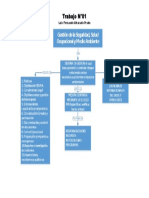
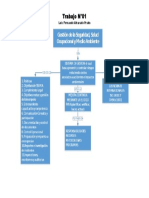
- Sistema de Gestion de Seguridad, Salud y Medio AmbienteDocumento1 páginaSistema de Gestion de Seguridad, Salud y Medio AmbienteLuis F AlvaradoAinda não há avaliações
- Tarea Sesión 01Documento4 páginasTarea Sesión 01Luis F AlvaradoAinda não há avaliações
- Identificación de Aspectos e Impactos AmbientalesDocumento2 páginasIdentificación de Aspectos e Impactos AmbientalesLuis F AlvaradoAinda não há avaliações
- Las Estrategias Competitivas de Michael PorterDocumento4 páginasLas Estrategias Competitivas de Michael PorterLuis F AlvaradoAinda não há avaliações
- Falta DisminuirDocumento13 páginasFalta DisminuirLuis F AlvaradoAinda não há avaliações
- Flujogramas de Procesos IndustrialesDocumento9 páginasFlujogramas de Procesos IndustrialesLuis F AlvaradoAinda não há avaliações
- Control Nº2 - Madera de PlasticoDocumento1 páginaControl Nº2 - Madera de PlasticoLuis F AlvaradoAinda não há avaliações
- Cop 21Documento2 páginasCop 21Luis F AlvaradoAinda não há avaliações
- Modelo CanvasDocumento5 páginasModelo CanvasLuis F AlvaradoAinda não há avaliações
- GlucogenogenesisDocumento2 páginasGlucogenogenesisCarlos Ramirez LopezAinda não há avaliações
- Capitulo 12 Comportamiento Intracelular Retículo Endoplásmatico Complejo de Golgi Endosomas LisoDocumento46 páginasCapitulo 12 Comportamiento Intracelular Retículo Endoplásmatico Complejo de Golgi Endosomas LisoSofi AmarillaAinda não há avaliações
- Proyecto Integrador 2.2Documento28 páginasProyecto Integrador 2.2Byron TaipeAinda não há avaliações
- Los Orgánulos Celulares - HiruDocumento3 páginasLos Orgánulos Celulares - HiruandreaAinda não há avaliações
- MetacrucigramaDocumento1 páginaMetacrucigramazenith100% (2)
- Curso en Biotecnología Molecular para Alumnos de PsicologíaDocumento2 páginasCurso en Biotecnología Molecular para Alumnos de PsicologíaAlex PsAinda não há avaliações
- Biologia 1 PDFDocumento84 páginasBiologia 1 PDFOscar Lemus RamírezAinda não há avaliações
- Programa - IX Diplomado en Biomagnetismo Asaya IDMADocumento7 páginasPrograma - IX Diplomado en Biomagnetismo Asaya IDMAkarolin RiveraAinda não há avaliações
- Farmacocinetica y Farmacodinamia PDFDocumento77 páginasFarmacocinetica y Farmacodinamia PDFTAREAS JOTAAinda não há avaliações
- Exposicion BiologiaDocumento16 páginasExposicion BiologiaGonzalo Millan FloresAinda não há avaliações
- FisicaDocumento58 páginasFisicaYamila MayhuaAinda não há avaliações
- X SOY 600 EspañolDocumento2 páginasX SOY 600 EspañolJosé AlmeaAinda não há avaliações
- GENETICA Molecular y BiotecnologíaDocumento46 páginasGENETICA Molecular y BiotecnologíaPablo MartínezAinda não há avaliações
- Genetica Clinica 2a Ed Mutación y Enfermedad Tema - Web - 04Documento8 páginasGenetica Clinica 2a Ed Mutación y Enfermedad Tema - Web - 04rosela_obandoAinda não há avaliações
- Diseñamos y Construimos Las Moléculas de ADN y ARNDocumento8 páginasDiseñamos y Construimos Las Moléculas de ADN y ARNJualej DiazAinda não há avaliações
- Cuestionario de Fisiologia Nerviosa Con RespuestasDocumento11 páginasCuestionario de Fisiologia Nerviosa Con RespuestasKimberly SanchezAinda não há avaliações
- Los Fosfolípidos Son Lípidos Iónicos Polares Compuestos de 1Documento7 páginasLos Fosfolípidos Son Lípidos Iónicos Polares Compuestos de 1Laura Juliana Sacristan YepesAinda não há avaliações
- Actividades - Niveles de Organización de Los Seres VivosDocumento6 páginasActividades - Niveles de Organización de Los Seres VivosGami andreAinda não há avaliações
- Motilidad Celular Flagelos y CiliciosDocumento2 páginasMotilidad Celular Flagelos y CiliciosKawir ArgumedoAinda não há avaliações
- Laboratorio 4. Citocromo OxidasaDocumento6 páginasLaboratorio 4. Citocromo OxidasaMajo ReyesAinda não há avaliações
- ProteinasDocumento10 páginasProteinasDelta CasioAinda não há avaliações
- Arquitectos de La Comunicación CelularDocumento6 páginasArquitectos de La Comunicación CelularMaricielo lazoAinda não há avaliações
- Marco Teórico ProteinasDocumento3 páginasMarco Teórico ProteinasValentina BenítezAinda não há avaliações
- Bases Moleculares de La Enfermedad Tema 1-5Documento40 páginasBases Moleculares de La Enfermedad Tema 1-5daniel_19junioAinda não há avaliações
- 954Documento6 páginas954Stefhany ValdeiglesiasAinda não há avaliações
- División CelularDocumento7 páginasDivisión CelularAndrésAinda não há avaliações
- BIOQUIMICA IntroducciónDocumento15 páginasBIOQUIMICA IntroducciónJose QuirogaAinda não há avaliações
- Historia de La Evolución de La BioquímicaDocumento4 páginasHistoria de La Evolución de La BioquímicaANDREA RIVERA ESPINOSAAinda não há avaliações
- Proyecto Genoma CaninoDocumento2 páginasProyecto Genoma CaninoEliana CaroAinda não há avaliações
- 73059127-2 Circulacion en Bacterias Protistas y HongosDocumento17 páginas73059127-2 Circulacion en Bacterias Protistas y HongosMaria Camila Ocampo Sierra100% (4)