Escolar Documentos
Profissional Documentos
Cultura Documentos
Enzimas
Enviado por
César TerronesDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Enzimas
Enviado por
César TerronesDireitos autorais:
Formatos disponíveis
Enzimas: mecanismo de
accin, sitio activo,
cofactores
Qu es una enzima?
Es un tipo de protena que acta como catalizador de
reacciones qumicas.
Incrementa la velocidad de reaccin sin cambiar el punto
de equilibrio.
Como catalizador:
Es especfico para cada reaccin. No necesariamente
para un solo sustrato, aunque muchas enzimas lo son.
Tiene gran poder cataltico, transformando hasta 10
3
a
10
4
molculas por segundo.
Est sujeto a diversos mecanismos de regulacin de
modo tal que no genere ms producto que el necesario.
en y zyme = en la levadura
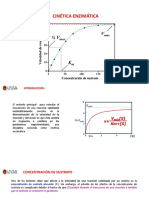
Actividad enzimtica
Es la forma de medida de una enzima.
La ecuacin general de las reacciones enzimticas es:
Donde la enzima se une al sustrato para generar un producto. Algunas
veces con el auxilio de un cofactor que se modifica durante la
reaccin.
La actividad enzimtica se mide por la reaccin cataltica bajo la forma
de desaparicin del sustrato por unidad de tiempo.
Tambin por formacin de producto o modificacin del cofactor.
Unidades: katal = moles de sustrato/segundo.
Unid. Internacionales: umol/minuto.
1 U= 16,7 nkat.
2 1
Cof P E ES Cof S E
Clasificacin de enzimas
Clase de enzima Tipo de reaccin catalizada
Oxidoreductasas
Reacciones que transfieren electrones de un sustrato
a otro.xido reduccin
Transferasas
Transfieren un grupo funcional de una molcula a otra.
Grupos como metilos, acilos, fosfatos etc
Hidrolasas
Rompen enlaces entre carbonos u otras molculas
con la adicin de una molcula de agua.
Liasas
Rompen enlaces C-C, C-S, C-N sin el ingreso de una
molcula de agua.
Isomerasas
Transforman un ismero en otro transfiriendo un grupo
funcional de una posicin a otra.
Ligasas
Forman enlaces C-C, C-N, C-O y C-S uniendo dos
molculas con gasto de energa.
Ej. Hexocinasa = ATP:D-hexosa 6-fosfotransferasa E.C.2.7.1.1.
Clase 2 (transferasas), subclase 7 (transf. de un grupo fosforilo), sub-subclase 1(el alcohol es el
aceptor del fosforilo), 1 (compuesto aceptor). Hexosa-6 (el alcohol fosforilado est en el C6 de
una hexosa).
Especificidad y sitio activo
Las reacciones se inician
cuando el sustrato se une al
sitio activo de la enzima.
El sitio activo es una porcin
espacial de la enzima creada
por la coincidencia de varias
cadenas laterales de amino-
cidos especficos. Estos
pueden no estar en
secuencia, pero los dobleces
de la protena enzimtica los
aproximan.
Existen: residuos de captura
y residuos de catlisis.
Sitio activo de la enzima fructosa
2,6 difosfatasa
Tipos de
especificidad enzimtica
En este modelo el sitio activo tiene una estructura rgida,
se le llama de llave y cerradura.
Es complementaria del sustrato.
Explica la especificidad de sustrato an a nivel de
ismeros (estructuras casi idnticas).
Modelo de molde rgido
Tipos de
especificidad enzimtica
Aqu el sitio activo es ms flexible, se le llama de ma-
no y guante.
Cuando el sustrato se acerca a la enzima se producen
cambios conformacionales que llevan a una exacta u-
nin entre ambos.
Modelo que explica mejor la especificidad de sustrato.
Modelo de molde inducido
Trminos relacionados con la
accin enzimtica
Apoenzima:
Referido solo a la parte proteica de
la enzima
Holoenzima:
Es la protena unido a una coenzima
y/o in metlico
Grupo prosttico
Cofactor
Iones inorgnicos:
Fe
2+,
Mg
2+,
Mn
2+
, Zn
2+
etc.
Complejos orgnicos (Coenzimas)
Grupos prostticos
Estn estrechamente integrados en la estructura de una
enzima.
Incorporacin estrecha y estable mediante fuerzas covalentes
o no covalentes.
Ej. Fosfato de piridoxal, FMN, FAD, pirofosfato de tiamina,
biotina y los iones metlicos de Co, Cu, Mg, Mn y Zn.
Los metales son los grupos prostticos ms comunes
metaloenzimas.
Cofactores
Se asocian de manera reversible con enzimas o sustratos.
Desempean funciones similares a las de grupos prostticos,
pero se unen de una manera transitoria y disociable a la
enzima o a un sustrato.
Los cofactores ms comunes tambin son iones metlicos.
Las enzimas que requieren un cofactor in metlico se
llaman enzimas activadas por metal para distinguirlas de las
metaloenzimas.
Coenzimas
Se unen lbilmente a la apoenzima y se disocian fcilmente.
Sirven como transbordadores de sustrato o agentes de
transferencia de grupo.
Son reciclables.
La asociacin con la coenzima tambin estabiliza sustrato
como tomos de hidrgeno.
Otras porciones qumicas transportadas por coenzimas son:
grupos metilo (folatos), grupos acilo (coenzima A) y
oligosacridos (dolicol).
Las vit. B hidrosolubles proporcionan componentes
importantes de muchas coenzimas. Ej. La nicotinamida (NAD,
NADP), riboflavina (FMN, FAD), cido pantotnico (coenzima A)
Mecanismos para la catlisis
Catlisis por proximidad: las molculas deben acercarse
hasta ubicarse dentro de la distancia formadora de enlace de
otra.
Cuando una enzima se une a molculas de sustrato en su
sitio activo, crea una regin de concentracin local alta de
sustrato. Este ambiente tambin orienta las molculas de
sustrato de manera espacial en una posicin ideal para que
interacten.
Catlisis cido bsica: los grupos funcionales ionizables de
cadenas laterales aminoacilo y de grupos prostticos (si
estn presentes) interactan como cidos o bases.
Ej. Pepsina, catepsinas lisosmicas, proteasa del VIH.
Mecanismos para la catlisis
Catlisis por tensin: en reacciones que comprenden la
rotura de un enlace covalente, las enzimas se unen a sus
sustratos en una conformacin muy desfavorable para el
enlace que sufrir la divisin estado de transicin. La
tensin resultante estira o deforma el enlace, esto lo debilita.
Catlisis covalente: comprende la formacin de un enlace
covalente entre la enzima y uno o ms sustratos.
La modificacin qumica de la enzima es transitoria.
Se observa particularmente en reacciones de transferencia de
grupo.
Por lo general participan los residuos de cistena o serina.
Ej. Quimotripsina, fructosa-2,6-Bifosfatasa
Regulacin de la actividad
enzimtica
Para que la vida se sostenga en condiciones de equilibrio es necesario
que el metabolismo se ajuste con precisin a las necesidades de los
tejidos.
El equilibrio metablico se obtiene regulando la actividad enzimtica
mediante el cambio de la :
cantidad de enzima presente.
cantidad de otros productos.
eficacia de la actividad enzimtica.
Adems el flujo de metabolitos impide que se haga efectivo la cualidad
de reaccin qumica reversible, por cuanto no hay posibilidad de
acumulacin de un producto especfico.
La cantidad de
enzima depende de...
Equilibrio entre velocidad de sntesis y degradacin de la
enzima.
Presencia de inductores en el medio de cultivo de la clula.
Enzimas inducidas
Enzimas constitutivas (independientes del sustrato)
Presencia de catabolitos que reprimen la actividad de una
enzima en particular.
Sntesis de enzimas como proenzimas sin actividad cata-
ltica.
Enzimas alostricas
[S]mM
10 20
20%
95%
Aquellas que son reguladas
mediante la presencia de efectores
en un sitio alostrico ( no ligado al
sitio cataltico de la enzima).
Las enzimas alostricas muestran
una cintica sigmoidea de
saturacin con el sustrato.
Cintica sigmoidea que supone
existencia de un umbral de activa-
cin por debajo del cul la enzima
es insensible a pequeas variacio-
nes de sustrato, mientras que por
encima pequeos cambios de sus-
trato producen efectos drsticos.
Modificaciones covalentes
En algunas enzimas la
regulacin depende de
modificaciones estructurales
reversibles, como la unin
covalente con un grupo
fosfato.
El proceso obtiene el fosfato
del ATP y es dependiente
del aporte de energa del
mismo.
Las formas fosforilada y no
fosforilada son diferentes
(una activa y otra inactiva) y
dependen de la presencia de
fosforilasas y fosfatasas.
OH
O-P=O
O-
O-
Prot.
Fosfatasa Prot.
Quinasa
ATP
Pi
E
E
Localizacin enzimtica
Las enzimas ejercen su
funcin predominantemente
en el interior celular. Mas an
lo hacen en determinado
organelo de la clula.
Las enzimas que se en-
cuentran en el plasma o l-
quidos diversos corresponden
a aquellas que se estn eli-
minando y muy pocas como
la LCAT (Lecitina colesterol
acil transferasa), LLP (Lipasa
lipoproteica), ejercen su
funcin a nivel plasmtico.
Succinato deshidro-
genasa.Citocromo oxidasa
Mitocondria
Catalasa
Peroxisoma
Alfa manosidasa
Complejo Golgi
Retculo endoplasma
Glucosa 6 fosfatasa
Na/K ATPasa
membrana
Papel Clnico de las Enzimas
Si bien es cierto las enzimas cumplen su actividad en
el interior celular, es posible encontrarlas en los
lquidos biolgicos con cierta frecuencia.
Todas las enzimas plasmticas, las del LCR, del L.
Asctico o Pleural se encuentran en bajos niveles de
concentracin actividad- provenientes de los tejidos
ricos en ellas y generalmente de paso a un proceso de
destruccin heptica o eliminacin renal.
nicamente algunas enzimas como las del
metabolismo de lpidos (LCAT, LLP) o los factores
de coagulacin ejercen su actividad en el plasma o
suero.
Elevacin enzimtica en el
plasma...
La actividad enzimtica en el plasma y otros lquidos biolgicos
se produce por:
Necrosis: destruccin celular y vaciamiento de las enzimas
como en el infarto de miocardio, hepatitis viral.
Permeabilidad: aumento de permeabilidad de membrana
igual a necrosis.
Sobre produccin: mayor metabolismo en un tejido
-neoplasia-.
Menor eliminacin: no se elimina normalmente
-obstruccin biliar-.
I ncremento de clulas inflamatorias: en lquidos como
Pleural y Asctico los exudados se acompaan de aumento de
actividad enzimtica.
Origen de las enzimas
en el plasma
Enzimas Ejemplos
Especficas del plasma
Protrombina, plasmingeno,ceruloplasmina,
Lipasa Lipoproteica,colinoesterasa
Secretadas Amilasas, fosfatasa prosttica, pepsingeno
Del metabolismo celular
Lctico deshidrogenasa, aldolasa, aspartato y
alanina transferasa.
Enzimas de uso diagnstico
Enzima Uso diagnstico
Fosfatasa cida Cancer de prstata
Fosfatasa alcalina Enf. heptica y osea
Amilasa Enf. pancretica
Aspartato amino transferasa Enf. heptica y cardiaca
Alanina amino transferasa Enf. heptica
Creatino fosfo quinasa Enf. muscular y cardiaca
Dehidrogenasa lctica I nfarto de miocardio
GOT
GPT
GLDH
SDH
CPK
LDH
Papel de las enzimas en la
medicina
Establecer un diagnstico,
como en el caso de las
enzimas del infarto de
miocardio (CPK y LDH).
Valorar la magnitud de la
lesin
Monitorizar la mejora del
paciente.
Mostrar la repeticin del
fenmeno (reinfarto)
TGO
2 4 6 8 10
LDH
CPK
Das despus del infarto de
Miocardio.
Isoenzimas
Enzimas que realizan la misma funcin pero difieren en su estructura
qumica y propiedades cinticas.
Las formas isoenzimticas distintas pueden pertenecer a distintos
tejidos revelando sus modificaciones el tejido que le dio origen.
Generalmente son estructuras oligomricas con varios tipos de cadenas
proteicas -dmeros o tetrmeros- .
Isoenzimas LDH
0%
10%
20%
30%
40%
50%
60%
70%
80%
90%
100%
H
g
a
d
o
R
i
n
M
i
o
c
a
r
d
i
o
M
s
c
u
l
o
E
r
i
t
r
o
c
i
t
o
s
P
u
l
m
o
n
e
s
B
a
z
o
LDH1
LDH2
LDH3
LDH4
LDH5
%
Dehidrogenasa lctica
Existen cinco isoenzimas
de la deshidrogenasa lctica
(LDH). Cada una es un oli-
gmero con cuatro prot-
meros de los tipos H y M y
tiene un PM de 34 000.
Los protmeros se combi-
nan de manera distinta y se
originan en distintos tejidos
con preferencia.
El suero tiene un contenido
representativo de todos los
tejidos.
Isoenzima SubunidadesTejido predominante
LDH1 HHHH corazn
LDH2 HHHM corazn
LDH3 HHMM rin, pulmn
LDH4 HMMM hgado
LDH5 MMMM hgado
normal
infarto
Creatino fosfokinasa
Existen tres isoenzimas de
la creatino fosfokinasa.
Cada una es un dmero
formado por la combina-
cin de protmeros M y B.
Cada dmero representa a
un tejido en particular.
Isoenzima Subunidades Tejido predominante
CK1 BB Cerebro
Ck2 MB Msculo cardiaco
CK3 MM Msculo esqueltico
(+)
(-)
CK1
CK2
CK3
Você também pode gostar
- PROTEÍNASDocumento23 páginasPROTEÍNASGreiis Vazquez Russo100% (3)
- Nutricion 1Documento484 páginasNutricion 1PacoVivoAinda não há avaliações
- Membrana Celular UsacDocumento34 páginasMembrana Celular UsacStephany HernándezAinda não há avaliações
- Metabolismo de Nucleotidos.10Documento24 páginasMetabolismo de Nucleotidos.10Edwar Tarrillo Vasquez100% (1)
- Tema 8 - Cinetica Enzimatica Farmacia PDFDocumento12 páginasTema 8 - Cinetica Enzimatica Farmacia PDFMariciell Larissa Gonzales TiconaAinda não há avaliações
- Lección #02 DisicipuladoDocumento12 páginasLección #02 DisicipuladoCésar Terrones0% (1)
- 01HBMDocumento7 páginas01HBMCésar TerronesAinda não há avaliações
- Biocatalizadores y Referencias BibliograficasDocumento6 páginasBiocatalizadores y Referencias BibliograficasMaria Elizabeth M. Alberca0% (1)
- 6 - Metabolismo LipídicoDocumento27 páginas6 - Metabolismo LipídicoJosh ReyAinda não há avaliações
- Cinetica de Reacc EnzimaticasDocumento9 páginasCinetica de Reacc EnzimaticasMisato Katzuragi RitzukoAinda não há avaliações
- EnzimasDocumento23 páginasEnzimasMaruby MontonerAinda não há avaliações
- El Examen General de OrinaDocumento72 páginasEl Examen General de OrinaAlfonso VivalAinda não há avaliações
- Laboratorio PHDocumento6 páginasLaboratorio PHmirledysAinda não há avaliações
- Determinación de La Actividad Enzimática de La Fosfatasa Ácida Frente A La Variación de Diferentes FactoresDocumento8 páginasDeterminación de La Actividad Enzimática de La Fosfatasa Ácida Frente A La Variación de Diferentes FactoresJuan Jose Villalobos MoraAinda não há avaliações
- ENZIMOLOGÍA CLÍNICA SeminarioDocumento22 páginasENZIMOLOGÍA CLÍNICA SeminarioDante TorresAinda não há avaliações
- Seminario 6 - Enzimas 2 - 2019 PDFDocumento28 páginasSeminario 6 - Enzimas 2 - 2019 PDFEmy CativaAinda não há avaliações
- Guia Cuerpos Cetonicos Menarini-DiagnosticsDocumento20 páginasGuia Cuerpos Cetonicos Menarini-DiagnosticsIzabela CarolineAinda não há avaliações
- Obecidad en Chile InvestigacionDocumento158 páginasObecidad en Chile Investigacionlorena barriaAinda não há avaliações
- Factores Que Afectan La Actividad EnzimáticaDocumento4 páginasFactores Que Afectan La Actividad EnzimáticaDavid DiazAinda não há avaliações
- Amortiguadores en Los Sistemas BiológicosDocumento4 páginasAmortiguadores en Los Sistemas Biológicoselizabeth corzoAinda não há avaliações
- Ciclo de KrebsDocumento6 páginasCiclo de KrebsSiday SilvaAinda não há avaliações
- Cuestionario 1 - MITOCONDRIASDocumento9 páginasCuestionario 1 - MITOCONDRIASval_eri95Ainda não há avaliações
- CarbohidratosDocumento7 páginasCarbohidratosLindsay Cuadros LeonAinda não há avaliações
- Preguntas Resueltas. MetabolismoDocumento6 páginasPreguntas Resueltas. MetabolismoMarco MaldonadoAinda não há avaliações
- Soluciones Amortiguadoras y PHDocumento7 páginasSoluciones Amortiguadoras y PHLalila Ortiz DiazAinda não há avaliações
- UNIDAD II, Parte 1 2017 Análisis TitrimétricoDocumento14 páginasUNIDAD II, Parte 1 2017 Análisis TitrimétricobessieolivaAinda não há avaliações
- Síntesis de NucleótidosDocumento3 páginasSíntesis de NucleótidosAnonymous guhIUozAinda não há avaliações
- Discusion de Grupo N 3Documento14 páginasDiscusion de Grupo N 3RubenPerez100% (4)
- Clasificacion de Las Enzimas PDFDocumento4 páginasClasificacion de Las Enzimas PDFJoice C Flores100% (1)
- Unidad 2. FarmacocineticaDocumento29 páginasUnidad 2. FarmacocineticaGar AraAinda não há avaliações
- Bioquimica Informe 3 UpsjbDocumento24 páginasBioquimica Informe 3 UpsjbJesus Flores Campos100% (2)
- Selectividad Las EnzimasDocumento4 páginasSelectividad Las EnzimasPedro Manuel Rivera CalleAinda não há avaliações
- Metabolismo Del GLUCÓGENODocumento35 páginasMetabolismo Del GLUCÓGENOErick Javier Guzman SerranoAinda não há avaliações
- Identificación, Propiedades y Cinética de La CatalasaDocumento11 páginasIdentificación, Propiedades y Cinética de La CatalasaDiana Alexandra Santos RiveraAinda não há avaliações
- Bioquimica 1 Segundo ParcialDocumento122 páginasBioquimica 1 Segundo ParcialCristianAinda não há avaliações
- Desnaturalización de Las ProteínasDocumento4 páginasDesnaturalización de Las ProteínasJaider Florez NegreteAinda não há avaliações
- Traduccion Del Arn Procariota y EucariotaDocumento40 páginasTraduccion Del Arn Procariota y EucariotaUlises Infante Huaytalla100% (2)
- Guia de Estudio de Metabolismo de CarbohidratosDocumento3 páginasGuia de Estudio de Metabolismo de CarbohidratoskatAinda não há avaliações
- RESPUESTA Taller 3 - Glucólisis y Destino Del PiruvatoDocumento14 páginasRESPUESTA Taller 3 - Glucólisis y Destino Del PiruvatoLuisianaAinda não há avaliações
- Factores Que Afectan La Actividad EnzimaticaDocumento7 páginasFactores Que Afectan La Actividad EnzimaticaAracely Escarleth Aguirre de la CruzAinda não há avaliações
- 1 - Bioelementos y Biomoleculas BuenoDocumento80 páginas1 - Bioelementos y Biomoleculas Buenome gustan los seres humanos :3Ainda não há avaliações
- Preguntas de Autoevaluación 1ERA UNIDADDocumento30 páginasPreguntas de Autoevaluación 1ERA UNIDADMaster Alonzo0% (1)
- PREPARACION Y EVALUACION DE UN SISTEMA AMORTIGUADOR DE PH (Buffer) .Documento8 páginasPREPARACION Y EVALUACION DE UN SISTEMA AMORTIGUADOR DE PH (Buffer) .Juliana Rodriguez0% (1)
- 11 Actividad EnzimaticaDocumento6 páginas11 Actividad EnzimaticaRaquel Yoselin Guzman RosasAinda não há avaliações
- Extracción e Identificación de LípidosDocumento4 páginasExtracción e Identificación de LípidosNimbe Cuervo GamaAinda não há avaliações
- La Estructura de La InsulinaDocumento3 páginasLa Estructura de La InsulinaAntonella Angulo Cruzado100% (1)
- Seminario. Glucolisis y Oxidacion Del Piruvato.Documento45 páginasSeminario. Glucolisis y Oxidacion Del Piruvato.lorena navarreteAinda não há avaliações
- Clasificación de EnzimasDocumento5 páginasClasificación de EnzimasJaimecesar Ch MAinda não há avaliações
- ProteínasDocumento10 páginasProteínasJoanSalvadorRussoCabreraAinda não há avaliações
- Azucares ReductoresDocumento1 páginaAzucares ReductoresSabrina MarinAinda não há avaliações
- GluconeogénesisDocumento16 páginasGluconeogénesisGiovanni GonzalezAinda não há avaliações
- B-Oxidación de Ácidos GrasosDocumento1 páginaB-Oxidación de Ácidos GrasosAxel RamírezAinda não há avaliações
- Presentacion 6 Cinetica EnzimaticaDocumento46 páginasPresentacion 6 Cinetica EnzimaticaE Clinton LMAinda não há avaliações
- ALOSTERICADocumento10 páginasALOSTERICAtanyAinda não há avaliações
- Respiración Aerobia y AnaerobiaDocumento6 páginasRespiración Aerobia y AnaerobiaPablo QuelalAinda não há avaliações
- Interacciones Débiles Entre BiomoléculasDocumento4 páginasInteracciones Débiles Entre BiomoléculasWolfgang MckenziieAinda não há avaliações
- Hoja de Trabajo - PH, Soluciones Buffer y Ecuación de Henderson HasselbalchDocumento2 páginasHoja de Trabajo - PH, Soluciones Buffer y Ecuación de Henderson HasselbalchjulitaaaAinda não há avaliações
- Informe ElectrólitosDocumento4 páginasInforme ElectrólitosJazmin MoraAinda não há avaliações
- Cinética EnzimáticaDocumento9 páginasCinética EnzimáticaLourdes SoriaAinda não há avaliações
- Cap 7 Enzimas Mecanismo de AcciónDocumento6 páginasCap 7 Enzimas Mecanismo de AcciónGmo8 CAinda não há avaliações
- Enzimas OficialDocumento18 páginasEnzimas OficialIvan Gutierrez MujicaAinda não há avaliações
- Informe EnzimasDocumento17 páginasInforme EnzimasJunior Andrade JaqueAinda não há avaliações
- Bioquimica Tercer ParcialDocumento39 páginasBioquimica Tercer Parcialsabriii Mapofseul7 BTSAinda não há avaliações
- Enzimas y HormonasDocumento16 páginasEnzimas y HormonasMatthew Brooks100% (1)
- Lección #01 Disicipulado PDFDocumento13 páginasLección #01 Disicipulado PDFCésar TerronesAinda não há avaliações
- Casas Sulca Frank Renato ReformismoDocumento160 páginasCasas Sulca Frank Renato ReformismoCésar TerronesAinda não há avaliações
- Capítulo 8: El Verbo-Presente Indicativo Medio/PasivoDocumento6 páginasCapítulo 8: El Verbo-Presente Indicativo Medio/PasivoCésar TerronesAinda não há avaliações
- Capítulo 6: El Pronombre-Demostrativo Y Relativo: (Cerca) Libro, Sino Aquél (Lejos)Documento5 páginasCapítulo 6: El Pronombre-Demostrativo Y Relativo: (Cerca) Libro, Sino Aquél (Lejos)César TerronesAinda não há avaliações
- Hormonas CorticosuprarenalesDocumento9 páginasHormonas Corticosuprarenalesfiorela alexandraAinda não há avaliações
- AMINOACIDOSDocumento24 páginasAMINOACIDOSDaniela SmithAinda não há avaliações
- Free Test Qali 2o ParteDocumento9 páginasFree Test Qali 2o ParteJavier Ortega MimbreroAinda não há avaliações
- Diapositivas de PROTEINASDocumento21 páginasDiapositivas de PROTEINASfer carmonaAinda não há avaliações
- 7 Hidrólisis y Desnaturalización de Las ProteínasDocumento2 páginas7 Hidrólisis y Desnaturalización de Las ProteínaskellyAinda não há avaliações
- Universidad Nacional Agraria de La Selva: Vela GilbertoDocumento106 páginasUniversidad Nacional Agraria de La Selva: Vela GilbertoBeery CotrinAinda não há avaliações
- Esquemas Bioelementos y BiomoleculasDocumento8 páginasEsquemas Bioelementos y BiomoleculasSara CMAinda não há avaliações
- Energía LibreDocumento7 páginasEnergía LibreMayerli Sarai Salguero AlvarezAinda não há avaliações
- Capítulo 3 - Aminoácidos y PéptidosDocumento18 páginasCapítulo 3 - Aminoácidos y PéptidosHéctor RosalesAinda não há avaliações
- Cuestionario Metabolismo IntermediarioDocumento8 páginasCuestionario Metabolismo IntermediarioAmyEBermudezQuero0% (1)
- La Base Físico-Química de La VidaDocumento1 páginaLa Base Físico-Química de La VidaArtic AAinda não há avaliações
- Reconocimiento de BiomoleculasDocumento9 páginasReconocimiento de BiomoleculasWilson JaimesAinda não há avaliações
- Pruebas MoleDocumento279 páginasPruebas MoleANGHELO SEBASTHIAN GAVILANEZ DIAZAinda não há avaliações
- Aminoácidos para Alimentación de Caballos (Lisina)Documento8 páginasAminoácidos para Alimentación de Caballos (Lisina)Chistrian CruzAinda não há avaliações
- Medición Directa Versus El Valor Estimado Del Colesterol de LDLDocumento11 páginasMedición Directa Versus El Valor Estimado Del Colesterol de LDLKaren AriasAinda não há avaliações
- Desnaturalización de ProteínasDocumento3 páginasDesnaturalización de ProteínasAngel PereyraAinda não há avaliações
- Descubrimiento de La MitocondriaDocumento4 páginasDescubrimiento de La MitocondriaNico SosaAinda não há avaliações
- FarmacodinamiaDocumento57 páginasFarmacodinamiaDavid BarreraAinda não há avaliações
- Complemento Del ApunteDocumento3 páginasComplemento Del ApunteIsauraAinda não há avaliações
- Taller #6. BioQ 2 2020-2Documento3 páginasTaller #6. BioQ 2 2020-2Julián Andrés Lozano GómezAinda não há avaliações
- Mecanismos de Lesión CelularDocumento16 páginasMecanismos de Lesión CelularDoc Robert GregorioAinda não há avaliações
- Proteinas Presentación Grupo 1Documento31 páginasProteinas Presentación Grupo 1Sinia GómezAinda não há avaliações
- Alimentacion en Los GenesDocumento4 páginasAlimentacion en Los GenesYuraima GamardoAinda não há avaliações
- Clase #2 y 3 Las ProteínasDocumento3 páginasClase #2 y 3 Las ProteínasGeorgina OcañaAinda não há avaliações
- Ciclo de Krebs TutoríaDocumento2 páginasCiclo de Krebs TutoríaBeverlyAinda não há avaliações
- Ciclo de KrebsDocumento8 páginasCiclo de KrebsAnthony GomezAinda não há avaliações
- BRI Guía de Investigación Citocinas-2Documento4 páginasBRI Guía de Investigación Citocinas-2Abel CamachoAinda não há avaliações