Escolar Documentos
Profissional Documentos
Cultura Documentos
Abp Heterogeneo F 1
Enviado por
Jorge De Jesús Domínguez CatalánTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Abp Heterogeneo F 1
Enviado por
Jorge De Jesús Domínguez CatalánDireitos autorais:
Formatos disponíveis
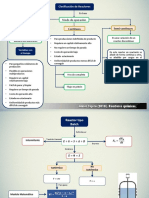
Ecuación
Cinética
Ecuaciones típicas de la cinética química en las cuales se
estudian las velocidades y mecanismo de reacción de las
reacciones químicas.
Características Propiedad Expresión
En la cinética en fase
gaseosa, por lo general se La expresión de r en función r= 𝐾 𝐴 𝛼
𝐵 𝛽
… 𝐿 𝑖
define r en función de de [] a T dada tiene la forma:
concentraciones moleculares rr = 𝑓 𝐴 𝐵 …
Donde
y no molares. Sin
embargo Los exponentes alfa y beta
Existe una restricción hasta i se denominan ordenes
Ejemplo parciales y su suma es el
orden total de la reacción.
El uso de concentraciones en
𝐻2 + 𝐼2 → 2𝐻𝐼 ecuaciones cinéticas es
estrictamente para sistemas
∴ 𝑟 = 𝐾 𝐻2 [𝐼2 ] ideales.
LEVINE, I. (2004). Principios de fisicoquímica. New York: Editorial Mc GrawHill.
Ecuación de velocidad de reacción en función
de la presión y concentración
Se hace la interpretación de como la velocidad de reacción
puede ser influida por propiedades externas como pueden ser
las mencionadas anteriormente.
Concentración. Presión
La velocidad de reacción La cual dice En un sistema gaseoso, la
aumenta con la concentración “Al incrementar la concentración de velocidad de reacción
lo cual es expresado en la los reactantes, la frecuencia de aumentará con la presión que
teoría de colisiones. colisión también aumenta” es aumentar laDonde
concentración
del gas.
Generará
Ejemplo Consideración
Un ejemplo es la medición de
Un incendio se compone de la velocidad de Al tomar en cuenta presión se
reacciones de combustión, las descomposición del debe de medir esta en
cuales poseen altas acetaldehído para producir condiciones isotérmicas e
concentraciones de reactantes, metano y monóxido de isocoras.
es por ello su velocidad. carbono.
LEVINE, I. (2004). Principios de fisicoquímica. New York: Editorial Mc Graw Hill.
Você também pode gostar
- Costos I PDFDocumento122 páginasCostos I PDFjosilito_281638Ainda não há avaliações
- Resultados: Tabla 1. Datos Experimentales de Los Índices de Refracción de Una Mezcla IsopropanolDocumento4 páginasResultados: Tabla 1. Datos Experimentales de Los Índices de Refracción de Una Mezcla IsopropanolJorge De Jesús Domínguez CatalánAinda não há avaliações
- 5 5Documento10 páginas5 5Jorge De Jesús Domínguez CatalánAinda não há avaliações
- Abp Heterogeneo F 1Documento9 páginasAbp Heterogeneo F 1Jorge De Jesús Domínguez CatalánAinda não há avaliações
- Enlace PeptidicoDocumento5 páginasEnlace PeptidicoJorge De Jesús Domínguez CatalánAinda não há avaliações
- EvaluacionDocumento44 páginasEvaluacionJorge De Jesús Domínguez CatalánAinda não há avaliações
- Presión de VaporDocumento2 páginasPresión de VaporJorge De Jesús Domínguez CatalánAinda não há avaliações
- Paso 4 de Abp Ejercicio 1Documento1 páginaPaso 4 de Abp Ejercicio 1Jorge De Jesús Domínguez CatalánAinda não há avaliações
- Abp Heterogeneo F 1Documento9 páginasAbp Heterogeneo F 1Jorge De Jesús Domínguez CatalánAinda não há avaliações
- IndiceDocumento3 páginasIndiceJorge De Jesús Domínguez CatalánAinda não há avaliações
- Estudio de La Precipitación y Recuperación Del Fósforo Presente en Las Aguas Residuales en Forma de EstruvitaDocumento1 páginaEstudio de La Precipitación y Recuperación Del Fósforo Presente en Las Aguas Residuales en Forma de EstruvitaJorge De Jesús Domínguez CatalánAinda não há avaliações
- Hoja KMMKDocumento3 páginasHoja KMMKJorge De Jesús Domínguez CatalánAinda não há avaliações
- Paso IV Ejercicio 2 y Diagrama HiDocumento2 páginasPaso IV Ejercicio 2 y Diagrama HiJorge De Jesús Domínguez CatalánAinda não há avaliações
- Or IndiceDocumento2 páginasOr IndiceJorge De Jesús Domínguez CatalánAinda não há avaliações
- RecuperaciónDocumento1 páginaRecuperaciónJorge De Jesús Domínguez CatalánAinda não há avaliações
- Libro Etanol AguaDocumento1 páginaLibro Etanol AguaJorge De Jesús Domínguez CatalánAinda não há avaliações
- Estudio de La Precipitación y Recuperación Del Fósforo Presente en Las Aguas Residuales en Forma de EstruvitaDocumento1 páginaEstudio de La Precipitación y Recuperación Del Fósforo Presente en Las Aguas Residuales en Forma de EstruvitaJorge De Jesús Domínguez CatalánAinda não há avaliações
- Resumen Proceso ResumenDocumento13 páginasResumen Proceso ResumenJorge De Jesús Domínguez CatalánAinda não há avaliações
- Costos IDocumento4 páginasCostos IJorge De Jesús Domínguez CatalánAinda não há avaliações
- Tiosulfato de SodioDocumento13 páginasTiosulfato de SodioJorge De Jesús Domínguez CatalánAinda não há avaliações
- VentiDocumento2 páginasVentiJorge De Jesús Domínguez CatalánAinda não há avaliações
- Articulo Secado de CañaDocumento11 páginasArticulo Secado de CañaJorge De Jesús Domínguez CatalánAinda não há avaliações
- Presión de VaporDocumento2 páginasPresión de VaporJorge De Jesús Domínguez CatalánAinda não há avaliações
- Tecnológico Nacional de Méxic1Documento9 páginasTecnológico Nacional de Méxic1Jorge De Jesús Domínguez CatalánAinda não há avaliações
- Instrum Didac Ago-Dic 2018 Reactores QuimicosDocumento11 páginasInstrum Didac Ago-Dic 2018 Reactores QuimicosJorge De Jesús Domínguez CatalánAinda não há avaliações
- p7 Test OrdenamientoDocumento7 páginasp7 Test OrdenamientoJorge De Jesús Domínguez CatalánAinda não há avaliações
- Serie de Diagramas Conceptuales t1 FisicoquímicaDocumento7 páginasSerie de Diagramas Conceptuales t1 FisicoquímicaJorge De Jesús Domínguez CatalánAinda não há avaliações
- Resultados de CALORÍMETRODocumento3 páginasResultados de CALORÍMETROJorge De Jesús Domínguez CatalánAinda não há avaliações
- Practica 6 Marco Teórico: Ecuación Tubo VenturiDocumento12 páginasPractica 6 Marco Teórico: Ecuación Tubo VenturiJorge De Jesús Domínguez CatalánAinda não há avaliações
- OPTI CCA-TS (Manual Usuario)Documento222 páginasOPTI CCA-TS (Manual Usuario)Facundo SilvaAinda não há avaliações
- Abonos FertilizantesDocumento5 páginasAbonos FertilizantesevelynAinda não há avaliações
- 047b71 Ficha Tecnica Lamina Alfajor o AntideslizanteDocumento2 páginas047b71 Ficha Tecnica Lamina Alfajor o Antideslizantesergio hurtadoAinda não há avaliações
- Tabla PeriodicaDocumento14 páginasTabla PeriodicaRodrigo Ornelas50% (2)
- Mi Tarea de Las Reacciones QuimicasDocumento5 páginasMi Tarea de Las Reacciones QuimicasRommyna Yáñez CeballosAinda não há avaliações
- Compuestos InorganicosDocumento2 páginasCompuestos InorganicosKaren Lia ColmenaresAinda não há avaliações
- Practica No 4 Química Analitica II FIQ 2023Documento2 páginasPractica No 4 Química Analitica II FIQ 2023Sara EstherAinda não há avaliações
- Detergente LíquidoDocumento2 páginasDetergente LíquidoKarla De Baños LaraAinda não há avaliações
- MSDS Desiccare Silica Gel Desiccant 062112.en - EsDocumento3 páginasMSDS Desiccare Silica Gel Desiccant 062112.en - EsPráctica Prevención krcc IquiqueAinda não há avaliações
- Aceites y GrasasDocumento16 páginasAceites y Grasaslizet estefanyAinda não há avaliações
- Q Sem7Documento7 páginasQ Sem7Nils Quiña PomaAinda não há avaliações
- Informe de Resultados Calidad de AguaDocumento5 páginasInforme de Resultados Calidad de AguaJaime AntonioAinda não há avaliações
- EXAMEN3P Ciclo Vacacional 2019Documento5 páginasEXAMEN3P Ciclo Vacacional 2019johanAinda não há avaliações
- Resumen de GeoquimicaDocumento43 páginasResumen de GeoquimicaClaudia Viviana Avila VeraAinda não há avaliações
- Tabla 1Documento6 páginasTabla 1Anlly Liceth Acosta MesaAinda não há avaliações
- Laboratorio9-Zinc Cadmio y MercurioDocumento12 páginasLaboratorio9-Zinc Cadmio y MercuriosherajekiAinda não há avaliações
- SelvolPVOH SpecialtyCoatings SP PDFDocumento4 páginasSelvolPVOH SpecialtyCoatings SP PDFrafaeldelperu1982Ainda não há avaliações
- Unidad 2 - Tarea 3 - Propiedades Químicas Trabajo ColaborativoDocumento19 páginasUnidad 2 - Tarea 3 - Propiedades Químicas Trabajo ColaborativoYORMAN XIRAUS GARCIA TORRESAinda não há avaliações
- Control Calidad de La LecheDocumento13 páginasControl Calidad de La LecheEliana SegoviaAinda não há avaliações
- Obtencion de Halogenuros de AlquiloDocumento12 páginasObtencion de Halogenuros de AlquiloJOHAN LARA PAQUIAinda não há avaliações
- MSDS Supermate A Blanco Combinaciones PDFDocumento11 páginasMSDS Supermate A Blanco Combinaciones PDFJohnny AlvaroAinda não há avaliações
- Cotización de Bureta Brand Digital Brnd4760161Documento2 páginasCotización de Bureta Brand Digital Brnd4760161TomAinda não há avaliações
- Práctica No.3Documento6 páginasPráctica No.3Mariel MirandaAinda não há avaliações
- Isomeria de Compuestos de CoordinacionDocumento5 páginasIsomeria de Compuestos de CoordinacionJesus GuillenAinda não há avaliações
- Trabajo Eje 3 QuimicaDocumento5 páginasTrabajo Eje 3 Quimicalrivas24Ainda não há avaliações
- El ProtònDocumento4 páginasEl ProtònSari ARAinda não há avaliações
- Trabajo Final de Quimica Grado UndecimoDocumento5 páginasTrabajo Final de Quimica Grado UndecimoLisseth Dahiana CañasAinda não há avaliações
- Control de Calidad de Productos Farmacéuticos S, L y Ss Según USPDocumento65 páginasControl de Calidad de Productos Farmacéuticos S, L y Ss Según USPCharlotte RiveraAinda não há avaliações
- Ácidos CarboxílicosDocumento4 páginasÁcidos Carboxílicosdaniela holsbergAinda não há avaliações
- Ficha F600M 1Documento1 páginaFicha F600M 1ROSA ALEXANDRA DE LA CADENA JULONAinda não há avaliações