Escolar Documentos
Profissional Documentos
Cultura Documentos
Alkena
Enviado por
Grace100%(1)100% acharam este documento útil (1 voto)
156 visualizações42 páginasalkena dan turunannya
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PPTX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoalkena dan turunannya
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
100%(1)100% acharam este documento útil (1 voto)
156 visualizações42 páginasAlkena
Enviado por
Gracealkena dan turunannya
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
Você está na página 1de 42
Bab 6.
Alkena: Struktur dan Aktivitas
6.1 Pembuatan dan Penggunaan Alkena di Industri
6.2 Menghitung derajat ketidak jenuhan
6.3 Tatanama
6.4 Isomer cis-trans Alkena
6.5 Aturan penman Z dan E
6.6 Kestabilan Alkena
6.7 ReaksiAdisi Elektrofilik Alkena
6.8 Orientasi Adisi Elektrofilik : Aturan Markonikov
6.9 Struktrur dan Kestabilan Karbokation
6.10 Postulasi Hammond
6.11 Pembuktian Mekanisme Adisi Elektrofilik :
Penyusunan Ulang Karbokation
SENYAWA ALKENA
Senyawa ikatan rangkap karbon ada dalam kelompok
senyawa organic umum dan molekul biologi,
sehingga pemahaman sifat senyawa ini sangat
dibutuhkan.
Dalam bab ini kita akan lihat beberapa konsekwensi
stereoisomer alkena dan focus pada keragaman dan
kelompok reaksi umum senyawa alkena, reaksi adisi
elektrofilik.
6.1 Pembuatan dan Penggunaan Alkena
Etilena, propilena, dan butena dibuat secara
industry melalui proses cracking alkane (C2-C8)
6.2 MENGHITUNG DERAJAT KETIDAK JENUHAN
Senyawa Organohalogen (C,H, X dimana X= F, Cl, Br atau I)
Subtituen halogen bertidak sama seperti pengantian untuk
hydrogen dalam molekul organic, sehingga kita dapat
menambahkan penggantian halogen dengan hydrogen
hingga didapat molekul akhirnya guna menentukam derajat
ketidak jenuhan.
Senyawa organooksigen (C, H, O) oksigen membentuk
dua ikatan sehingga oksigen tidak mempengaruhi formula
hidrokarbon equivalen dan dapat diabaikan saat
perhitungan derajat ketidak jenuhan. Anda dapat
meyakinkan ini dengan melihat pengaruh penambahan
atom oksigen pada senyawa alkane C-C menjadi C-O-C
atau C-H menjadi C-OH, dan terlihat tidak ada pengaruh
pada jumlah hydrogen.
Senyawa organo Nitrogen (C, H, N) Nitrogen
membentuk tiga ikatan, sehingga senyawa
organonitrogen memiliki satu hydrogen lebih banyak
dibanding hidrokarbon; sehingga kita perlu mengurangi
jumlah nitrogen dari jumlah hydrogen yang ada untuk
mendapatkan formula hidrokarbon yang equivalen.
Sekali lagi anda dapat meyakinkan hal ini dengan
menambahkan atom nitrogen dalam struktur ikatan
alkane C-C menjadi C-NH-C atau CH menjadi C-NH2. Hal
ini berarti ada penambahan satu hydrogen dalam
molekul.Sehingga kita harus mengurangi satu hydrogen
untuk mendapatkan formula hidrokarbon yang
equivalen. Contoh untuk formula C5H9N maka formula
equivalennya menjadi C5H8 dan ini berarti ada dua
derajat ketidak jenuhan.
Kesimpulan
1. Tambahkan jumlah halogen sebagai H dalam formula
equivalen
2. Abaikan jumlah oksigen dalam formula equivalen
3. Kurangi jumlah nitrogen dari jumlah H dalam formula
Senyawa diazepam atau dikenal dengan Valium
memiliki tiga cincin, enam ikatan rangkap dua dan
formula C16H?ClNO2. Berapa banyak hydrogen
yang dimiliki diazepam (lakukan perhitungan
jumlah hydrogen tetapi tanpa menghitung satu
persatu dari hydrogen dalam sstruktur.
6.3 TATANAMA ALKENA
Tahap 1
Tentukan krangka utama senyawa hidrokarbon. Tetapkan
rantai karbon terpanjang yang mengandung ikatan rangkap
dan beri nama senyawa yang sesuai menggunakan akhiran -
ena
Tahap 2
Beri penomeran rantai atom karbon . Mulai dari dari
ujung rantai yang terdekat dengan ikatan rangkap atau
bila jarak ikatan rangkap dengan ujung rantai nya sama,
mulai dari titik cabang rantai terdekat. Aturan ini
menjamin bahwa ikatan rangkap pada karbon akan
menerima kemungkinan nilai terendah.
Tahap 3
Tuliskan nama senyawa secara lengkap. Urutan
subtituen disesuakan dengan posisinya dalam rantai dan
susun secara alfabetik . Tunjukkan posisi ikatan rangkap
dengan memberikan penomeran pada karbon alkena
pertama dan tempatkan nilai tersebut sebelum nama
kerangka utama hidrokarbon. Jika ada lebih dari satu
ikatan rangkap tunjukan posisi masing masing ikatan
rangkap dan gunaka ssatu akhiran : diena, triena dst.
Kita harus mengingat bahwa IUPAC telah merubah
penamaan tersebut dan merekomendasikannya tahun
1993 untuk penenempatan ikatan rangkap langsung
sebelum akhiran –ena . misalnya, penaman but-2-ena
yang sebelumnya 2-butena. Perubahan ini tidak
secara luas diterima oleh komunitas ahli kimia. Namun
anda perlu mengingat pada suatu saat menemui
system yang baru
Penamaan senyawa sikloalkena sama halnya untuk rantai
terbuka alkena tetapi karena tidak ada rantai akhir dan awal
nya, kita beri penomeran C1 dan C2 diantara ikatan
rangkapnya dan subtituen pertama memiliki nomer
serendah mungkin.
Untuk alasan sejarah, ada beberapa senyawa alkena menggunakan
nama umum atau common name dan ini sudah diterima dala
ketentuan IUPAC misalnya senyawa alkena turunan dari etana
seharusnya disebut etena, tetapi senyawa ini lebih dikenal dengan
etilena.
6.4 Isomer Cis-Trans pada Alkena
Karena rotasi ikatan tidak terjadi, maka kedua 2 butena tidak dapat
secara spontan dipertukarkan, kedua senyawa nya berbeda dan dapat
di isolasi. Untuk contoh disubtitusi alkane, kita dapat menyatakan
bahwa kedua senyawa tersebut sebagai senyawa stereoisomer cis-
trans.
Keisomeran cis-trans tidak dibatasi pada alkena disubtitusi.
Hal ini dapat terjadi pula pada ikatan rangkap yang
mengalami subtitusi dengan gugus yang berbeda. Namun
bila salah satu atom karbon dari C=C mengikat gugus yang
sama maka cis-tran isomer tidak dimungkinkan.
6.5 Aturan urutan : E- dan Z
Ketentuan dari aturan Cahn-Ingold-Prelog.
Aturan 1
Asumsikan ikatan karbon dalam keadaan terpisah, perhatikan masing
masing atom yang secara langsung terikat pada karbon kemudian
lakukan urutan prioritas berdasarkan nomer atom. Atom dengan
nomer atom terbesar memperoleh prioritas pertama dan
selanjutnya atom dengan nomer atom lebih rendah.
Aturan 2
Apabila keputusan tidak bisa diambil melalui skala prioritas pada atom
pertama, lihat urutan dari atom ke 2, 3, atau ke 4 yang menjauhi ikatan
rangkap sampai diperoleh perbedaan skala prioritas.
Aturan 3
6.6 KESTABILAN ALKENA
Tingkat kestabilan alkena dipengaruhi oleh kombinasi dua
faktor. Pertama oleh penstabilan interaksi antara ikatan p
dari C=C dan dengan ikatan s C-H subtituen.
Dalam batasan ikatan valensi, interaksi yang terjadi disebut
hiperkonyugasi. Dalam penjelasan orbital molekul, ada
ikatan MO (molukular orbital) yang dapat diperluas hingga
C=C-C-H
Factor ke 2 yang memeberikan konstribusi kestabilan alkena melibatkan
kekuatan ikatan antara karbon sp2 dan karbon sp3 lebih kuat dibandingkan
antara ikat sp3 dengan sp3. Sehingga dengan membandingkan 1-butena
dengan 2-butena, monosubtitusi isomer memiliki satu ikatan sp3-sp3 dan
satu ikatan sp3-sp2, sedangkan pada isomer disubtitusi memiliki dua ikatan
sp3-sp2.
6.7 REAKSI ADISI ELEKTROFILIK ALKENA
Intermediate
karbokation
PENULISAN REAKSI ORGANIK
6.8 Orientasi Adisi Elektrofilik: Aturan Markovnikov
Aturan Mrakovnikov
Você também pode gostar
- Reaksi Substitusi NukleofilikDocumento58 páginasReaksi Substitusi NukleofilikRizky Arihta25% (4)
- Makalah Kimor Organologam BaityDocumento17 páginasMakalah Kimor Organologam Baityfebrina100% (1)
- Modul Kimia Organik (Senyawa Karbon)Documento167 páginasModul Kimia Organik (Senyawa Karbon)Yulia CitraAinda não há avaliações
- LN AlkenaDocumento29 páginasLN Alkenaandro sihombingAinda não há avaliações
- AsamAminoDocumento6 páginasAsamAminoAndi'Anhy Zhiee PutrhyBungsuAinda não há avaliações
- Aldehid Dan KtonDocumento21 páginasAldehid Dan KtonFatma Cahyani100% (1)
- AlkenaDocumento89 páginasAlkenaThohaioh NoerAinda não há avaliações
- Alkena Dan Kalium Manganat (Vii) : D. Reaksi Dengan Kmno4 (Uji Baeyer)Documento11 páginasAlkena Dan Kalium Manganat (Vii) : D. Reaksi Dengan Kmno4 (Uji Baeyer)Olvi LakahinaAinda não há avaliações
- Stabilitas Karbokation Dan HiperkonjugasiDocumento12 páginasStabilitas Karbokation Dan HiperkonjugasiPuthree PandjaiitanAinda não há avaliações
- Alkohol Dan EsterDocumento37 páginasAlkohol Dan EsterErkaWulAinda não há avaliações
- Diktat UAS KIMOR Semester 2Documento27 páginasDiktat UAS KIMOR Semester 2muthia rizki hidayatiAinda não há avaliações
- Ringkasan Materi Kimia Dan Soal Plus Pembahasan PDFDocumento169 páginasRingkasan Materi Kimia Dan Soal Plus Pembahasan PDFAdyna RahmasariAinda não há avaliações
- Jurnal PDFDocumento11 páginasJurnal PDFSinta Silviani Dwi LestariAinda não há avaliações
- 2 FalsafahBiokimiaDocumento12 páginas2 FalsafahBiokimiaPurnomoAinda não há avaliações
- REAKSI SUBTITUSIDocumento17 páginasREAKSI SUBTITUSIRetno Dwi HartantiAinda não há avaliações
- Dasar Teori Asam AminoDocumento3 páginasDasar Teori Asam AminoArya Mega UtamiAinda não há avaliações
- Review Jurnal SteroidDocumento2 páginasReview Jurnal SteroidNi Nengah Sri IndiyaniAinda não há avaliações
- Makalah Fenol Dan FenolatDocumento11 páginasMakalah Fenol Dan FenolatRiko Pratama100% (1)
- Stereokimia MolekulDocumento4 páginasStereokimia MolekulSeskia RenensenataAinda não há avaliações
- RX SNi, SNi Alil, Lingkar, AromatikDocumento16 páginasRX SNi, SNi Alil, Lingkar, AromatikIslawatiAinda não há avaliações
- K 1 5Documento10 páginasK 1 5rudolfbyAinda não há avaliações
- Kimia KomputasiDocumento15 páginasKimia KomputasiTisenda TimiselaAinda não há avaliações
- Hidrokarbon 1Documento7 páginasHidrokarbon 1Michelle AdeliaAinda não há avaliações
- ASAM SINAMATDocumento7 páginasASAM SINAMATDiah UtamiAinda não há avaliações
- Reaksi Bersaing SN1 Dan E1Documento3 páginasReaksi Bersaing SN1 Dan E1Regina TheresyaAinda não há avaliações
- Aplikasi Teori Hsab Pada Pemisahan MaterialDocumento17 páginasAplikasi Teori Hsab Pada Pemisahan MaterialNur Fatimah100% (1)
- Seli Andika - A1F018019 - Sintesis Kompleks Nikel MakrosiklikDocumento15 páginasSeli Andika - A1F018019 - Sintesis Kompleks Nikel MakrosiklikDWIANIAinda não há avaliações
- Addisi MolekulDocumento22 páginasAddisi MolekulIslawati100% (1)
- 5 - Polimerisasi KondensasiDocumento12 páginas5 - Polimerisasi KondensasiheruAinda não há avaliações
- KONDENSASI CLAISEN Dan Sintesis Etil AsetatDocumento4 páginasKONDENSASI CLAISEN Dan Sintesis Etil AsetatMoehammad Dihanzt T-zeroneAinda não há avaliações
- SEJARAH BENZENADocumento4 páginasSEJARAH BENZENAanggun2901Ainda não há avaliações
- Biosintesis AlkaloidDocumento3 páginasBiosintesis AlkaloidKhalil MubarakAinda não há avaliações
- Laporan Kimia Komputasi-2Documento8 páginasLaporan Kimia Komputasi-2Lalu Ardian Gunawan100% (1)
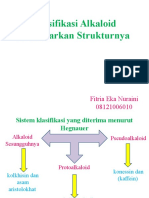
- Fitria Eka Nuraini (Alkaloid)Documento76 páginasFitria Eka Nuraini (Alkaloid)Fitria Eka NurainiAinda não há avaliações
- LAPORAN PERCOBAAN 6 PROTEIN (Munadhiroh)Documento34 páginasLAPORAN PERCOBAAN 6 PROTEIN (Munadhiroh)Sylvianoer20Ainda não há avaliações
- Geometri MolekulDocumento7 páginasGeometri MolekulNurlaila Ela IlaAinda não há avaliações
- Arena Dan AromatisitasDocumento154 páginasArena Dan AromatisitasVita Maryam H.100% (2)
- Karbanion PDFDocumento14 páginasKarbanion PDFMuhammad SalehAinda não há avaliações
- Kimia Organik FisikDocumento27 páginasKimia Organik FisikIsmaMardaneniAinda não há avaliações
- Perte. NMR 1Documento65 páginasPerte. NMR 1Seskia RenensenataAinda não há avaliações
- Asam Amino, Peptida Dan ProteinDocumento36 páginasAsam Amino, Peptida Dan ProteinNurhayati SihombingAinda não há avaliações
- Biokimia Kel 3 - (Spingolipid)Documento14 páginasBiokimia Kel 3 - (Spingolipid)Ilham Alfian RahmatAinda não há avaliações
- Percobaan 2. Isolasi Trimiristin Dan Asam Dari Biji Pala MiristatDocumento20 páginasPercobaan 2. Isolasi Trimiristin Dan Asam Dari Biji Pala MiristatSri ArgariniAinda não há avaliações
- Sifat - Sifat AlkenaDocumento33 páginasSifat - Sifat Alkenaputry elzha meidayantiAinda não há avaliações
- Substitusi Aromatik Nukleofilik (Nitrasi Fenol)Documento5 páginasSubstitusi Aromatik Nukleofilik (Nitrasi Fenol)yanahnurjannahAinda não há avaliações
- Aktivasi Asam Lemak Di SitoplasmaDocumento2 páginasAktivasi Asam Lemak Di SitoplasmaestuyulianingsihAinda não há avaliações
- Makalah Kimia Anorganik Fisik Kelompok IDocumento29 páginasMakalah Kimia Anorganik Fisik Kelompok IBella RasmilaAinda não há avaliações
- Kompleks Ion dan Bilangan KoordinasiDocumento3 páginasKompleks Ion dan Bilangan KoordinasiAnonymous VYL7FpfZAinda não há avaliações
- Makalah Diels Alder FIXDocumento10 páginasMakalah Diels Alder FIXAsriandy RamadhanAinda não há avaliações
- Analisis Sel ElektrolisisDocumento2 páginasAnalisis Sel ElektrolisisUlil AmbriAinda não há avaliações
- Uji FitokimiaDocumento6 páginasUji Fitokimiafahri100% (1)
- Putri Nopita Sari - A1F018001 - SINTESIS KOMPLEKS NIKEL MAKROSIKLIK PDFDocumento15 páginasPutri Nopita Sari - A1F018001 - SINTESIS KOMPLEKS NIKEL MAKROSIKLIK PDFDWIANIAinda não há avaliações
- Karbonil Senyawa: Aldehida dan KetonDocumento59 páginasKarbonil Senyawa: Aldehida dan Ketonadrik syahirul fahmiAinda não há avaliações
- AminaDocumento25 páginasAminaMuhammad Sulthon SAinda não há avaliações
- ALKENADocumento41 páginasALKENAistri kyungsoAinda não há avaliações
- ALKENADocumento87 páginasALKENAandro sihombingAinda não há avaliações
- Hidrokarbon Tak JenuhDocumento10 páginasHidrokarbon Tak JenuhLuxun GregetAinda não há avaliações
- Produk Modul HidrokarbonDocumento25 páginasProduk Modul HidrokarbonFerdi P. SaputraAinda não há avaliações
- 5Documento20 páginas5Abdul GaniAinda não há avaliações
- Unsur-unsur Golongan IIIB, IVB, VB, VIB, VIIBDocumento50 páginasUnsur-unsur Golongan IIIB, IVB, VB, VIB, VIIBGrace100% (1)
- PENCEMARAN UDARA-kimia5Documento34 páginasPENCEMARAN UDARA-kimia5GraceAinda não há avaliações
- AlkenaDocumento42 páginasAlkenaGrace100% (1)
- Asam KarboksilatDocumento1 páginaAsam KarboksilatGraceAinda não há avaliações
- REAKSI ADISIDocumento33 páginasREAKSI ADISIGraceAinda não há avaliações
- Jeruk Penghantar ListrikDocumento2 páginasJeruk Penghantar ListrikGraceAinda não há avaliações
- Isolasi Sitral dari Minyak SerehDocumento7 páginasIsolasi Sitral dari Minyak SerehGraceAinda não há avaliações