Escolar Documentos
Profissional Documentos
Cultura Documentos
Trabalho TCL Zinco
Enviado por
Gabriela BuenoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Trabalho TCL Zinco
Enviado por
Gabriela BuenoDireitos autorais:
Formatos disponíveis
UNIVERSIDADE FEDERAL DE MATO GROSSO- UFMT
INSTITUTO DE CIÊNCIAS EXATAS E DA TERRA
DEPARTAMENTO DE QUÍMICA- LICENCIATURA EM QUÍMICA
O ZINCO E A TEORIAS DO CAMPO LIGANTE
Disciplina: Química Inorgânica II
Docente: Adriano Siqueira
Discentes: Francielle Mendes, Gabriel Stelzer, Gabriela Bueno Gonzales e Leticia Rosa
Cuiabá, dezembro de 2021
INTRODUÇÃO
A Teoria do Campo Cristalino TCC é bem A Teoria do Campo Ligante TCL veio para
sucedida na explicação das formas dos complementar a TCC. A teoria do campo
complexos (distorções) e suas propriedades ligante é parecida com a teoria do orbital
espectroscópicas e magnéticas, mas, ignora a molecular, onde é composta por diagramas
de níveis de energia dos orbitais
existência de interações covalentes que ocorrem
moleculares que são construídos a partir de
para alguns complexos.
orbitais atômicos do metal e das
A ordem dos ligantes na série espectroquímica combinações lineares dos orbitais dos
não pode ser explicada considerando apenas as ligantes.
forças eletrostáticas.
INTRODUÇÃO
Algumas contribuições da TCL:
1) Considera as ligações σ entre o átomo
metálico e os ligantes;
2) Considera as ligações π;
A Teoria do Campo Ligante TCL veio
3) Entendimento do ∆0 (HOMO e
para complementar a TCC. A teoria do
LUMO);
campo ligante é parecida com a teoria
do orbital molecular, onde é composta
por diagramas de níveis de energia dos O ∆o é uma explicação do por que a teoria do
orbitais moleculares que são construídos campo cristalino não pode explicar a série
espectroquímica.
a partir de orbitais atômicos do metal e
das combinações lineares dos orbitais
dos ligantes.
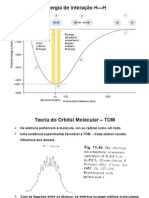
ORBITAIS MOLECULARES PARA COMPLEXOS
OCTAÉDRICOS
Ligantes doadores σ possuem apenas orbitais de simetria σ
(interação frontal) para interagir com o metal. Ex: H2O, NH3, em.
O símbolo ∆o também é usado na
teoria do campo ligante como uma
medida da magnitude das interações Interações σ
metal-ligante.
Os seis orbitais de doador ligante
preenchidos contribuem com doze
elétrons para os seis orbitais
moleculares de menor energia neste
diagrama. Os elétrons de valência
do metal ocupam os orbitais t2g e
eg*.
Interações doador- σ com orbitais s, p e d do zinco.
ORBITAIS MOLECULARES PARA COMPLEXOS TETRAEDRICOS
Interações σ e π
Ligantes doadores σ e π possuem além de orbitais
de simetria σ (interação frontal), orbitais de
simetria π (interagem através de mais de um
par de elétrons não ligantes, ou de orbitais
preenchidos) para interagir com o metal. Ex:
Halogênios (Cl-, F-, I-) e OH-.
Exemplo de complexo: [ZnCl4]2-
(tetraclorozincato).
Ligantes retrodoadores estão entre os mais
fortes da série espectroquímica,. Eles possuem
orbitais de simetria σ, e orbitais vazios de
simetria π. Ex: phen, NO2-, CN-, CO.
A SÉRIE ESPECTROQUÍMICA
Os ligantes que ocuparam os orbitais π , como os haletos, podem funcionar
como doadores-π. Eles doam esses elétrons para o metal, enquanto
simultaneamente doam seus elétrons s ligantes.
Quando os ligantes têm orbitais π * vacantes ou d de energia adequada, há a
possibilidade de retrodoação π, e os ligantes podem ser aceptores-π.
DIVISÃO DE ORBITAL E SPIN ELETRÔNICO
Para centros de metal d0 até d3 e d8 até
d10, à somente uma configuração de
elétron possível. No caso do Zinco,
apenas a configuração de spin alto
independente do ligante.
DIVISÃO DE ORBITAL E SPIN ELETRÔNICO
A energia de emparelhamento de dois elétrons
depende da energia coulombiana de repulsão entre
dois elétrons na mesma região do espaço, ∏ c e a
energia de troca mecânica quântica, ∏e.
Centros metálicos d10 como é o caso dos
compostos de zinco não possuem energia de
emparelhamento, assim como a energia de
desdobramento também será nula.
ENERGIAS DE ESTABILIZAÇÃO DO CAMPO LIGANTE
A diferença entre (1) a energia da configuração eletrônica t 2g/eg resultante da divisão do campo ligante e
(2) a energia hipotética da configuração eletrônica t 2g/eg com todos os cinco orbitais degenerados e
igualmente povoados é chamada de energia de estabilização do campo ligante (EECL).
ENERGIAS DE ESTABILIZAÇÃO DO CAMPO LIGANTE
CONCLUSÃO
REFERENCIAS
Atkins, Peter e Loretta Jones. Princípios químicos: The Quest for Insight: Quarta edição . WH Freeman and
Company, 2008.
Ayala, J.D. Química de Coordenação. Disponível em:http://qui.ufmg.br/~ayala/matdidatico/coord.pdf. Acesso
em: 27 de novembro de 2021.
• Harris, D.; Bertolucci, M. (1989). Simetria e Espectroscopia . Publicações Dover.
• MIESSLER, G.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5ª ed. São Paulo: Pearson Education, 2014.
Você também pode gostar
- Compostos de Coordenação - Parte 5Documento22 páginasCompostos de Coordenação - Parte 5Bruno AlvesAinda não há avaliações
- Resumo Geral Sobre Tom e TLVDocumento6 páginasResumo Geral Sobre Tom e TLVLEE MARXAinda não há avaliações
- Teoria Das BandasDocumento16 páginasTeoria Das BandasAldo Renan100% (1)
- Compostos ComplexosDocumento9 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- Teoria do Campo Ligante em Complexos de CoordenaçãoDocumento41 páginasTeoria do Campo Ligante em Complexos de CoordenaçãoAdonilson Freitas100% (3)
- Teoria do Campo Cristalino (TCC) explica cores dos complexos metálicosDocumento12 páginasTeoria do Campo Cristalino (TCC) explica cores dos complexos metálicosJoao CarlosAinda não há avaliações
- CHEMESTRYDocumento25 páginasCHEMESTRYGenivaldo LelisAinda não há avaliações
- Docsity Relatorio de Inorganica Experimental 3Documento20 páginasDocsity Relatorio de Inorganica Experimental 3paulo vitor macedoAinda não há avaliações
- TOM Aplicada Aos Compostos de CoordenaoDocumento4 páginasTOM Aplicada Aos Compostos de CoordenaoAna Laura ValerianoAinda não há avaliações
- LISTA 2 INORGÂNICA RESOLVIDA PARA ESTUDOS - Passei DiretoDocumento5 páginasLISTA 2 INORGÂNICA RESOLVIDA PARA ESTUDOS - Passei Diretofernando lealAinda não há avaliações
- Elementos de Transição e Propriedades dos Compostos de CoordenaçãoDocumento3 páginasElementos de Transição e Propriedades dos Compostos de CoordenaçãoJoed PiresAinda não há avaliações
- QCoordParte2Documento56 páginasQCoordParte2Edjaine Carriel RosaAinda não há avaliações
- Catalise em Compostos de CoordenaçãoDocumento42 páginasCatalise em Compostos de Coordenaçãonetochemistry0% (1)
- Encontros 1 e 2 - Introdução À Química Inorgânica e Breve Revisão de Estrutura Atômica e Propriedades Periódicas Dos ElementosDocumento23 páginasEncontros 1 e 2 - Introdução À Química Inorgânica e Breve Revisão de Estrutura Atômica e Propriedades Periódicas Dos ElementosVivian CyprianoAinda não há avaliações
- 4 - Química de Organometálicos - Bloco D - EstruturaDocumento26 páginas4 - Química de Organometálicos - Bloco D - EstruturaRF Braga100% (1)
- Explicando as contribuições da TCL e TFL para a ligação química e a série espectroquímicaDocumento2 páginasExplicando as contribuições da TCL e TFL para a ligação química e a série espectroquímicapaulajfgsAinda não há avaliações
- Ligações em Complexos de Metais de TransiçãoDocumento52 páginasLigações em Complexos de Metais de TransiçãoNathalyAinda não há avaliações
- Cloreto de HexamincobaltoIIIDocumento13 páginasCloreto de HexamincobaltoIIIYuri GomesAinda não há avaliações
- Estudos das propriedades químicas dos sais duplos de compostos complexosDocumento16 páginasEstudos das propriedades químicas dos sais duplos de compostos complexosMargarita CaceresAinda não há avaliações
- Compostos ComplexosDocumento14 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- Relatório 3 - QI543 - Espectros Eletrônicos de Absorção Na Região Do UV-VisDocumento15 páginasRelatório 3 - QI543 - Espectros Eletrônicos de Absorção Na Região Do UV-VisTalitha OrtizAinda não há avaliações
- Unidade 4-2010Documento26 páginasUnidade 4-2010Mango lavoAinda não há avaliações
- Química Inorgânica Farmacêutica Resumo 1 ParteDocumento19 páginasQuímica Inorgânica Farmacêutica Resumo 1 Parteluis.oliveira-1Ainda não há avaliações
- Teoria do Campo Cristalino e os Orbitais dDocumento68 páginasTeoria do Campo Cristalino e os Orbitais dDouglas RamosAinda não há avaliações
- Tom 1 PDFDocumento42 páginasTom 1 PDFmanuellaamattos19Ainda não há avaliações
- Ligações Covalentes - TomDocumento64 páginasLigações Covalentes - TomMarcus Vinicius100% (1)
- Estrutura da Matéria: Teoria do Campo Cristalino e Complexos MetálicosDocumento49 páginasEstrutura da Matéria: Teoria do Campo Cristalino e Complexos MetálicosAdonilson Freitas0% (1)
- Luz solar para produção de hidrogênioDocumento58 páginasLuz solar para produção de hidrogênioCarolina Croceta BombazarAinda não há avaliações
- Complexos de Metais do Bloco d: Números de Coordenação e GeometriasDocumento20 páginasComplexos de Metais do Bloco d: Números de Coordenação e GeometriasLis GonçalvesAinda não há avaliações
- Inmetro09pesquisador 010 10Documento20 páginasInmetro09pesquisador 010 10ccq256867Ainda não há avaliações
- Ligação Química: Tipos e CaracterísticasDocumento53 páginasLigação Química: Tipos e CaracterísticasRauan BrendonAinda não há avaliações
- Teoria Do Orbital Molecular Aplicada Aos Compostos de CoordenaçãoDocumento18 páginasTeoria Do Orbital Molecular Aplicada Aos Compostos de CoordenaçãoDaniel SantosAinda não há avaliações
- Ligações Metálicas - CompletaDocumento14 páginasLigações Metálicas - CompletaHoullsAinda não há avaliações
- Teoria do Orbital Molecular (TOMDocumento11 páginasTeoria do Orbital Molecular (TOMLUIZA NAZARETHAinda não há avaliações
- Teoria orbital molecular complexosDocumento10 páginasTeoria orbital molecular complexosAlexandra CristiniAinda não há avaliações
- Química Orgânica (Com Excercícios)Documento256 páginasQuímica Orgânica (Com Excercícios)Guilherme Flores100% (16)
- UNIVERSIDADE VEIGA DE ALMEIDA CETec – CENTRO DE ENGENHARIAS E TECNOLOGIASDocumento8 páginasUNIVERSIDADE VEIGA DE ALMEIDA CETec – CENTRO DE ENGENHARIAS E TECNOLOGIASJoece SamotAinda não há avaliações
- Aula 8 Distorc3a7c3a3o de Jahn TellerDocumento18 páginasAula 8 Distorc3a7c3a3o de Jahn TellerMarcio PereiraAinda não há avaliações
- Compostos Organometálicos do Bloco-dDocumento47 páginasCompostos Organometálicos do Bloco-dzael18Ainda não há avaliações
- TOM e ExerciciosDocumento3 páginasTOM e ExerciciosAndrade29Ainda não há avaliações
- Aulas 6 e 7 Complexos Octac3a9dricos Tetrac3a9dricos e Quadrado PlanaresDocumento36 páginasAulas 6 e 7 Complexos Octac3a9dricos Tetrac3a9dricos e Quadrado PlanaresJefferson CristianoAinda não há avaliações
- Complexos Tetraédricos + Jahn-TellerDocumento2 páginasComplexos Tetraédricos + Jahn-TellerPaula CarolinaAinda não há avaliações
- Aplicação Da Teoria Do Orbital MolecularDocumento14 páginasAplicação Da Teoria Do Orbital MolecularTatianyAinda não há avaliações
- Geometria Molecular ResumoDocumento10 páginasGeometria Molecular ResumoPedro Ricardo BessowAinda não há avaliações
- Exercícios Da Teoria Do OrbitalDocumento5 páginasExercícios Da Teoria Do OrbitalPaulo Henrique Barcellos França100% (1)
- Teoria Do Campo Cristalino (TCC)Documento28 páginasTeoria Do Campo Cristalino (TCC)Dharma Initiative100% (7)
- Aula 5 - Ligações Químicas Parte IIDocumento60 páginasAula 5 - Ligações Químicas Parte IIGustavo Carvalho SilvaAinda não há avaliações
- Quimica OrganicaDocumento257 páginasQuimica Organicaacgsoares14100% (2)
- Ligacoes Quimicas2Documento52 páginasLigacoes Quimicas2JOSE DINIZ DOS SANTOS JUNIORAinda não há avaliações
- Capitulo II - Estrutura Atomica e Ligacao InteratomicaDocumento24 páginasCapitulo II - Estrutura Atomica e Ligacao InteratomicaBenilde Gonçalvês Gulube GulubeAinda não há avaliações
- Resumo PPT 10Documento5 páginasResumo PPT 10Margarida GonçalvesAinda não há avaliações
- Química dos Materiais: Ligações Químicas e Estrutura MolecularDocumento76 páginasQuímica dos Materiais: Ligações Químicas e Estrutura MolecularFilipe de Andrade WanderleyAinda não há avaliações
- Teorias ligação compostos coordenaçãoDocumento19 páginasTeorias ligação compostos coordenaçãoNOOB FilosóficoAinda não há avaliações
- Introdução à Engenharia dos MateriaisDocumento3 páginasIntrodução à Engenharia dos MateriaisLarissa RibeiroAinda não há avaliações
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Lista4 Equilibrio Complexo OxidoReducaoDocumento1 páginaLista4 Equilibrio Complexo OxidoReducaoGabriela BuenoAinda não há avaliações
- Lista de Exercícios de Química Analítica QualitativaDocumento3 páginasLista de Exercícios de Química Analítica QualitativaGabriela BuenoAinda não há avaliações
- Lista2-Eletrólitos EquilíbrioSólidoLíquidoDocumento3 páginasLista2-Eletrólitos EquilíbrioSólidoLíquidoGabriela BuenoAinda não há avaliações
- Respostas sobre recursos hídricos e qualidade da águaDocumento6 páginasRespostas sobre recursos hídricos e qualidade da águaGabriela BuenoAinda não há avaliações
- Os saberes docentes e a profissionalizaçãoDocumento3 páginasOs saberes docentes e a profissionalizaçãoGabriela BuenoAinda não há avaliações
- Relatório Final Estágio 2 FINALDocumento18 páginasRelatório Final Estágio 2 FINALGabriela BuenoAinda não há avaliações
- A Química DOS Experimentos: Williene S. SantosDocumento16 páginasA Química DOS Experimentos: Williene S. Santosvandeson dos santosAinda não há avaliações
- FISPQ - Cloro Líquido 12%Documento7 páginasFISPQ - Cloro Líquido 12%Diogenes ParanhosAinda não há avaliações
- DETERGENTS AND COSMETICS Experimental Script For Manufacturing (In Portuguese) DETERGENTES E COSMÉTICOS Roteiro Experimental para FabricaçãoDocumento14 páginasDETERGENTS AND COSMETICS Experimental Script For Manufacturing (In Portuguese) DETERGENTES E COSMÉTICOS Roteiro Experimental para FabricaçãoNadja LimaAinda não há avaliações
- Polímeros de Adição e Condensação: Propriedades e AplicaçõesDocumento8 páginasPolímeros de Adição e Condensação: Propriedades e AplicaçõesJoao HenriqueAinda não há avaliações
- Ic 608 - Ece - Aula 1 - 2020.1Documento13 páginasIc 608 - Ece - Aula 1 - 2020.1FabriciaeDiego P. de Medeiros G. de LimaAinda não há avaliações
- Teste 1 (2018-2019)Documento9 páginasTeste 1 (2018-2019)Luísa CarmoAinda não há avaliações
- Síntese de macromoléculas viraisDocumento7 páginasSíntese de macromoléculas viraisJoão Victor VilaresAinda não há avaliações
- Metais importantes da indústria Moçambicana: Al, Fe, Zn, Au, Ag e CuDocumento14 páginasMetais importantes da indústria Moçambicana: Al, Fe, Zn, Au, Ag e CuRogério Maurício MiguelAinda não há avaliações
- Requisitos mínimos luvas cirúrgicas e procedimentosDocumento11 páginasRequisitos mínimos luvas cirúrgicas e procedimentosMariana MeirelesAinda não há avaliações
- 4 Lista 06 Nomenclatura de HidrocarbonetosDocumento3 páginas4 Lista 06 Nomenclatura de HidrocarbonetosFRANCISCO TARCIOAinda não há avaliações
- Transdução de SinaisDocumento6 páginasTransdução de SinaisthuanesgAinda não há avaliações
- Questionario 1 - QAG2Documento2 páginasQuestionario 1 - QAG2ALINE BEATRIZ SOARES PASSERINIAinda não há avaliações
- Ana Caroline Völz Ponath M05 - Atividade - Prevenção e Combate A Incêndio Nas EdificaçõesDocumento5 páginasAna Caroline Völz Ponath M05 - Atividade - Prevenção e Combate A Incêndio Nas EdificaçõesRonei Odair PonathAinda não há avaliações
- Adesão de materiais resinosos em restaurações dentáriasDocumento15 páginasAdesão de materiais resinosos em restaurações dentáriasLuana LimaAinda não há avaliações
- Microbiologia no SoloDocumento4 páginasMicrobiologia no SoloLucas GustavoAinda não há avaliações
- Amostragem de efluentes líquidosDocumento34 páginasAmostragem de efluentes líquidosIngrid Guimarães Silveira e Silva100% (1)
- Projetista Mecânico 4.o Freelancer IDocumento22 páginasProjetista Mecânico 4.o Freelancer IDavi RodriguesAinda não há avaliações
- Ciclo Biogeoquímico Carbono, Oxigênio, HidrogênioDocumento9 páginasCiclo Biogeoquímico Carbono, Oxigênio, Hidrogêniolima98santos.limaAinda não há avaliações
- Fluido Freio Super HDDocumento2 páginasFluido Freio Super HDWaldicyr Favoretti FilhoAinda não há avaliações
- Uréia enzimáticaDocumento2 páginasUréia enzimáticabernardo.silvaAinda não há avaliações
- Lista de exercícios de química com 10 questõesDocumento4 páginasLista de exercícios de química com 10 questõesRicardo LimaAinda não há avaliações
- Química Analítica Instrumental: Métodos e AplicaçõesDocumento47 páginasQuímica Analítica Instrumental: Métodos e AplicaçõesLilianeMaiaAinda não há avaliações
- Química Geral I - Aula 8 - Oitava Lista de Exercícios - GabaritoDocumento6 páginasQuímica Geral I - Aula 8 - Oitava Lista de Exercícios - Gabarito331rogermannAinda não há avaliações
- SuspensõesDocumento3 páginasSuspensõesRaquelAinda não há avaliações
- Cinetqui 001Documento31 páginasCinetqui 001Anonymous QMpWb7Vc3XAinda não há avaliações
- 11 DeterminacaodadurezatotalDocumento5 páginas11 DeterminacaodadurezatotalAna Luiza CamposAinda não há avaliações
- Prova Diagnóstica Do 3 AnoDocumento4 páginasProva Diagnóstica Do 3 AnoJuniorAinda não há avaliações
- Óleo absoluto de Rosa Damascena UFMG análise químicaDocumento1 páginaÓleo absoluto de Rosa Damascena UFMG análise químicaFabio SimãoAinda não há avaliações
- Desinfetante Minuano Floral FISPQDocumento6 páginasDesinfetante Minuano Floral FISPQTiago MeazzaAinda não há avaliações
- Ficha de emergência tinta inflamávelDocumento1 páginaFicha de emergência tinta inflamávelPaulo SilvaAinda não há avaliações