Escolar Documentos
Profissional Documentos
Cultura Documentos
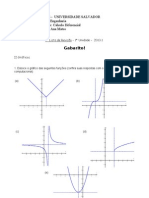
Estrutura At+ Mica PDF
Enviado por
Filipe AbreuTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estrutura At+ Mica PDF
Enviado por
Filipe AbreuDireitos autorais:
Formatos disponíveis
27/02/2011
1
Estrutura atmica
Professor: Maurcio Pereira
Disciplina: Qumica Geral I
DEPARTAMENTO DE ENGENHARIA E ARQUITETURA (DEAR)
Modelos atmicos
Demcrito
(sculo V a.c.)
A matria possui partculas
muito pequenas e indivisveis:
TOMOS
John Dalton (1808)
27/02/2011
2
Modelo de Dalton
John Dalton (1808)
Postulados de Dalton:
1- Toda matria formada por
entidades extremamente pequenas,
os tomos.
2- Os tomos so indivisveis.
3- O nmero de tomos diferentes
que existe na natureza
relativamente pequeno.
4- A formao de materiais se d
por meio de diferentes associaes
entre tomos iguais ou no. Essas
associaes so os tomos-
compostos (molcula).
= oxignio
= hidrognio
Algumas reaes qumicas
Estudo dos gases (lei das presses parciais)
Raios Catdicos (1890)
Como o desvio para
o lado positivo
A partcula carregada
negativamente!
+ + + + + + + +
- - - - - - - - - - -
desvio
Ay
l L
+
-
+
-
+
-
+
-
Uma alta voltagem produzia
radiao dentro do tubo
evacuado (raios catdicos)
O modelo de Dalton no
explicava esse fenmeno
27/02/2011
3
Modelo de Thomson
A
B
C
Fluido
positivo
Carga
negativa
Razo entre a carga eltrica
e a massa de um eltron
-1,76 x 10
-8
C/g
J. J. Thomson
(1897)
J. J. Thomson
(1897)
A
B
C
Fluido
positivo
Carga
negativa
Razo entre a carga eltrica
e a massa de um eltron
-1,76 x 10
-8
C/g
Carga de um e
-
-1,602 x 10
-19
C
Massa de um e
-
=
carga
carga/massa
= 9,1 x 10
-28
g
Modelo de Thomson
27/02/2011
4
Radiao e Campo eltrico
1908
Modelo de Rutherford
Rutherford
(1910)
27/02/2011
5
Modelo de Rutherford
O modelo atmico de Thomson
no explicava esse fenmeno
Modelo de Rutherford
Eltron
Prton Nutron
Uma vez que seria incmodo expressar
massas to pequenas em gramas, usa-se
a unidade de massa atmica (u).
1 u = 1,66054 x 10
-24
g
1 prton = 1,0073 u
1 nutron = 1,0087 u
1 eltron = 5,486 x 10
-4
u
Nmero de massa (A) = nmero de prtons (Z) + nmero de nutrons X
A
Z
27/02/2011
6
Estrutura eletrnica dos tomos
Por que elementos diferentes, submetidos a uma
chama, produzem cores diferentes?
Espectro visvel
27/02/2011
7
Espectro visvel
O efeito fotoeltrico e os ftons
Einstein sups que a luz trafega em
pacotes de energia denominado ftons
A energia de um fton: E = h v
Efeito fotoeltrico
Os eltrons s sero lanados se a frequncia
mnima for alcanada
27/02/2011
8
Modelo atmico de Bohr
Bohr observou o espectro de linhas de determinados elementos e admitiu que os
eltrons estavam confinados em estados especficos de energia, denominados
orbitais.
As cores de gases excitados surgem devido ao movimento dos eltrons entre os
estados de energia do tomo.
J que os estados de energia so quantizados, a luz emitida por tomos excitados
deve ser quantizada e aparecer como espectro de linhas.
Modelo para o tomo de H
( )
|
|
.
|
\
|
=
= v = A
2 2
18
1 1
J 10 18 . 2
i f
n n
hc
h E
Quando n
i
> n
f,
a energia emitida.
Quando n
f
> n
i,
a energia absorvida.
A rbita mais distante no modelo de Bohr tem n
prximo ao infinito e corresponde energia zero.
Os eltrons no modelo de Bohr podem se mover apenas
entre rbitas atravs da absoro e da emisso de energia
em quantum (hv).
27/02/2011
9
Sries espectrais do hidrognio
H
2 2
H
2 2
H
2 2
H
2 2
H
2 2
1 1 1
R n 3 4 Balmer
2 n
1 1 1
R n 2 3 Lyman
1 n
1 1 1
R n 4 5 Paschen
3 n
1 1 1
R n 5 6 Brackett
4 n
1 1 1
R n 6 7 Pfund
5 n
, , ...
, , ...
, , ...
, , ...
, , ...
| |
= =
|
\ .
| |
= =
|
\ .
| |
= =
|
\ .
| |
= =
|
\ .
| |
= =
|
\ .
Modelo Atmico de Bohr
Max Planck e Albert Einstein
foton
E h = u
34
h 6 63 x 10 Js
-
, =
27/02/2011
10
Modelo Atmico de Bohr (1913)
foton
E h = u
c u =
foton
hc
E
Modelo Atmico de Bohr (1913)
Baseado na idia da quantizao e da existncia dos ftons,
Bohr introduziu o seu modelo para o tomo de hidrognio,
baseado em postulados:
a) Um eltron se move em uma rbita circular em torno do
ncleo sob influncia da atrao coulombiana do ncleo,
(mecnica clssica).
b) O eltron s pode se mover em rbitas que apresentem
momentos angulares L quantizados:
,.... , , n n L 3 2 1 = =
27/02/2011
11
Modelo Atmico de Bohr (1913)
c) O eltron fica em rbitas estacionrias e no emite
radiao eletromagntica. Portanto, a sua energia total E
permanece constante.
d) Radiao emitida se um eltron, que se move
inicialmente numa rbita de energia E
i
, muda para uma
rbita de energia E
f
. A freqncia da radiao emitida dada
por:
Em outras palavras, o tomo emite um fton.
i f
E E
h
u =
Considerando o ncleo em repouso, a fora
eltrica no eltron dada por
2
0
2
1
4 r
e
F
tc
=
r
v
m
r
e
2
2
0
2
1
4
=
tc
Para uma rbita circular:
n L =
rmv L =
rm
n
v
=
2
2
0
2
n
me
h
r
n
t
c
=
Modelo atmico de Bohr (1913)
Se
e
v
-e, m
+e
27/02/2011
12
Assim, a energia das diferentes rbitas sero dadas por:
Portanto, Bohr prev que as rbitas tm raios:
eV
n n h
me
E
n
2 2 2 2
0
4
6 , 13 1
8
= =
c
2
2
0
2
n
me
h
r
n
t
c
=
2
0
2
0
me
h
r
t
c
=
2
0
n r r
n
=
com
ou
5291 0
0
, r =
ou
Mas:
r
e
r
e mv
U K E
0
2
0
2 2
8 4 2 tc tc
=
|
|
.
|
\
|
+ = + =
Modelo atmico de Bohr (1913)
As freqncias emitidas nas transies seriam:
Portanto, Bohr prev que:
1
3 2
0
4
74 , 109
8
= = cm
c h
me
R
H
c
|
.
|
\
|
=
2 2 3 2
0
4
'
'
1
'
1
8 n n h
me
h
E E
n n
n n
c
v
|
.
|
\
|
=
|
.
|
\
|
=
2 2 2 2 3 2
0
4
'
'
1 1 1
'
1
8
1
n n
R
n n c h
me
H
n n
c
Modelo atmico de Bohr (1913)
27/02/2011
13
O modelo de Bohr explicou as raias espectrais, conhecidas
para o tomo de hidrognio, e mostrou que deveriam existir
outras, fora do espectro visvel.
Modelo atmico de Bohr
Limitaes do modelo de Bohr
Pode explicar adequadamente apenas o espectro de linhas do tomo de
hidrognio.
Os eltrons no so completamente descritos como partculas pequenas.
O princpio da incerteza
O princpio da incerteza de Heisenberg: na escala de massa de partculas
atmicas, no podemos determinar exatamente a posio, a direo do
movimento e a velocidade simultaneamente.
Se Ax a incerteza da posio e Amv a incerteza do momento, ento:
t
> A A
4
h
mv x
27/02/2011
14
Mecnica quntica e orbitais
atmicos
A resoluo da equao leva s funes de onda.
A funo de onda fornece o contorno do orbital eletrnico (+).
O quadrado da funo de onda (+
2
)
fornece a probabilidade de se
encontrar o eltron, isto , d a densidade eletrnica para o tomo.
Schrdinger props uma equao que contm os termos onda e partcula.
Nmero quntico principal, n
O nmero quntico azimuthal, l
(refere-se aos orbitais: s, p, d e f)
O nmero quntico magntico, m
l
(fornecem a orientao do orbital no espao)
Mecnica quntica e orbitais
atmicos
Orbitais e nmeros qunticos
Os orbitais podem ser classificados em termos de energia para produzir um
diagrama de Aufbau.
medida que n aumenta, o espaamento entre os nveis de energia torna-se
menor.
27/02/2011
15
Mecnica quntica e orbitais
atmicos
Orbitais s
Todos os orbitais s so esfricos.
medida que n aumenta, os orbitais s ficam maiores.
medida que n aumenta, aumenta o nmero de ns.
Um n uma regio no espao onde a probabilidade de se
encontrar um eltron zero.
Em um n, +
2
= 0
Para um orbital s, o nmero de ns n-1.
Mecnica quntica e orbitais
atmicos
27/02/2011
16
Mecnica quntica e orbitais
atmicos
Orbitais p
Orbital p
Existem trs orbitais p: p
x
, p
y
, e p
z
.
Mecnica quntica e orbitais
atmicos
Orbitais d
27/02/2011
17
Mecnica quntica e orbitais
atmicos
Spin eletrnico e o princpio
da excluso de Pauli
O princpio da excluso de Pauli: dois eltrons no podem ter a mesma
srie de 4 nmeros qunticos. Portanto, dois eltrons no mesmo orbital
devem ter spins opostos.
Estrutura atmica
Exerccio
1) Qual a configurao eletrnica do oxignio (Z
O
= 8) e do sdio (Z
Na
= 11),
considerando a representao em nveis e subnveis de energia, e quantos eltrons
desemparelhados possui em cada um dos elementos?
27/02/2011
18
Estrutura atmica
Exerccio
1) Qual a configurao eletrnica do oxignio (Z
O
= 8) e do sdio (Z
Na
= 11),
considerando a representao em nveis e subnveis de energia, e quantos eltrons
desemparelhados possui em cada um dos elementos?
Estrutura atmica
Exerccio
1) Qual a configurao eletrnica do oxignio (Z
O
= 8) e do sdio (Z
Na
= 11),
considerando a representao em nveis e subnveis de energia, e quantos eltrons
desemparelhados possui em cada um dos elementos?
O : 1s
2
2s
2
2p
4
Na : 1s
2
2s
2
2p
6
3p
1
Você também pode gostar
- Projeto TrocadorDocumento47 páginasProjeto TrocadorFilipe AbreuAinda não há avaliações
- Aula 5 FT CalorDocumento13 páginasAula 5 FT CalorFilipe AbreuAinda não há avaliações
- Aula 01. Calculo IIIjjnynytcnucyDocumento65 páginasAula 01. Calculo IIIjjnynytcnucyFilipe AbreuAinda não há avaliações
- Gabarito Da ListaDocumento33 páginasGabarito Da ListaLenon NevesAinda não há avaliações
- 29082014-161915-2014.08 - Analise Abiove Do Mercado de BiodieselDocumento6 páginas29082014-161915-2014.08 - Analise Abiove Do Mercado de BiodieselFilipe AbreuAinda não há avaliações
- CáLculo Il - 1a Lista 2014.1Documento4 páginasCáLculo Il - 1a Lista 2014.1Filipe AbreuAinda não há avaliações
- Estrutura Atômica 2013Documento42 páginasEstrutura Atômica 2013Filipe AbreuAinda não há avaliações
- CorrosãoDocumento15 páginasCorrosãoFilipe AbreuAinda não há avaliações
- 1 Lista Reviso - GabaritoDocumento2 páginas1 Lista Reviso - GabaritoFilipe AbreuAinda não há avaliações
- Estrutura At+ Mica PDFDocumento18 páginasEstrutura At+ Mica PDFFilipe AbreuAinda não há avaliações