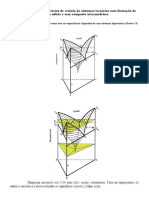
Escolar Documentos
Profissional Documentos
Cultura Documentos
Físico Química Equações e Constantes
Enviado por
maikousaadi0 notas0% acharam este documento útil (0 voto)
6 visualizações1 páginaDireitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
6 visualizações1 páginaFísico Química Equações e Constantes
Enviado por
maikousaadiDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 1
EQUAÇÕES E CONSTANTES
PV = nRT
U = q + w
w = – Pext (V2-V1)
w = – nRT ln (V2/V1) = – nRT Ln (P1/P2).
U = n Cv T
H = n Cp T
H = U + PV
Para gás monoatômico: Cv = 3/2 R ; Cp = 5/2 R
P1 V1 = P2 V2
= Cp / Cv
V2/ V1 = V3 / V4
S = q rev / T
S (universo) = S (sistema) + S (vizinhanças)
G = H – T S
rGo = rHo – T rSo
dG = dH – T dS – S dT
dG = V dP – S dT
(G / T)P = – S
(G / P)T = V
(G / )P, T = (B – A)
rG = rGo + RT Ln (PBb / PAa)
rGo = – RT Ln Keq
Ln Keq = (– rHo/RT) + (rSo/R)
1 atm L = 101,3 Joule
1000 J = 1 kJ
R = 8,31 J / K mol
R = 0,082 atm L / K mol
Você também pode gostar
- Mod TFC Geologia-UFRJDocumento19 páginasMod TFC Geologia-UFRJmaikousaadiAinda não há avaliações
- Captulo VI TermodinmicaDocumento44 páginasCaptulo VI TermodinmicaDanielle CruzAinda não há avaliações
- PDL Comercio E Representacao Eireli Danfe: #SérieDocumento1 páginaPDL Comercio E Representacao Eireli Danfe: #SériemaikousaadiAinda não há avaliações
- 113865-Texto Do Artigo-206419-1-10-20160405Documento20 páginas113865-Texto Do Artigo-206419-1-10-20160405maikousaadiAinda não há avaliações
- A.S.A.S Comercio E Servicos Ltda-Me DanfeDocumento1 páginaA.S.A.S Comercio E Servicos Ltda-Me DanfemaikousaadiAinda não há avaliações
- Material 11 Revisao Da Primeira e Segunda LeiDocumento2 páginasMaterial 11 Revisao Da Primeira e Segunda LeimaikousaadiAinda não há avaliações
- Material 9 FQ 2013 Revisão Teorica Do Capitulo 2 EntropiaDocumento2 páginasMaterial 9 FQ 2013 Revisão Teorica Do Capitulo 2 EntropiamaikousaadiAinda não há avaliações
- Material 1 FQ 2013 Trabalho Gas IdealDocumento3 páginasMaterial 1 FQ 2013 Trabalho Gas IdealmaikousaadiAinda não há avaliações
- Material 8 FQ 2013 Ciclo de Carnot Teoria Site Na WebDocumento1 páginaMaterial 8 FQ 2013 Ciclo de Carnot Teoria Site Na WebmaikousaadiAinda não há avaliações
- Material 7bis FQ Ciclo de Carnot ExercicioDocumento1 páginaMaterial 7bis FQ Ciclo de Carnot ExerciciomaikousaadiAinda não há avaliações
- Calor 24Documento3 páginasCalor 24Salmen Saleme GidraoAinda não há avaliações
- Material 5 FQ 2013 Processos AdiabaticosDocumento1 páginaMaterial 5 FQ 2013 Processos AdiabaticosmaikousaadiAinda não há avaliações
- Material 10 FQ Entropia Exercicios Processos Reversiveis e IrreversiveisDocumento3 páginasMaterial 10 FQ Entropia Exercicios Processos Reversiveis e IrreversiveismaikousaadiAinda não há avaliações
- Material 4 FQ Exercicios de Primeiro PrincipioDocumento3 páginasMaterial 4 FQ Exercicios de Primeiro PrincipiomaikousaadiAinda não há avaliações
- Material 2 FQ 2013 Exercicio Trabalho Gas IdealDocumento3 páginasMaterial 2 FQ 2013 Exercicio Trabalho Gas IdealmaikousaadiAinda não há avaliações
- Proposta de Resolução-Calendário Acadêmico 2014Documento4 páginasProposta de Resolução-Calendário Acadêmico 2014maikousaadiAinda não há avaliações
- Equações e ConstantesDocumento1 páginaEquações e ConstantesmaikousaadiAinda não há avaliações
- Material 32 Diagramas de Fase Sistemas BinariosDocumento10 páginasMaterial 32 Diagramas de Fase Sistemas BinariosmaikousaadiAinda não há avaliações
- Material 3 FQ 2013 Revisão Teórica Da Primeira LeiDocumento1 páginaMaterial 3 FQ 2013 Revisão Teórica Da Primeira LeimaikousaadiAinda não há avaliações
- Material 35 Diagramas de Fase Sistemas Ternarios Esfena Anortite VolastoniteDocumento8 páginasMaterial 35 Diagramas de Fase Sistemas Ternarios Esfena Anortite VolastonitemaikousaadiAinda não há avaliações
- Material 34 Diagramas de Fase Sistemas TernariosDocumento8 páginasMaterial 34 Diagramas de Fase Sistemas TernariosmaikousaadiAinda não há avaliações
- Material 33 Diagramas de Fase Sistemas BinariosDocumento9 páginasMaterial 33 Diagramas de Fase Sistemas BinariosmaikousaadiAinda não há avaliações
- FQ Geo Lista de Temas 2016 - 1Documento1 páginaFQ Geo Lista de Temas 2016 - 1maikousaadiAinda não há avaliações
- Físico Química Aula 21 (Exercicios)Documento5 páginasFísico Química Aula 21 (Exercicios)maikousaadiAinda não há avaliações
- Físico Química Aula 20 (Exercicios)Documento6 páginasFísico Química Aula 20 (Exercicios)maikousaadiAinda não há avaliações
- Físico Química Aula 20 (Exercicios)Documento6 páginasFísico Química Aula 20 (Exercicios)maikousaadiAinda não há avaliações
- Geometria Plana AreasDocumento79 páginasGeometria Plana AreasmaikousaadiAinda não há avaliações
- Sistemas de Medidas Geometria Plana e EspacialDocumento138 páginasSistemas de Medidas Geometria Plana e EspacialmaikousaadiAinda não há avaliações
- Texto 02 Conceitos PetrofisicaDocumento5 páginasTexto 02 Conceitos PetrofisicaCarlos MesquitaAinda não há avaliações