Escolar Documentos
Profissional Documentos
Cultura Documentos
Estequiometria
Estequiometria
Enviado por
Mayanderson RodriguesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estequiometria
Estequiometria
Enviado por
Mayanderson RodriguesDireitos autorais:
Formatos disponíveis
1
ESTEQUIOMETRIA
MEDINDO ELEMENTOS
2
ESTEQUIOMETRIA NOME DERIVADO da palavra
grega STOICHEION (elemento) e METRON (medida)
importante para medir concentrao de oznio na
atmosfera, ou o rendimento potencial de ouro de
uma pepita, por exemplo.
Vrias medidas em qumica so possveis graas a
aplicao da estequiometria
3
TRANSFORMAES DA
MATRIA
FSICAS:
4
TRANSFORMAES QUMICAS:
REAGENTES PRODUTOS
5
As transformaes qumicas (REAES) esto
baseadas em duas leis fundamentais:
CONSERVAO DAS MASSAS (LAVOISIER, 1774)
10 g de reagente 10 g de produto
1000 tomos de um elemento reagem
1000 tomos do elemento nos produtos (Dalton)
PROPORES DEFINIDAS (PROUST, 1807)
6
CONSERVAO DAS MASSAS NUMA REAO QUMICA A
MASSA DOS REAGENTES IGUAL A MASSA DOS PRODUTOS
NO H PERDA NEM GANHO DE MASSA
7
PROPORES DEFINIDAS OS ELEMENTOS
QUIMICOS, EM UM DADO COMPOSTO, ESTO
SEMPRE COMBINADOS NA MESMA PROPORO
EM MASSA
DECOMPONDO-SE ZnS sempre se obtem 1,000 g
de Zn para 0,490 g de S a composio constante
8
Mesmo as menores amostras com que trabalhamos no
laboratrio contm enormes nmeros de tomos, ons ou
molculas.
Por ex. uma colher de ch de gua (cerca de 5 mL), contm um
nmero muito grande de molculas, da ordem de sextilhes de
partculas.
No dia-a-dia usamos unidades de contagem como dzia (12
unidades) e grosa (144 objetos).
MOL UNIDADE DE QUANTIDADE DE MATRIA
Em qumica a unidade usada para contar tomos, molculas ou
ons o MOL:
quantidade de matria que contm tantos objetos quanto o
nmero de tomos contidos em 12 g de C
12
isotopicamente
puro.
9
MOL
O mol : origem da palavra latina moles
p
PORO, QUANTIDADE
A UNIDADE UTILIZADA PELOS
QUMICOS, RELACIONADA COM UM
N GRANDE DE TOMOS, ONS,
MOLCULAS
10
A DEFINIO DE MOL
12 g de
carbono-12
Quantidade de matria que contm o mesmo n de tomos
que em 12 g do istopo-12 do carbono
11
A definio do Sistema Internacional diz que a massa de 1 mol de
tomos de C
12
12 g.
O carbono natural no puro:
uma mistura de istopos com 98,90 % de C
12
e 1,10 % de C
13
:
A massa mdia de C na mistura 12,011 u (massa atmica do C nas
tabelas)
A massa de um n. de Avogadro destes tomos 12,011 g ou:
1 mol de tomos de C equivale a 12,011 g
UM MOL DE QUALQUER ELEMENTO TEM MASSA EM
GRAMAS IGUAL MASSA ATMICA DO ELEMENTO
12
LORENZO ROMANO
AMEDEO CARLO
AVOGADRO( 1776-1856)
N
A
= NMERO DE AVOGADRO =
6,022 X 10
23
6,02 x 10
23
OU
CONSTANTE
DE
AVOGADRO
13
6,02 x 10
23
1 mol de molculas de H
2
O 6,02 x 10
23
molculas de H
2
O
(602 sextilhes)
1 mol de tomos de C 6,02 x 10
23
tomos de C
1 mol de ons de Na+ 6,02 x 10
23
ons de Na+
1 mol de N 6,02 x 10
23
de tomos de N
1 mol de N
2
602 x 10
23
de molculas de N
2
MOL NMERO FIXO DE PARTCULAS
14
12 g de Carbono 32 g de Enxofre
64 g de Cobre 207 g de Chumbo
201 g de Mercrio
1 mol de tomos dos elementos C, S, Cu, Pb e Hg
15
1 mol de molculas de compostos moleculares
18 g de
H
2
O
46 g de
C
2
H
5
OH
180 g de
C
6
H
12
O
6
342 g de
C
12
H
22
O
11
GUA ETANOL GLICOSE SACAROSE
16
1 MOL DE FRMULAS UNITRIAS DE
COMPOSTOS INICOS
58 g de NaCl 100 g de CaCO
3
278 g de FeSO
4
.7H
2
O 78 g Na
2
O
2
17
Massa molecular: soma das massas atmicas dos tomos da
frmula qumica:
MM do H
2
SO
4
= 2 x 1,0 u do H + 32,1 u do S + 4 x 16,0 u do O
= 98,1 u
Massa molar: massa em gramas de 1 mol de partculas
MM do H
2
SO
4
= 98 u (uma molcula) MMolar: 98 g (1 mol =
6,02 x 10
23
molculas)
1 molcula 98 u 1 mol de molculas 98g
6,02 x 10
23
fator de converso
Utilizando o MOL
18
APLICANDO CLCULOS ESTEQUIOMTRICOS SIMPLES-
CONVERSES:
1) Massa para Mol:
Quantos mols de nquel (Ni) h em 4,50 g deste elemento?
Ni= 58,71 u, portanto 1 mol de tomos de Ni tem 58,71 g
4,50 g Ni x 1 mol Ni = 0,077 mol Ni
58,71 g Ni
2) Mol para Massa:
Quantos gramas de ouro (Au) existem em 0,250 mol deste metal?
1 mol de Au = 197,0 g
0,250 mol Au x 197,0 g Au = 49,25 g Au
1 mol Au
19
3) em frmulas qumicas:
Quantos mols de tomos de O esto combinados com 6,20 mols de tomos
de P no H
3
PO
4
?
6,20 mol P x 4 mol O = 24,8 mol O
1 mol P
4) Em frmulas mnimas e moleculares:
P
4
O
10
uma frmula molecular P
2
O
5
uma frmula simplificada
Em uma amostra de um composto de estanho (Sn) e cloro (Cl) de massa
2,57 g foram encontrados 1,17 g de estanho. Qual a frmula mnima da
substncia? (Cl = 2,57 -1,17 = 1,40 g)
Mol de Cl: 1,40 g Cl x 1 mol Cl = 0,0395 mol Cl
35,45 g
Mol de Sn: 1,17 g Sn x 1 mol Sn = 0,00986 mol Sn
118,7 g
SnCl
4
20
5) Porcentagem em massa a partir de frmulas
Calcule a composio percentual da sacarose C
12
H
22
O
11
Massa molar= 342 g/mol
% C = (12) 12 g x 100 % = 42,1 % C
342,0 g
% H = (22) 1,0 g x 100 % = 6,4 % H
342,0 g
% O = (11) 16,0 g x 100 % = 51,5 %
342,0 g
5) Porcentagem em massa a partir de frmulas
Calcule a composio percentual da sacarose C
12
H
22
O
11
Massa molar= 342 g/mol
% C = (12) 12 g x 100 % = 42,1 % C
342,0 g
% H = (22) 1,0 g x 100 % = 6,4 % H
342,0 g
% O = (11) 16,0 g x 100 % = 51,5 %
342,0 g
21
6) Frmula mnima a partir da centesimal
Um p branco utilizado em tintas, esmaltes e cermicas tem a
seguinte composio percentual: Ba 69,6 %, C 6,09 % e O 24,3
%. Qual a frmula mnima?
Ba: 69,6 g Ba x 1 mol Ba/ 137,3 g Ba = 0,507 mol Ba
C: 6,09 g C x 1 mol C/ 12,01 g C = 0,507 mol C
O: 24,3 g O x 1 mol O/16,00 g O = 1,52 mol O
Ba
0,507
C
0,507
O
1,52
ou melhor: BaCO
3
22
TIPOS DE REAES
PRECIPITAO
COMBUSTO
23
Marmore reagindo com
cido (CaCO
3
+ HCl)
Alumnio (Al) com HCl
Alumnio com
HNO
3
diluido
24
EQUAES QUMICAS
REAGENTES PRODUTOS
25
EQUAES QUMICAS
BALANCEADAS
2 Al
(s)
+ 3 Br
2(l)
1 Al
2
Br
6(s)
1- Quantidade relativa dos reagentes
2- Quantidade relativa dos produtos
3- O estado fsico de todas as
espcies participantes
26
NO BALANCEAMENTO: NDICES DAS
FRMULAS NO MUDAM
IDENTIDADE DAS SUBSTNCIAS
COEFICIENTES PODEM MUDAR
H
2
O diferente de H
2
O
2
H
2
O diferente de H
2
O
2
ndice
MOL coeficientes dos reagentes e produtos
(1) CH
4
+ 2 O
2
(1) CO
2
+ 2 H
2
O
coeficientes
27
BALANCEANDO UMA EQ.QUMICA
1- ESCREVER AS FRMULAS CORRETAS DE
REAGENTES E PRODUTOS
2- BALANCEAR O N DE TOMOS DE CARBONO
28
3- BALANCEAR N DE TOMOS DE HIDROGNIO
4- BALANCEAR O N DE TOMOS DE OXIGNIO
5- VERIFICAR SE TODOS OS ELEMENTOS ESTO
BALANCEADOS.
29
Da reao entre fsforo elementar P
4
c/
gs cloro Cl
2
, obtm-se PCl
3
.
QUAL A MASSA DE PCl
3
OBTIDA?
QUAL A MASSA DE Cl
2
NECESSRIA
para REAGIR COM 1,45 g de P
4
?
30
gramas de
reagente P
4
gramas de
produto PCl
3
mol de reagente
P
4
mol de produto
PCl
3
Fator estequiomtrico
x 1/massa molar massa
molar
x
31
1- ESCREVER A EQ.BALANCEADA P/ A
REAO
2-CALCULAR O N DE MOL DO P
4
32
3- USAR O FATOR ESTEQUIOMTRICO
PARA CALCULAR O N DE MOL DE Cl
2
DESEJADO
n. MOL DESEJADO = FATOR ESTEQUIOMTRICO (converso)
n. MOL DISPONVEL
33
4- CALCULAR A MASSA DE Cl
2
EM 7,02 x
10
-2
mol
A massa de cloro exigida para a reao
completa 4,98 g
A massa de cloro exigida para a reao
completa 4,98 g
34
5- USAR O FATOR ESTEQUIOMTRICO
PARA CALCULAR O N DE MOL DE PCl
3
QUE SER PRODUZIDO
Fator estequiomtrico
ou
Razo molar
35
6- CALCULAR A MASSA (g) DE PCl
3
EM 4,68 x 10
-2
MOL
A massa de PCl
3
produzida na reao de
1,45 g de P
4
com 4,98 g de Cl
2
de 6,43 g
de PCl
3
36
OCTANO, C
8
H
18
UM COMPOSTO
REPRESENTATIVO DA GASOLINA.
A EQ.QUMICA PARA A SUA COMBUSTO :
2C
8
H
18(l)
+ 25 O
2(g)
16 CO
2(g)
+ 18 H
2
O
(l)
A DENSIDADE DO OCTANO: 0,702 g/cm
3
.
CALCULE A MASSA DE CO
2
PRODUZIDO,
QUANDO 1 LITRO DE OCTANO QUEIMADO
APLICANDO AS RELAES ESTEQUIOMTRICAS
37
A massa de octano correspondente a 1 L
702 g (Utilizando-se m= d.V)
Da equao balanceada: 2 mol de octano
produzem 16 mol de CO
2
Massa CO
2
= 702 g octano X 1 mol octano x 16 mol CO
2
x 44 g CO
2
114,2 g oct. 2 mol oct mol CO
2
Massa CO
2
= 2160 g
ou 2,16 kg
FATOR ESTEQUIOMTRICO
38
A emisso de CO
2
e outros gases, produz o efeito estufa, aumento
de temperatura da Terra, o que causa efeitos danosos ao ambiente
e ao homem.
A quantificao do carbono no meio ambiente calculada
atravs da quantidade de CO
2
a ser removida ou quantidade
de gases do efeito estufa que deixar de ser lanada na
atmosfera CRDITOS DE CARBONO
Cada crdito de carbono equivale a 1 tonelada de CO
2
equivalente
http://www.carbonobrasil.com/faq.htm
39
1 Ton de CO
2
emitida quando voce viaja:
3200 km de avio
2090 km em carro mdio
Quando usa o computador 10.600 h
MDIA DE EMISSO DE CO
2
/ANO
4,5 Ton para um carro comum
1,7 Ton para um brasileiro comum
6,2 Ton para utilizao mdia de eletricidade
de uma casa comum
6 bilhes de Ton p/ os EUA
25 bilhes de Ton para o planeta Terra
40
C
2
H
6
O + 3 O
2
-> 2CO
2
+ 3H
2
O
gasolina
etanol
Emisso de CO
2
2C
8
H
18
(l) + 25 O
2
(g) 16 CO
2
(g) + 18 H
2
O(l)
1 L octano 2,16 kg CO
2
1 L etanol 1,51 kg CO
2
Para reciclar o CO
2
que voc gera visite o site:
http://www.reciclecarbono.com.br/
Visto em: 28/02/08
41
A queima da gasolina 11150 calorias/g
A queima do lcool 6650 calorias/g
RENDIMENTO ENERGTICO
O carro a lcool consome cerca de 30 % a mais
do que o carro a gasolina, levando em conta a
melhor regulagem do motor.
42
REAGENTES LIMITANTES
- Um qumico misturou 1,00 mol de N
2
com
5,00 mols de H
2
. Qual o maior nmero
possvel de mols do produto que sero
formados pela reao?
O reagente em menor quantidade (nmero de mols) limita a
quantidade do produto formado, ou seja, o reagente limitante.
Ento devemos usar o N
2
para iniciar os clculos
N
2
+ 3 H
2
2 NH
3
Portanto: 1,00 mol de N
2
2 mols de NH
3
Sobram 2 mols de H
2
43
EXEMPLO: Carbeto de clcio reage com gua para formar hidrxido
de clcio e acetileno. Qual o reagente limitante quando 100 g de
gua reage com 100 g de carbeto de clcio?
CaC
2
(s) + 2 H
2
O (l) Ca(OH)
2
(aq) + C
2
H
2
(g)
Massa molar do CaC
2
- 64,10 g/mol
Massa molar da H
2
O - 18,0 g/mol
n. Mol CaC
2
= 100 g CaC
2
x 1 mol CaC
2
= 1,56 mol CaC
2
(limitante)
64,10
n. Mol H
2
O = 100 g H
2
O x 1 mol H
2
O = 5,55 mol H
2
O
18,0 g H
2
O
n. Mol CaC
2
= 100 g CaC
2
x 1 mol CaC
2
= 1,56 mol CaC
2
(limitante)
64,10
n. Mol H
2
O = 100 g H
2
O x 1 mol H
2
O = 5,55 mol H
2
O
18,0 g H
2
O
1,56 mol CaC
2
x 2 mol H
2
O = 3,12 mol H
2
O
1 mol CaC
2
1 mol CaC
2
: 2 mol de H
2
O
Excesso de gua: 5,55 3,1 2=
2,43 mol H
2
O
44
RENDIMENTO DAS REAES
REAGENTES
REAGENTES
PRODUTO
PRODUTO
45
RENDIMENTO TERICO E RENDIMENTO PERCENTUAL
RENDIMENTO REAL DE UM PRODUTO - quantidade obtida no final
da reao, medida em gramas ou mols ( quantidade medida)
RENDIMENTO TERICO a massa que deveramos obter se no
houvessem perdas ou produtos secundrios (quantidade calculada
COM BASE NUMA EQUAO QUMICA)
RENDIMENTO PERCENTUAL = RENDIMENTO REAL x 100 %
RENDIMENTO TERICO
46
CALCULANDO O RENDIMENTO PERCENTUAL DE UM
PRODUTO
Um qumico efetua a sntese do tricloreto de fsforo misturando 12,0 g
de P com 35,0 g de Cl
2
e obtem 42,4 g de PCl
3
. Calcule o rendimento
percentual para este composto.
2P(s) + 3 Cl
2
(g) 2 PCl
3
(l)
Uma vez que foram fornecidas as massas, deve-se saber qual o
reagente limitante.
Vamos escolher o fsforo e determinar se ele est presente em
quantidade suficiente para reagir com 35 g de cloro.
12,0 g P x 1 mol P x 3 mol Cl
2
x 70,90 g Cl
2
= 41,2 g Cl
2
30,97 g P 2 mol P 1 mol Cl
2
Vemos que no h Cl
2
suficiente para reagir com 12,0 g de P.
O Cl
2
ser totalmente consumido, ele o reagente limitante.
47
Para obter o rendimento terico de PCl
3
, vamos calcular quantos
gramas deste poderiam ser obtidos a partir de 35 g de Cl
2
.
35,0 g Cl
2
x 1 mol Cl
2
x 2 mol PCl
3
x 137,32 g PCl
3
= 45,2 g PCl
3
70,90 g Cl
2
3 mol Cl
2
1 mol PCl
3
Como o rendimento real foi de 42,4 g de PCl
3
e no 45,2 g,
obteremos:
RENDIMENTO REAL
RENDIMENTO PERCENTUAL = x 100 %
RENDIMENTO TERICO
% = 42,4 g PCl
3
x 100% = 93,8%
45,2 g PCl
3
Você também pode gostar
- Treinamento Tecnico ElginDocumento37 páginasTreinamento Tecnico ElginJunior Verdi80% (5)
- Manual em Construcao MLR 516Documento69 páginasManual em Construcao MLR 516tiagoeber100% (2)
- Apostila de PA (5 Páginas e 44 Questões, Com Gabarito)Documento5 páginasApostila de PA (5 Páginas e 44 Questões, Com Gabarito)Leonardo Costa100% (3)
- Ar Condicionado 1450 1550Documento35 páginasAr Condicionado 1450 1550Júlio César Haas75% (4)
- Prancha Pavimento Mosaico Grau Apr Jun2011Documento3 páginasPrancha Pavimento Mosaico Grau Apr Jun2011Leonardo SeveroAinda não há avaliações
- Trabalho Sobre CalDocumento9 páginasTrabalho Sobre CalLuanna MedeirosAinda não há avaliações
- Caderno de Sintese TecnologicaDocumento68 páginasCaderno de Sintese TecnologicaAlbertoAinda não há avaliações
- Tabela Das Horas PlanetáriasDocumento16 páginasTabela Das Horas Planetáriasnb_mvAinda não há avaliações
- Cepra-Alimentação DieselDocumento124 páginasCepra-Alimentação DieselJoby Lj100% (2)
- Desenho Técnico CivilDocumento24 páginasDesenho Técnico CivilFábio LeiteAinda não há avaliações
- Masterfrio Manual TecnicoDocumento91 páginasMasterfrio Manual Tecnicolucascsb_1100% (2)
- Service Catalogue 2015 PT BRDocumento156 páginasService Catalogue 2015 PT BRAndréAinda não há avaliações
- Jose Laercio Do Egito - Artigo FRC - Aspectos Da Doutrina PitagóricaDocumento5 páginasJose Laercio Do Egito - Artigo FRC - Aspectos Da Doutrina PitagóricaSamir Bandeira100% (1)
- Redes de Distribuicao - Capitulo 9Documento74 páginasRedes de Distribuicao - Capitulo 9Riaj Li0% (1)
- Perguntas - Boliche - 6º AnoDocumento6 páginasPerguntas - Boliche - 6º AnoRODRIGO FELIPE ALESSIAinda não há avaliações
- Relatório-Caixa MultiplicadoraDocumento42 páginasRelatório-Caixa Multiplicadoramikael bezerra cotias dos santosAinda não há avaliações
- Grand Siena BR 2015Documento195 páginasGrand Siena BR 2015Romulo100% (1)
- RT 05-17 - Estiagem - BH PDFDocumento214 páginasRT 05-17 - Estiagem - BH PDFMauroTrindadeAinda não há avaliações
- Tue Caf 8000 CPTMDocumento3 páginasTue Caf 8000 CPTMRodrigo SampaioAinda não há avaliações
- Codigo EcuDocumento2 páginasCodigo EcuRicardo CabralAinda não há avaliações
- Segurança Com Pontes Rolantes Certo X ErradoDocumento11 páginasSegurança Com Pontes Rolantes Certo X ErradoMarco Antonio VianaAinda não há avaliações
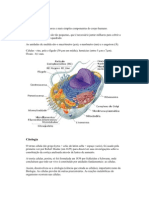
- Célula AnimalDocumento6 páginasCélula AnimalFelipe MeloAinda não há avaliações
- Modelagem Numérica Contínua eDocumento12 páginasModelagem Numérica Contínua eBrian DangeloAinda não há avaliações
- PNEUM HIDRA AprendizDocumento75 páginasPNEUM HIDRA AprendizIVO LEONARDO BURGHARDTAinda não há avaliações
- Avaliação de Química - 1º Ano - 1º Período PDFDocumento1 páginaAvaliação de Química - 1º Ano - 1º Período PDFcesaraugustvmAinda não há avaliações
- Reacções Ácido BaseDocumento26 páginasReacções Ácido BaseVânia FigueiredoAinda não há avaliações
- Propagação em Espaço LivreDocumento10 páginasPropagação em Espaço LivreAllan BragaAinda não há avaliações
- DISSERTAÇÃO - Características Físico-Químicas e Avaliação Do Perfil de Ácidos Graxos de Azeites Obtidos de Diferentes Variedades de Oliveiras Introduzidas em Minas Gerais - BrasilDocumento79 páginasDISSERTAÇÃO - Características Físico-Químicas e Avaliação Do Perfil de Ácidos Graxos de Azeites Obtidos de Diferentes Variedades de Oliveiras Introduzidas em Minas Gerais - BrasilatanamatiAinda não há avaliações
- Catalogo lcs2 v4 7 PDFDocumento92 páginasCatalogo lcs2 v4 7 PDFEliane SouzaAinda não há avaliações