Escolar Documentos
Profissional Documentos
Cultura Documentos
Relatorio 1
Enviado por
Lorrany KerllyonaiTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Relatorio 1
Enviado por
Lorrany KerllyonaiDireitos autorais:
Formatos disponíveis
1
I - INTRODUO
O cido clordrico foi descoberto em torno do ano 800 pelo alquimista Persa Jabir
Ibn Hayyan (Geber), misturando sal comum com cido sulfrico (vitrolo):
2NaCl + H2SO4 Na2SO4 + 2HCl
Jabir, descobriu ou inventou um grande nmero de produtos qumicos e relatou
suas descobertas em mais de vinte obras, que permitiram a propagao de seus
conhecimentos sobre o cido clordrico e de outros produtos qumicos atravs dos
sculos. A gua rgia, sua inveno, uma mistura do cido clordrico com o cido
ntrico, permite dissolver o ouro e foi uma participao sua na famosa busca dos
alquimistas pela pedra filosofal.
O cido clordrico produzido em solues com at 38% HC (cido clordrico
concentrado). O cido clordrico tcnico gira em torno de 30-34% HC, de acordo com
o meio de transporte e a minimizao de perdas por evaporao. As solues de cido
muritico para uso domstico tm no mximo 10-12% HC e recomenda-se dilu-las
antes do uso.
Os maiores produtores mundiais incluem a Dow Chemical, FMC, Georgia Gulf
Corporation, Tosoh Corporation, AresClean, Akzo Nobel e Tessenderlo. A produo
mundial total estimada em 20 milhes de toneladas por ano, com 3 milhes mediante a
sntese direta e o restante como subproduto de sntese orgnica.
O cido clordrico encontrado em vrios produtos de limpeza de pisos.
muito usado tambm em solues acidificantes para aqurios com peixes
ornamentais.
O cido clordrico a soluo de cloreto de hidrognio, um composto qumico de
frmula HCl, em gua. Concentrado, ele tem um odor acre e picante, higroscpico e
libera vapores visveis em contato com o ar mido.
A soluo um cido mineral definido como forte, pois possui alta dissociao
inica, independentemente de ser uma substncia altamente reativa, como j o o gs
cloreto de hidrognio.
O cloreto de hidrognio, a temperatura ambiente, um gs incolor que forma
fumos de cido clordrico em contato com a umidade atmosfrica.
Embora seja o cloreto de hidrognio que tenha a frmula qumica HCl, esta
frmula usada normalmente para referir-se, embora erroneamente, ao cido clordrico.
2
II - OBJETIVOS
Preparar e padronizar uma soluo de 250 mL de cido clordrico a 0,1 N;
Padronizar uma soluo de carbonato de sdio.
III MATERIAL E MTODOS
Balo Volumtrico;
Bureta;
Suporte Universal;
Bquer;
Erlenmeyer;
Pipeta volumtrica
Balana Analtica;
Funil de vidro;
Basto de vidro;
Carbonato de Sdio (Na
2
CO
3)
;
Indicador alaranjado de metila;
cido Clordrico;
Pisseta;
Prova em branco.
Metodologia:
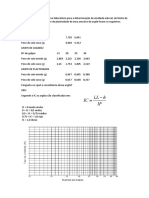
Para a preparao da soluo padro 0,1 M de cido Clordrico (titulante), calculou-se a
normalidade deste, concentrado, utilizando os valores de T e d, encontrados no
rtulo da embalagem, a serem substitudos na seguinte frmula:
Onde,
e so, respectivamente, ttulo e densidade;
o equivalente.
Atravs da expresso matemtica da equivalncia do princpio da equivalncia abaixo
se calculou o volume necessrio do cido para preparar a referida soluo.
3
Colocou-se em um bquer, com volume de 50 mL, 30 mL de gua destilada ao qual
foram inseridos 2,3 mL do cido concentrado. Com o auxlio do funil e basto de vidro
a soluo foi transferida para um balo volumtrico de 250 mL, completando o volume
da soluo com gua destilada at a marca de aferio do balo, tampou-se e agitou-se
para a completa homogeneizao.
Em seguida, utilizando a pipeta volumtrica foram transferidos 25 mL para o
erlenmeyer. Adicionando-se 3 gotas do indicador indicador alaranjado de metila.
Duplicou-se o procedimento.
Foi feita uma preparao direta da soluo de carbonato de sdio (titulado). Pesando-se
a massa do mesmo com exatido de quatro casas decimais (5,3000 g),valor obtido da
frmula abaixo:
Onde o Eq, :
Substituindo os valores, temos:
Ento, foi dissolvido em um bquer com certo volume de gua destilada. Transferiu-se
essa soluo para um balo volumtrico completando o seu volume de 1L. Deslocou-se
50 mL da soluo de Na
2
CO
3
para a bureta.
Finalmente, iniciou-se a padronizao titulando a soluo de Na
2
CO
3
com a soluo de
HCl at a mudana de colorao semelhante a prova em branco.
4
IV RESULTADOS OBTIDOS
Para a titulao da soluo preparada de cido clordrico (HCl) com a soluo de
carbonato de sdio (Na
2
CO
3
) 0,1 N, foram necessrios os seguintes volumes (Tabela
1):
Tabela 1. Dados obtidos da titulao da soluo de HCl com a soluo padro primrio de
Na
2
CO
3.
Titulao Volume de HCl Volume de Na
2
CO
3
0,1 N
1 25 mL 25 mL
2 25 mL 24,8 mL
O volume necessrio da soluo padro para atingir o ponto de equivalncia foi
aproximado do volume do titulado HCl, o que era esperado pois as solues deveriam
ter o mesmo valor de normalidade.
A concentrao da soluo de cido clordrico pode ser determinada pela
seguinte equao:
5
V- CONCLUSO
REFERNCIAS BIBLIOGRFICAS
Disponvel em: https://sites.google.com/site/scientiaestpotentiaplus/acido-cloridrico Acessado
em 09 de Julho de 2014.
BRASILEIRO, I. M. do N. Apostila de Qumica Analtica Aplicada. UFCG. Sum,2012.
Você também pode gostar
- Os Dados Obtidos No Laboratório para A Determinação de Umidade NaturalDocumento4 páginasOs Dados Obtidos No Laboratório para A Determinação de Umidade NaturalWendel MeloAinda não há avaliações
- VW Constellation FALHASDocumento734 páginasVW Constellation FALHASBarra Nova Ferreira100% (2)
- Formulario OP2 1a ProvaDocumento3 páginasFormulario OP2 1a ProvaGabriel MirandaAinda não há avaliações
- Trocadores de Calor Nas Usinas de Açúcar, Etanol e Energia (Amostra)Documento22 páginasTrocadores de Calor Nas Usinas de Açúcar, Etanol e Energia (Amostra)Thiago LinsAinda não há avaliações
- CoulometriaDocumento8 páginasCoulometriaGrace FernandesAinda não há avaliações
- CQFQ 0xx - Não Conformidades - Rev.01Documento3 páginasCQFQ 0xx - Não Conformidades - Rev.01Lyca Ribeiro da FonsecaAinda não há avaliações
- FMEA SistemaDocumento6 páginasFMEA Sistemamarcelokyamamoto100% (1)
- Lista de Exercícios 1Documento2 páginasLista de Exercícios 1Olympio NetoAinda não há avaliações
- Apostila 02-Físico-Química Cursos Militares-Episteme Cursos Online Professor AlexandreDocumento169 páginasApostila 02-Físico-Química Cursos Militares-Episteme Cursos Online Professor AlexandreIssei HyoudouAinda não há avaliações
- Exercicios Modulo 24 Aula 1Documento3 páginasExercicios Modulo 24 Aula 1Thales MogariAinda não há avaliações
- Exp. 4Documento6 páginasExp. 4Gus LAinda não há avaliações
- Mse 24 CRDocumento12 páginasMse 24 CRRodrigo SousaAinda não há avaliações
- Ficha Formativa 4 - 9ano (Classificação Materiais)Documento4 páginasFicha Formativa 4 - 9ano (Classificação Materiais)Adelaide SantosAinda não há avaliações
- f1 SM 10w40 - Fispq IpirangaDocumento9 páginasf1 SM 10w40 - Fispq IpirangaDeryck Queiroz100% (1)
- M Aquinas VaporDocumento3 páginasM Aquinas VaporIsac Manuel100% (1)
- O Funcionamento Do Sistema GNV TradicionalDocumento6 páginasO Funcionamento Do Sistema GNV TradicionalFernando AndradeAinda não há avaliações
- Dnit081 2006 Es-Remocoes ConcretoDocumento6 páginasDnit081 2006 Es-Remocoes ConcretoMarcelo CostaAinda não há avaliações
- Apostila Bota Nica Criptoga Mica Atual PDFDocumento63 páginasApostila Bota Nica Criptoga Mica Atual PDFMartival SantosAinda não há avaliações
- Mobil DTE Série 20Documento2 páginasMobil DTE Série 20Ronaldo RossiAinda não há avaliações
- Behaviorismo Radical - A Filosofia e A CiênciaDocumento203 páginasBehaviorismo Radical - A Filosofia e A CiênciaEryck Azevedo100% (2)
- Sw01 Dlrilt Cspgcc028bp 4630 OpDocumento67 páginasSw01 Dlrilt Cspgcc028bp 4630 OpLuís Fernando OliveiraAinda não há avaliações
- Química V2 PDFDocumento326 páginasQuímica V2 PDFrodrigo100% (1)
- Klüberplex BE - 91-222 SAMDocumento2 páginasKlüberplex BE - 91-222 SAMKleber PereiraAinda não há avaliações
- Aula Hormonios PDFDocumento19 páginasAula Hormonios PDFSandra SilvaAinda não há avaliações
- Aplicação Da Ressonância Magnética Nuclear 1H Na Identificação de Produtos NaturaisDocumento47 páginasAplicação Da Ressonância Magnética Nuclear 1H Na Identificação de Produtos NaturaisNelson Filho100% (1)
- Lista de Exercício 1 PDFDocumento2 páginasLista de Exercício 1 PDFArtur CasteloAinda não há avaliações
- Resumo Das Fórmulas de Rendimentos e Eficiência Utilizadas Na Indústria Açucareira Do BrasilDocumento16 páginasResumo Das Fórmulas de Rendimentos e Eficiência Utilizadas Na Indústria Açucareira Do BrasilFernanda Lima Silva100% (1)
- Exercícios RESOLVIDOS Nomenclatura Orgânica 3Documento3 páginasExercícios RESOLVIDOS Nomenclatura Orgânica 3Suzani Menegon0% (1)
- Quais São Os Métodos de Esterilização Mais UtilizadosDocumento14 páginasQuais São Os Métodos de Esterilização Mais UtilizadosFabíola Araújo Barboza CoimbraAinda não há avaliações
- FISPQ BRASNOX DM50 # DR REV01 - Peróxido IncolorDocumento9 páginasFISPQ BRASNOX DM50 # DR REV01 - Peróxido Incoloredson.proaltitude100% (1)