Escolar Documentos
Profissional Documentos
Cultura Documentos
Revisão Quimica 2
Enviado por
rubens.costa0 notas0% acharam este documento útil (0 voto)
1 visualizações2 páginasLista Revisão química
Título original
revisão quimica 2
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOC, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoLista Revisão química
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOC, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
1 visualizações2 páginasRevisão Quimica 2
Enviado por
rubens.costaLista Revisão química
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOC, PDF, TXT ou leia online no Scribd
Você está na página 1de 2
Físico-química – Revisão
1 – leia as sentenças abaixo e responda: d) 86,76 % e) 94,17 %
13 – Puccamp No preparo de solução alvejante de
I – Uma mistura de água, óleo e areia é uma mistura de
tinturaria, 521,5g de hipoclorito de sódio são
três fases e pode ser classificada como uma solução;
dissolvidos em água suficiente para 10,0 litros de
II – No sistema formado por açúcar ( C12H22O11) e água
solução. A concentração, em mol/L, da solução obtida
(H2O), a água é o dispersante;
é: (Dado: Massa molar do NaCℓO = 74,5g/mol)
III – Numa suspensão as partículas dispersas tem
a) 7,0 b) 3,5 c) 0,70 d) 0,35 e) 0,22
tamanho maior que 100 nm (nanômetros);
IV – As soluções não saturadas tem mais soluto
14 – FUVEST A dosagem de álcool etílico no sangue
dissolvido que o especificado pelo Coeficiente de
de um indivíduo mostrou um valor de 0,08 g/100 mL.
solubilidade (CS);
Supondo que o volume total de sangue deste indivíduo
V – A gelatina pode ser classificada como solução
seja de 6,0 litros e admitindo que 12 % do álcool
coloidal.
ingerido se encontra no seu sangue, quantas doses de
Marque a alternativa que aponta quais das sentenças
bebida alcoólica ele deve ter tomado ?
acima são verdadeiras:
1 dose de bebida alcoólica = 20 mL
A) ( ) apenas I e V estão corretas.
porcentagem aproximada em volume de
B) ( ) apenas II, III e IV estão corretas.
C) ( ) apenas II, III e V estão corretas. etanol na bebida = 50 %
D) ( ) apenas V esta correta. densidade do etanol = 0,80 g/mL.
E) ( ) todas estão corretas. a) 2 b) 4 c) 5 d) 6 e) 7
2– Qual o título em massa de uma solução 2 molal de 15 - Cesgranrio – RJ O mercúrio é um metal tóxico
sulfato de magnésio em água ? que pode ser absorvido pelos animais por via
3 – UFRN O agrônomo de uma usina de açúcar solicitou gastrintestinal e cuja excreção é lenta. A análise da
uma avaliação do teor de sacarose contida em um água de um rio contaminado revelou uma
determinado lote de cana-de-açúcar. Para isso, foi concentração de 5 . 10-5 mol/L de mercúrio. Qual a
entregue ao químico uma amostra de 2,0 litros de caldo massa, aproximada, de mercúrio ingerida por um
de cana para determinar a concentração de sacarose garimpeiro ao beber um copo contendo 250 mL dessa
(C12H22O11). (MMSACAROSE = 342 g/mol). água? ( Dado a massa atômica: Hg = 200)
Ao receber o resultado da análise, expresso em
molaridade(0,25M), o auxiliar de escritório, não a) ( ) 0,25 mg b)( )2,5 mg c) ( ) 25 mg
conseguindo decifra-lo, recorreu ao gerente. Este d) ( ) 0,025 mg e) ( ) 0,50 g
calculou que a massa de sacarose contida nos 2,0 litros
de caldo de cana, de concentração 0,25 mol/L, era: 16 – UFBA A tabela a seguir fornece os valores de
a) 42,7 g b) 85,5 g c) 2370 g d) 171 g solubilidade do cloreto de sódio e do hidróxido de
sódio, em água, a diferentes temperaturas.
4 – Evapora-se completamente a água de 60 g de uma
solução de KNO3 saturada e sem corpo de fundo,
obtém-se 20 g de resíduo sólido. O coeficiente de
solubilidade (CS) para o sal em questão para 100 g de
água na temperatura inicial da solução é:
5 – Calcule a massa de ácido nítrico necessária para
preparar 0,15 L (litros) de uma solução de concentração
50g/L.
6 – A concentração comum de uma solução de NaCl em
que foram dissolvidos 20 g desse sal em 180 g de H 2O As informações anteriores e os conhecimentos sobre
é: Dados: densidade da solução: 0,8 g/mL; soluções permitem concluir:
1L = 1000 mL.
(01) Soluções são misturas homogêneas.
A) ( ) 160 g/L B) ( ) 250 g/L C) ( ) 200 g/L
(02) Solução saturada é um mistura heterogênea.
D) ( ) 0,8 g/L E) ( ) 80 g/L
(04) O hidróxido de sódio é mais solúvel em água que
o cloreto de sódio.
7 – Calcule a concentração comum de 2 L (litros) de
(08) Soluções concentradas são soluções saturadas.
uma solução de NaOH, sabendo que há 80 g desse sal
(16) Quando se separa o soluto do solvente, obtêm-se
dissolvidos na solução.
substâncias diferentes daquelas que foram
8 – Explique com suas palavras porque ao fazermos
inicialmente misturadas.
uma limonada, as sementes do limão ficam no fundo do
(32) Adicionando-se 145g de hidróxido de sódio a 100g
copo antes de colocarmos o açúcar, e depois que
de água, a 20°C, obtém-se um sistema bifásico, que,
adicionamos o açúcar a semente “sobe” ficando na parte
após aquecido a temperaturas acima de 50°C,
de cima do suco.
apresenta-se monofásico.
9 - A fração molar de glicose ( C 6H12O6 ) numa solução
aquosa é 0,01. podemos então concluir que o título em
A soma das alternativas corretas é:________
massa da solução vale aproximadamente:
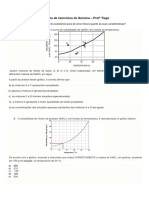
17 – FUVEST A curva de solubilidade do KNOƒ em
(Massas atômicas: H = 1; C = 12; O = 16 )
função da temperatura é dada a seguir. Se a 20°C
a) 0,01 % b) 0,83 % c) 1,00 %
misturarmos 50g de KNOƒ com 100g de água, quando
d) 9,17 % e) 90,9 %
for atingido o equilíbrio teremos:
10 – Uma solução de H2SO4 de concentração igual a
735 g/L tem densidade igual a 1,5 g/mL. Calcule:
a) um sistema homogêneo.
a) O titulo em massa de H2SO4 ;
b) um sistema heterogêneo.
b) A percentagem em massa de H2SO4
c) apenas uma solução insaturada.
11 – FUVEST Uma dada solução aquosa de hidróxido
d) apenas uma solução saturada.
de sódio contem 24 % em massa de NaOH. Sendo a
e) uma solução supersaturada.
densidade da solução 1,25 g/mL, a concentração em
g/L será aproximadamente igual a :
a) 300 b) 240 c) 125 d) 80 e) 19
18 – UFPI Que concentração, em mol/L, tem que ter
12 - UESPI Uma solução aquosa de ácido crômico,
H2Físico-química – Soluções e Propriedades coligativas – uma
2° ano Prof:Ba(OH)
Rubens Costa
100 mL de solução de água de barita, 2,
CrO4, apresenta fração molar de soluto igual a 0,5. A
para reter totalmente 0,20 mol de dióxido de carbono,
porcentagem em massa deste ácido nessa solução é
CO2?
aproximadamente:
a) 1 b) 2 c) 3
a) 68,45 % b) 74,32 % c) 38,45 %
d) 4 e) 5
5 – Calcule o valor da constante tonoscópica molal (K t)
19 - Mackenzie A partir do diagrama a seguir, que para os solventes:
relaciona a solubilidade de dois sais A e B com a a) álcool etílico (C2H5OH)
temperatura são feitas as afirmações: b) clorofórmio (CHCl3)
6 – Das afirmações abaixo, estão corretas:
a) ( ) A água do mar congela abaixo de 0°C ao nível
do mar.
b) ( ) A água do mar ferve acima de 100°C ao nível do
mar.
c) ( ) Durante a ebulição de uma solução, a
temperatura eleva-se continuamente.
d) ( ) Durante a solidificação de uma solução, a
temperatura diminui continuamente.
7 – Sabendo que uma solução aquosa A de glicose
tem temperatura de ebulição maior que outra solução
aquosa B de glicose, podemos afirmar que está(ão)
correta(s):
I - existe uma única temperatura na a) A solução A tem temperatura de
qual a solubilidade de A é igual à de B. congelamento maior que a solução B.
II - a 20°C, a solubilidade de A é menor que a de B. b) A solução A tem pressão de vapor maior que
III - a 100°C, a solubilidade de B é maior que a de A. a solução B, à mesma temperatura.
IV - a solubilidade de B mantém-se constante com o c) A solução A tem concentração maior que a
aumento da temperatura. solução B.
V - a quantidade de B que satura a solução à
temperatura de 80°C é igual a 150g. 8 – Analise as situações citadas abaixo e explique
justificando o que deverá acontecer após um certo
Somente são corretas: tempo.
a) I, II e III. b) II, III e V. c) I, III e V. Qual o fenômeno coligativo que ocorre?
d) II, IV e V. e) I, II e IV.
a) Ameixas secas imersas em água.
20 - UESPI Na preparação de 200 mL de uma solução
aquosa 1 M de ácido clorídrico, um estudante dispõe de b) cenoura imersa em salmoura (água +sal de cozinha)
uma solução aquosa 5 M desse ácido. Qual o volume da
solução inicial que será utilizado? 9 – Considere o diagrama de fases de uma substancia
a) 4 mL b) 20 mL c) 40 mL X representado abaixo:
d) 100 mL e) 150 mL
21 – UFPE-COVESTE Que volume, em mililitros, de
água destilada devemos adicionar a um litro de solução
0,105 M, para torna-la exatamente 0,100 M ?
a) 75 mL b) 25 mL c) 50 mL I II
d) 100 mL e) 150 mL
22 – UFPI Pode-se determinar a concentração de uma III
solução aquosa de ácido sulfúrico através de uma
solução aquosa de soda cáustica de concentração
conhecida (titulação). Ao se titular 25 mL de uma IV
solução de ácido sulfúrico 0,10 mol/L, “o ponto de
equivalência” será alcançado quando se adiciona a essa
solução um volume de solução 0,20 mol/L de soda a) Em que est6ado físico se encontra a Substancia X
caustica igual a: nos pontos I, II, III e IV no diagrama acima?
a) 10 mL b) 25 mL c) 15 L
d) 50 mL e) 100 mL b) Quais os estados físicos da substancia X presentes
nas curvas B-A, C-A e D-A do diagrama acima?
Propriedades coligativas
- Sobre as propriedades coligativas, defina e dê
exemplos quando possível:
1 – Pressão máxima de vapor:
“A morte do homem começa no instante
2 - Tonoscopia, ebulioscopia, crioscopia e pressão
osmótica. Explique sucintamente cada efeito: em que ele desiste de aprender”.
3 – A lei de Rauolt para cada efeito e as leis de Van’t Albino Teixeira
Hoff para a osmometria (pressão osmótica):
As expressões matemáticas devem ter suas
variáveis definidas com as respectivas unidades,
se houver.
4 – Quais os fatores que influem na pressão máxima de
vapor? Exemplifique.
Você também pode gostar
- Projetos Com Esp8266 Programado Em Lua - Parte XxiNo EverandProjetos Com Esp8266 Programado Em Lua - Parte XxiAinda não há avaliações
- 46-Unidades de ConcentraçãoDocumento3 páginas46-Unidades de Concentraçãonv77vnm100% (1)
- Lista de Exercícios 2 Ano Concentração de SoluçoesDocumento1 páginaLista de Exercícios 2 Ano Concentração de Soluçoeslopesqui1766Ainda não há avaliações
- Arquivo de Soluções Do Prof° VieiraDocumento9 páginasArquivo de Soluções Do Prof° VieiravieirasalesAinda não há avaliações
- Exercícios de Soluções - p casaDocumento2 páginasExercícios de Soluções - p casaMatheus HenriqueAinda não há avaliações
- Concentração de soluções químicasDocumento3 páginasConcentração de soluções químicasEduarda CoelhoAinda não há avaliações
- Lista de Exercícios - SoluçõesDocumento4 páginasLista de Exercícios - SoluçõesWellington SantosAinda não há avaliações
- Concentração de Solução ExerciciosDocumento5 páginasConcentração de Solução ExerciciosWesley HenriqueAinda não há avaliações
- Soluções e concentraçõesDocumento4 páginasSoluções e concentraçõesjparatyAinda não há avaliações
- Soluções QuímicasDocumento37 páginasSoluções QuímicasVictória Dutra100% (3)
- Lista de Exerccios 3respostas - Misturas e SoluesDocumento1 páginaLista de Exerccios 3respostas - Misturas e SoluesGabriel Brito PamplonaAinda não há avaliações
- Concentração de SoluçõesDocumento2 páginasConcentração de SoluçõesDavid LunaAinda não há avaliações
- Relações concentrações SoluçõesDocumento15 páginasRelações concentrações SoluçõesProfe KeideeAinda não há avaliações
- Quimi Foco 0103Documento2 páginasQuimi Foco 0103Daniel VictorAinda não há avaliações
- Estudo Das Soluções PDFDocumento47 páginasEstudo Das Soluções PDFRenanEQAinda não há avaliações
- Lista de Exercícios de SoluçõesDocumento2 páginasLista de Exercícios de SoluçõesBiancaAinda não há avaliações
- Apostila de Exercícios Com Gabarito de Soluções - Concentração Comum A Mistura de Soluções de Solutos DiferentesDocumento16 páginasApostila de Exercícios Com Gabarito de Soluções - Concentração Comum A Mistura de Soluções de Solutos DiferentesProf. Maych Melo QuímicaAinda não há avaliações
- Questões de Química sobre SoluçõesDocumento3 páginasQuestões de Química sobre SoluçõesPatrícia TeixeiraAinda não há avaliações
- Trabalho Progressao Parcila CocDocumento2 páginasTrabalho Progressao Parcila CocProf: Fabiano Mendonça100% (1)
- ExercíciosDocumento9 páginasExercíciosBruna SouzaAinda não há avaliações
- Solues 120808142105 Phpapp01Documento9 páginasSolues 120808142105 Phpapp01tissiaraujoAinda não há avaliações
- Lista de Exercicio Atualizada SolucoesDocumento5 páginasLista de Exercicio Atualizada SolucoesmariomarthinsAinda não há avaliações
- Lista de Exercícios sobre Soluções e Concentração (menos deDocumento6 páginasLista de Exercícios sobre Soluções e Concentração (menos deMirela MottaAinda não há avaliações
- Química - Testes e ContaminantesDocumento21 páginasQuímica - Testes e ContaminantesJulianaAinda não há avaliações
- Concentração de soluçõesDocumento1 páginaConcentração de soluçõeskelvin mateus assuncaoAinda não há avaliações
- Ficha de Fixação para 5 Periodo FarmaDocumento4 páginasFicha de Fixação para 5 Periodo FarmaEmídio Junior DuoAinda não há avaliações
- Cópia de Aula03 - Quimica2 - ExercíciosDocumento6 páginasCópia de Aula03 - Quimica2 - Exercíciospedro vitoAinda não há avaliações
- Lista de Exercícios - Concentração de Soluções.Documento3 páginasLista de Exercícios - Concentração de Soluções.Marcelo ChrystoferAinda não há avaliações
- LE - Dispersão e SolubilidadeDocumento3 páginasLE - Dispersão e SolubilidadeMatheus PetryAinda não há avaliações
- Aula #01 - SoluçõesDocumento14 páginasAula #01 - SoluçõesAnna Luiza LopesAinda não há avaliações
- Lista - SoluçõesDocumento8 páginasLista - SoluçõesPatricia BarraAinda não há avaliações
- ListaExercíciosQuímicaSoluçõesDocumento5 páginasListaExercíciosQuímicaSoluçõesAna Ester CavalcanteAinda não há avaliações
- Soluções químicas e cálculos de concentraçãoDocumento1 páginaSoluções químicas e cálculos de concentraçãopedro NetoAinda não há avaliações
- Soluções São Misturas HomogêneasDocumento6 páginasSoluções São Misturas HomogêneasMabelle Pereira Costa PaivaAinda não há avaliações
- Química - Concentração de SoluçõesDocumento6 páginasQuímica - Concentração de SoluçõesMaíssa FreitasAinda não há avaliações
- Lista de exercícios de Química sobre solubilidade e concentraçãoDocumento4 páginasLista de exercícios de Química sobre solubilidade e concentraçãoMichel KaipperAinda não há avaliações
- Lista de Exercicios de SolucoesDocumento2 páginasLista de Exercicios de SolucoesGraciano ComboioAinda não há avaliações
- Apostila de Exercícios 2Documento16 páginasApostila de Exercícios 2abatubaiAinda não há avaliações
- Soluções Química B UNIDADE 1Documento19 páginasSoluções Química B UNIDADE 1Renata Todeschinni TexeiraAinda não há avaliações
- Soluções químicasDocumento4 páginasSoluções químicasAntonio EduardoAinda não há avaliações
- 01Documento7 páginas01Natany AssaiAinda não há avaliações
- Lista de Exercícios - SOLUÇÕES de ConcentraçãoDocumento4 páginasLista de Exercícios - SOLUÇÕES de ConcentraçãoWesley MartinsAinda não há avaliações
- Exercicios de SolubilidadeDocumento6 páginasExercicios de Solubilidadesua mae de 4Ainda não há avaliações
- Solução aquosa saturada de saisDocumento4 páginasSolução aquosa saturada de saisMarko Aurelio Ferreira Da CostaAinda não há avaliações
- Lista Certa Do RobinhoDocumento4 páginasLista Certa Do RobinhogiovanarezendebensiAinda não há avaliações
- 16 SolubilidadeDocumento7 páginas16 SolubilidadeFRANKE MERO TESTEAinda não há avaliações
- Lista 1 de Exercicios - SolucoesDocumento2 páginasLista 1 de Exercicios - SolucoesnalytoncostaAinda não há avaliações
- 1 Lista de Exercícios - SoluçõesDocumento2 páginas1 Lista de Exercícios - SoluçõesAllyf Ferreira100% (1)
- Lista de Exercicios Solucoes 31Documento3 páginasLista de Exercicios Solucoes 31Thaís OliveiraAinda não há avaliações
- Lista de Exercicios Fisico QuimicaDocumento3 páginasLista de Exercicios Fisico QuimicaLorena GuimarãesAinda não há avaliações
- Exercícios - Química - Físico QuímicaDocumento51 páginasExercícios - Química - Físico QuímicamariafbellincantaAinda não há avaliações
- Lista de exercícios de solubilidadeDocumento2 páginasLista de exercícios de solubilidadeJoseAinda não há avaliações
- Coeficientes de solubilidade e concentrações de soluçõesDocumento6 páginasCoeficientes de solubilidade e concentrações de soluçõesÉrica LimaAinda não há avaliações
- Exercicios de ConcentracaoDocumento4 páginasExercicios de Concentracaodkforever0% (1)
- Tratamento de Lodos de Estações de Tratamento de ÁguaNo EverandTratamento de Lodos de Estações de Tratamento de ÁguaAinda não há avaliações
- Enviando A Medição De Ph Para Monitoramento No Vc# Com A Stm8 Programada Em ArduinoNo EverandEnviando A Medição De Ph Para Monitoramento No Vc# Com A Stm8 Programada Em ArduinoAinda não há avaliações
- Enviando A Medição De Ph Para Monitoramento No Vb Com A Stm8 Programada Em ArduinoNo EverandEnviando A Medição De Ph Para Monitoramento No Vb Com A Stm8 Programada Em ArduinoAinda não há avaliações