Escolar Documentos
Profissional Documentos
Cultura Documentos
Quimi Foco 0103
Enviado por
Daniel Victor0 notas0% acharam este documento útil (0 voto)
14 visualizações2 páginasquestoes
Título original
quimi foco 0103
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoquestoes
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
14 visualizações2 páginasQuimi Foco 0103
Enviado por
Daniel Victorquestoes
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 2
B) O valor da concentração da solução do ácido,
preparada a partir de 25,0mL da solução estoque, é de
0,6molL–1 .
01 C) A diluição da solução preparada com 150,0mL de
Unit 2023.2 água destilada interfere na quantidade do soluto
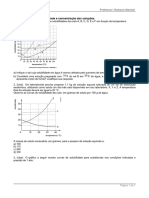
O ácido bórico, H3BO3(s), é um composto solúvel em água presente no sistema.
utilizado como inseticida e na indústria de fertilizantes, que D) O pH da solução estoque de ácido nítrico é maior
se apresenta como um pó branco ou como cristais incolores. do que o pH da solução preparada a partir de 25,0mL
Apesar de ser relativamente atóxico, a inalação ou o contato dessa solução.
com este ácido pode causar irritação nas vias respiratórias e E) A quantidade de moléculas de ácido nítrico
oculares. A solubilidade deste composto químico em água presente no volume de 25,0mL da solução estoque é
aumenta com o aquecimento, conforme se observa na curva de 3,6. moléculas.
representada no gráfico
03
Admitindo-se que os valores das concentrações dos
sais dissolvidos nos oceanos são de,
aproximadamente, 5,0.1 mol/L para o NaCl(aq),
MM=59g/mol , e 5,0.1 mol/L do MgSO4(aq),
MM=120g/mol , é correto concluir que
A) a relação entre a massa do sulfato de magnésio e o
volume de água nos oceanos é igual à de uma
solução aquosa 60g/L desse sal.
B) o valor da massa de cloreto de sódio encontrada
em uma amostra de 30L da água retirada de um
Com base nessas informações e na análise do gráfico, oceano é de, aproximadamente, 885g.
associadas aos conhecimentos sobre soluções aquosas, é C) a massa de sulfato de magnésio dissolvida na água
correto afirmar: dos oceanos é maior do que a massa de cloreto de
A) A mistura de 55g do B (s) com 400g de água, a sódio presente nesse sistema aquático.
50°C, forma um sistema químico homogêneo. D) o número de íons Na+(aq) originários de cloreto de
B) A curva de solubilidade do ácido bórico em água indica sódio é menor do que a soma do número de cátions
que o processo de dissolução desta substância é exotérmico. com o número de ânions do sulfato de magnésio.
C) A massa de ácido bórico que se dissolve, completamente, E) a quantidade de matéria de sulfato de magnésio em
em 250g de água destilada, a 20°C, é de, no máximo, 12,5g. 500mL de uma solução aquosa de concentração igual
D) O aquecimento de uma solução saturada de ácido bórico à da água dos oceanos é igual a 0,25mol.
de 50°C para 70°C reduz a massa do soluto que causa
irritações nos olhos. 04
E) O sistema químico com 15g de B (s) e 300g de água,
a 30°C, se apresenta como uma solução saturada com um Considere duas latas do mesmo refrigerante, uma na
corpo de fundo. versão diet e outra na versão comum. Ambas contêm
o mesmo volume de líquido (300 mL) e têm a mesma
massa quando vazias. A composição do refrigerante é
02
a mesma em ambas, exceto por uma diferença: a
Unit 2023.1 versão comum contém certa quantidade de açúcar,
RÓTULO DE UMA SOLUÇÃO ESTOQUE DE ÁCIDO enquanto a versão diet não contém açúcar (apenas
NÍTRICO massa desprezível de um adoçante artificial).
Pesando-se as duas latas fechadas de refrigerante,
foram obtidos os seguintes resultados.
O volume de 25,0mL de uma solução estoque de
ácido nítrico, HNO3(aq), armazenada em um
laboratório e identificada pelo rótulo, foi utilizado na
Por esses dados, pode-se concluir que a
preparação de 500,0mL de uma solução aquosa
concentração, em g/L, de açúcar no refrigerante
desse ácido. Com base nessas informações e nos
comum é de, aproximadamente:
conhecimentos sobre as soluções aquosas, é correto
a) 0,020
afirmar:
d) 20
A) A massa de ácido nítrico, HNO3(aq), presente em
b) 0,050
500,0mL da solução aquosa preparada é de 37,8g.
e) 50
c) 1,1
a) 4,00 d) 0,50
05 b) 2,00 e) 0,25
No rótulo de uma garrafa de “água mineral” lê-se, c) 1,00
entre outras coisas: Conteúdo:
1,5 L Bicarbonato de cálcio:
20 ppm A massa do bicarbonato de cálcio, no 09
conteúdo da garrafa, é: Um estudante de química realizou uma titulação ácido-
base no laboratório de química. Sabendo que para
titular 50 mL de uma solução de ácido clorídrico foram
-1
gastos 40 mL de uma solução de NaOH 0,10 mol L .
a) 0,03 g d) 0,06 g -1
A concentração (mol L ) da solução de ácido clorídrico
b) 0,02 g e) 150 mg determinada pelo químico foi de:
c) 0,01 g
a)0,070
06 b)0,060
c)0,080
Uma solução de hidróxido de alumínio (MM = 78 d)0,090
g.mol–1), utilizada no combate à acidez estomacal,
apresenta uma concentração igual a 3,90 g.L–1. A
concentração, em mol.L–1, dos íons hidroxila (OH–),
presentes nessa solução, é igual a
A) 5,0x .
B) 1,5x .
C) 1,5x .
D) 5,0x .
07
A partir do esquema de diluições representado a
seguir, qual será a concentração no frasco D, após a
execução das operações indicadas na seqüência de 1
a 5?
a) 0,075 mol/L d) 0,10 mol/L
b) 0,75 mol/L e) 7,50 mol/L
c) 1,00 mol/L
08
O hidróxido de sódio, NaOH, neutraliza
completamente o ácido sulfúrico, H2SO4, de acordo
com a equação
O volume, em litros, de uma solução de H2SO4, 1,0
mol/L que reage com 0,5 mol de NaOH é:
Você também pode gostar
- Trabalho Progressao Parcila CocDocumento2 páginasTrabalho Progressao Parcila CocProf: Fabiano Mendonça100% (1)
- Concentração de Solução ExerciciosDocumento5 páginasConcentração de Solução ExerciciosWesley HenriqueAinda não há avaliações
- Exercícios - Química - Físico QuímicaDocumento51 páginasExercícios - Química - Físico QuímicamariafbellincantaAinda não há avaliações
- Revisão Quimica 2Documento2 páginasRevisão Quimica 2rubens.costaAinda não há avaliações
- Atividade 02 - Soluções e Unidades de ConcentraçãoDocumento9 páginasAtividade 02 - Soluções e Unidades de Concentraçãodeniseloura90Ainda não há avaliações
- Atividade 02 - Soluções e Unidades de ConcentraçãoDocumento12 páginasAtividade 02 - Soluções e Unidades de Concentraçãodeniseloura90Ainda não há avaliações
- Lista de Exercícios 2 Ano Concentração de SoluçoesDocumento1 páginaLista de Exercícios 2 Ano Concentração de Soluçoeslopesqui1766Ainda não há avaliações
- Soluções Eng PDFDocumento2 páginasSoluções Eng PDFErick Guedes RibeiroAinda não há avaliações
- Universidade Federal Do Pará Instituto de Ciências Da Saúde Faculdade de FarmáciaDocumento3 páginasUniversidade Federal Do Pará Instituto de Ciências Da Saúde Faculdade de FarmáciaGraziane Portela100% (1)
- Lista de SoluçõesDocumento1 páginaLista de SoluçõesClaraAinda não há avaliações
- Soluções - Diluição Sem e Com ReaçãoDocumento5 páginasSoluções - Diluição Sem e Com ReaçãoProf. Maych Melo QuímicaAinda não há avaliações
- Arquivo de Soluções Do Prof° VieiraDocumento9 páginasArquivo de Soluções Do Prof° VieiravieirasalesAinda não há avaliações
- Lista de Exercícios - Soluções - Documentos GoogleDocumento4 páginasLista de Exercícios - Soluções - Documentos GoogleWesley MartinsAinda não há avaliações
- Lista - SoluçõesDocumento8 páginasLista - SoluçõesPatricia BarraAinda não há avaliações
- Diluição e Mistura de SoluçõesDocumento4 páginasDiluição e Mistura de SoluçõesProf. Maych Melo QuímicaAinda não há avaliações
- Exercicios de Revisao ReavaliaçãoDocumento3 páginasExercicios de Revisao ReavaliaçãoMarcelo NazarioAinda não há avaliações
- Lista de Exerccios 3respostas - Misturas e SoluesDocumento1 páginaLista de Exerccios 3respostas - Misturas e SoluesGabriel Brito PamplonaAinda não há avaliações
- 4879ae3c3f022c31ef2371c718039c86Documento2 páginas4879ae3c3f022c31ef2371c718039c86Jobson Tavares TeixeiraAinda não há avaliações
- Quim DDocumento21 páginasQuim DJulianaAinda não há avaliações
- Lista de Exercício de Soluções QuímicaDocumento3 páginasLista de Exercício de Soluções QuímicaEduarda CoelhoAinda não há avaliações
- 46-Unidades de ConcentraçãoDocumento3 páginas46-Unidades de Concentraçãonv77vnm100% (1)
- Lista de Exercícios Solubilidade, Concentração e Título - 2º Ano EMDocumento1 páginaLista de Exercícios Solubilidade, Concentração e Título - 2º Ano EMluiz felipe pereira mendesAinda não há avaliações
- Concentração de SoluçõesDocumento2 páginasConcentração de SoluçõesDavid LunaAinda não há avaliações
- Lista de Exercícios - Diluição e MisturasDocumento4 páginasLista de Exercícios - Diluição e MisturasGustavoAinda não há avaliações
- Exercícios Concentração Das Soluções 2023Documento2 páginasExercícios Concentração Das Soluções 2023MISLENE VIANA DO NASCIMENTOAinda não há avaliações
- Exercícios + Gabarito - Titulação Ácido-BaseDocumento3 páginasExercícios + Gabarito - Titulação Ácido-Baselcesar2008Ainda não há avaliações
- Ficha de Fixação para 5 Periodo FarmaDocumento4 páginasFicha de Fixação para 5 Periodo FarmaEmídio Junior DuoAinda não há avaliações
- Quest 06 - Soluções - GabaritoDocumento5 páginasQuest 06 - Soluções - GabaritomisaelinacioAinda não há avaliações
- Lista de Exercícios - SoluçõesDocumento4 páginasLista de Exercícios - SoluçõesWellington SantosAinda não há avaliações
- Cópia de Aula03 - Quimica2 - ExercíciosDocumento6 páginasCópia de Aula03 - Quimica2 - Exercíciospedro vitoAinda não há avaliações
- Lista Certa Do RobinhoDocumento4 páginasLista Certa Do RobinhogiovanarezendebensiAinda não há avaliações
- ExercíciosDocumento9 páginasExercíciosBruna SouzaAinda não há avaliações
- Lista de Exercícios - Concentração de Soluções.Documento3 páginasLista de Exercícios - Concentração de Soluções.Marcelo ChrystoferAinda não há avaliações
- Lista de Exercicios Fisico QuimicaDocumento3 páginasLista de Exercicios Fisico QuimicaLorena GuimarãesAinda não há avaliações
- Lista de Exercicios Solucoes 31Documento3 páginasLista de Exercicios Solucoes 31Thaís OliveiraAinda não há avaliações
- Exercicio ConcentraçãoDocumento1 páginaExercicio Concentraçãopedro NetoAinda não há avaliações
- Exercícios Extras de SoluçõesDocumento4 páginasExercícios Extras de SoluçõesDavi VergaraAinda não há avaliações
- SOLUÇOESDocumento37 páginasSOLUÇOESVictória Dutra100% (3)
- Universidade Eduardo Mondlane Faculdade de Ciências Departamento de QuímicaDocumento4 páginasUniversidade Eduardo Mondlane Faculdade de Ciências Departamento de QuímicaGeremias Armindo ArmindoAinda não há avaliações
- Lista de Exercícios - Operações Com SoluçõesDocumento2 páginasLista de Exercícios - Operações Com SoluçõesBiancaAinda não há avaliações
- Lista 1Documento4 páginasLista 1Victor gonçalves de sousaAinda não há avaliações
- Lista de Exercício - SoluçõesDocumento3 páginasLista de Exercício - SoluçõesNathalia Muniz Distik100% (1)
- Exercícios Soluções (Com Gabarito)Documento4 páginasExercícios Soluções (Com Gabarito)Orlando FirmezaAinda não há avaliações
- Lista 11 - Diluição e Misturas .Documento5 páginasLista 11 - Diluição e Misturas .thais cremascoAinda não há avaliações
- Lista de Exercicios Solucoes 31Documento3 páginasLista de Exercicios Solucoes 31Josimar Lima FerreiraAinda não há avaliações
- QGeral - Aula Pratica SolucoesDocumento5 páginasQGeral - Aula Pratica SolucoesMarta VazulaAinda não há avaliações
- Exercício Soluções Após A 1 AvaliaçãoDocumento1 páginaExercício Soluções Após A 1 AvaliaçãoZilene AlvesAinda não há avaliações
- Valor Nota : 1) Uma Solução Pode Ser Definida ComoDocumento4 páginasValor Nota : 1) Uma Solução Pode Ser Definida ComoSuellen CartaxoAinda não há avaliações
- 17 18 Concentracao e DiluicaoDocumento6 páginas17 18 Concentracao e Diluicaolfilippe5823Ainda não há avaliações
- Soluções IDocumento16 páginasSoluções IEduardo AlbinoAinda não há avaliações
- Lista de Química - Mol, Massa Molar e Concentração de Soluções 2º AnoDocumento1 páginaLista de Química - Mol, Massa Molar e Concentração de Soluções 2º AnoKAUA DE ARAUJO TEIXEIRAAinda não há avaliações
- Lista de Exercicio Atualizada SolucoesDocumento5 páginasLista de Exercicio Atualizada SolucoesmariomarthinsAinda não há avaliações
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Documento5 páginasA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10Ainda não há avaliações
- Tratamento de Lodos de Estações de Tratamento de ÁguaNo EverandTratamento de Lodos de Estações de Tratamento de ÁguaAinda não há avaliações
- 15 03Documento5 páginas15 03Daniel VictorAinda não há avaliações
- Notes 240129 092237 240301 095006Documento1 páginaNotes 240129 092237 240301 095006Daniel VictorAinda não há avaliações
- CraseDocumento4 páginasCraseDaniel VictorAinda não há avaliações
- Cinetica QuimicaDocumento4 páginasCinetica QuimicaDaniel VictorAinda não há avaliações
- Unit Unificado Cad 2 2022 FinalDocumento21 páginasUnit Unificado Cad 2 2022 FinalDaniel VictorAinda não há avaliações
- Técnicas de PreparoDocumento20 páginasTécnicas de PreparoLuiz JúniorAinda não há avaliações
- Angiologia AulaDocumento31 páginasAngiologia AulaPedro SilvaAinda não há avaliações
- Check List - COMPACTADOR DE SOLO NOVODocumento1 páginaCheck List - COMPACTADOR DE SOLO NOVOWellington Barbosa Barros100% (1)
- Anti Histaminicos H1 H2Documento38 páginasAnti Histaminicos H1 H2Ranielly LopesAinda não há avaliações
- Prova I 1 Série - ExatasDocumento6 páginasProva I 1 Série - ExatasLilian Meire LiberatoAinda não há avaliações
- Jaqueline Navin - Veneno Da TraiçãoDocumento161 páginasJaqueline Navin - Veneno Da TraiçãoTia DéAinda não há avaliações
- Relatório de Biologia (Fase Mitótica)Documento3 páginasRelatório de Biologia (Fase Mitótica)cfilipa5Ainda não há avaliações
- Inácio de Antioquia - Epístola Aos EfésiosDocumento6 páginasInácio de Antioquia - Epístola Aos EfésiosMayco BiasibettiAinda não há avaliações
- Exercícios Meio AmbienteDocumento3 páginasExercícios Meio AmbienteRodrigo SimõesAinda não há avaliações
- Um Conto de NatalDocumento25 páginasUm Conto de NatalSpartacus SouzaAinda não há avaliações
- Comida Do BrasilDocumento12 páginasComida Do Brasilchiaralentini52Ainda não há avaliações
- Controlo Do Ruído Nos Centros Urbanos-CONFERÊNCIA 02Documento23 páginasControlo Do Ruído Nos Centros Urbanos-CONFERÊNCIA 02Eduardo Catito LuandaAinda não há avaliações
- Tabela UNIQUEDocumento1 páginaTabela UNIQUEMaxirlei NascimentoAinda não há avaliações
- Cálculo de Contribuições - Guia Da Previdência Social MES 04Documento2 páginasCálculo de Contribuições - Guia Da Previdência Social MES 04codigos escritorioAinda não há avaliações
- Trabalho FisicaDocumento3 páginasTrabalho FisicaMarlluzAinda não há avaliações
- NST-biologia2-Métodos Científicos e Níveis de Organização em BiologiaDocumento8 páginasNST-biologia2-Métodos Científicos e Níveis de Organização em BiologiaGabriella MartinsAinda não há avaliações
- Mamíferos de Importância EconômicaDocumento34 páginasMamíferos de Importância EconômicaCarlos ToffoloAinda não há avaliações
- Defensivos Agroquimicos UvaDocumento15 páginasDefensivos Agroquimicos UvaLeandro FrenedaAinda não há avaliações
- Dotação de Medicamentos e Materiais de Primeiros SocorrosDocumento2 páginasDotação de Medicamentos e Materiais de Primeiros SocorrosWladsonAinda não há avaliações
- 1 - A Natureza Da EletricidadeDocumento27 páginas1 - A Natureza Da EletricidadeGilmar Ferreira EliasAinda não há avaliações
- Paramentação e DesparamentaçãoDocumento10 páginasParamentação e DesparamentaçãomarcionelioAinda não há avaliações
- Resumo Da Anatomia e Fisiologia Do Recém NascidoDocumento14 páginasResumo Da Anatomia e Fisiologia Do Recém NascidoFelipe Anderson50% (2)
- Climatização em Consultório OdontológicoDocumento13 páginasClimatização em Consultório OdontológicoPaulo Cezar0% (1)
- Embriologia-Exercicios de FixacaoDocumento7 páginasEmbriologia-Exercicios de Fixacaor_neriAinda não há avaliações
- Geografia Cap03 MinDocumento3 páginasGeografia Cap03 MinLuciana Lu100% (1)
- Amelogênese Imperfeita 1Documento3 páginasAmelogênese Imperfeita 1Robson MoreiraAinda não há avaliações
- Estatuto Dos Servidores Públicos de Cruz Das AlmasDocumento62 páginasEstatuto Dos Servidores Públicos de Cruz Das AlmasFábio Elker50% (8)
- Resumo Sistema CardiovascularDocumento2 páginasResumo Sistema CardiovascularLaura100% (1)
- Ritual e PerfidiaDocumento8 páginasRitual e PerfidiaJaarnoAinda não há avaliações
- Planilha 5km Iniciante 8s COSANDocumento1 páginaPlanilha 5km Iniciante 8s COSANcachorro lokoAinda não há avaliações