Escolar Documentos
Profissional Documentos
Cultura Documentos
P Equílibrio Químico
Enviado por
Luna SchlittlerDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
P Equílibrio Químico
Enviado por
Luna SchlittlerDireitos autorais:
Formatos disponíveis
Data:
Nota:
Prova: 25 pontos
Aluno (a): Turma:
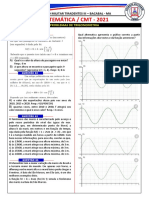
1) No início do século XX, a expectativa da Primeira Guerra Mundial gerou uma grande
necessidade de compostos nitrogenados. Haber foi o pioneiro na produção de amônia, a
partir do nitrogênio do ar. Se a amônia for colocada num recipiente fechado, sua
decomposição ocorrerá de acordo com a seguinte equação química não balanceada:
NH3 (g) ↔ N2 (g) + H2 (g)
As variações das concentrações com o tempo estão ilustradas na figura abaixo.
A partir da análise da figura acima, podemos afirmar que as curvas A, B e C representam
a variação temporal das concentrações dos seguintes componentes da reação,
respectivamente:
a) H2, N2 e NH3
b) NH3, H2 e N2
c) NH3, N2 e H2
d) N2, H2 e NH3
e) H2, NH3 e N2
2) Em um recipiente de 500 mL, encontram-se, em condições de equilíbrio, 0,48 g de
NO2 e 2 g de N2O4. Calcule a constante de equilíbrio, em termos de concentração, para a
reação abaixo (massas atômicas: N = 14; O = 16).
2 NO2 ↔ N2O4
3) Sabendo-se que K é igual a 69 para a reação N2 + 3 H2 ↔ 2 NH3 a 500 °C e que a
análise de um recipiente de 7 L mostrou que a 500 °C se encontravam presentes, no estado
de equilíbrio, 3,71 mols de hidrogênio e 4,55 mols de amoníaco. Qual o número de mols
de nitrogênio presente no recipiente é:
4) Para a reação AB (g) ↔ 2 CD (g), a constante de equilíbrio é igual a 0,4, a 100 °C. Na
tabela abaixo, constam as concentrações de AB e CD, em cinco sistemas diferentes, todos
a 100 °C.
Dentre eles, qual o único sistema que se encontra em equilíbrio?
5) Num recipiente de volume constante igual a 1,00 litro, inicialmente evacuado, foi
introduzido 1,00 mol de pentacloreto de fósforo gasoso e puro. O recipiente foi mantido
a 250 °C e no equilíbrio final foi verificada a existência de 0,47 mol de gás cloro. Das
opções abaixo, identifique a que contém o valor aproximado da constante (Kc) do
equilíbrio estabelecido dentro do cilindro e representado pela seguinte equação química:
PCl5 (g) ↔ PCl3 (g) + Cl2 (g)
a) 0,179 b) 0,22 c) 0,42 d) 2,38 e) 4,52
6) Um método proposto para coletar energia solar consiste na utilização dessa energia
para aquecer a 800 °C trióxido de enxofre - SO3 - ocasionando a reação:
2 SO3 (g) ↔ 2 SO2 (g) + O2 (g)
Os compostos SO2 (g) e O2 (g), assim produzidos, são introduzidos em um trocador de
calor de volume correspondente a 1,0 L e se recombinam produzindo SO3 e liberando
calor. Se 5,0 mols de SO3 sofrem 60% de dissociação nessa temperatura, identifique o
valor correto de Kc.
a) 1,1 b) 1,5 c) 3,4 d) 6,7 e) 9
Você também pode gostar
- Slides OndasDocumento60 páginasSlides OndasRosangela GonçalvesAinda não há avaliações
- Vasos Horizontais - Tampos Torisféricos - ExemploDocumento7 páginasVasos Horizontais - Tampos Torisféricos - ExemploMich3lstreetdk100% (1)
- Calor Específico e Quantidade de CalorDocumento5 páginasCalor Específico e Quantidade de CalorRobson SalvianoAinda não há avaliações
- Guia Didático para o Ensino de QuímicaDocumento234 páginasGuia Didático para o Ensino de QuímicaLuna Schlittler100% (1)
- Lista de Exercícios Equilíbrio Químico UFPBDocumento3 páginasLista de Exercícios Equilíbrio Químico UFPBAline MirandaAinda não há avaliações
- Equilíbrio químico - lista de exercícios resume de forma concisa e otimizada para o conteúdo do documento, que trata de uma lista de exercícios sobre equilíbrio químico, como solicitadoDocumento5 páginasEquilíbrio químico - lista de exercícios resume de forma concisa e otimizada para o conteúdo do documento, que trata de uma lista de exercícios sobre equilíbrio químico, como solicitadoLussandra MarquezAinda não há avaliações
- Equilíbrio Químico - Constante de Equilíbrio KcDocumento9 páginasEquilíbrio Químico - Constante de Equilíbrio KcRaisson HolandaAinda não há avaliações
- Anexo III - Memória de Reforço - Torre Paranapiacaba - R00Documento53 páginasAnexo III - Memória de Reforço - Torre Paranapiacaba - R00Will F AlvesAinda não há avaliações
- 11F NL (Teste2 CC) - Nov2021Documento3 páginas11F NL (Teste2 CC) - Nov2021diana BaptistaAinda não há avaliações
- Equilíbrio químico - Constante de equilíbrio kcDocumento36 páginasEquilíbrio químico - Constante de equilíbrio kcbrandownAinda não há avaliações
- Exercícios Constante de EquilíbrioDocumento13 páginasExercícios Constante de EquilíbrioPietra LemosAinda não há avaliações
- FCMMG 2007 Resumo Prova Medicina e GabaritoDocumento74 páginasFCMMG 2007 Resumo Prova Medicina e GabaritoNovo BeagaAinda não há avaliações
- Química - Prof. Rafael - Equilíbrio Químico e Deslocamento de EquilíbrioDocumento12 páginasQuímica - Prof. Rafael - Equilíbrio Químico e Deslocamento de EquilíbrioRafael VaristeloAinda não há avaliações
- Go Tarefa Semanal Curso 5e8b7a80d74e8Documento22 páginasGo Tarefa Semanal Curso 5e8b7a80d74e8rafinhagebrinAinda não há avaliações
- Exerc Cálc Quím2009Documento4 páginasExerc Cálc Quím2009lurianmcAinda não há avaliações
- 51 20equil C3 ADbrio 20qu C3 ADmico 20ADocumento87 páginas51 20equil C3 ADbrio 20qu C3 ADmico 20AJhonny WalkerAinda não há avaliações
- Cálculo Estequimétrico (Slide 5) - Thiago VenceslauDocumento32 páginasCálculo Estequimétrico (Slide 5) - Thiago Venceslaugabrilanjo02Ainda não há avaliações
- Avaliação Quimica 160623Documento7 páginasAvaliação Quimica 160623LMM LMMAinda não há avaliações
- Revisão de Química GeralDocumento4 páginasRevisão de Química GeralRodrigo TorresAinda não há avaliações
- Constante de equilíbrio Kc para reação de formação de HCNDocumento22 páginasConstante de equilíbrio Kc para reação de formação de HCNDeborah LGAinda não há avaliações
- Lista de Equilíbrio Químico PDFDocumento3 páginasLista de Equilíbrio Químico PDFMarcelo SatorresAinda não há avaliações
- Go Tarefa Semanal 3 Serie e Curso 5e961d9f0ad5fDocumento15 páginasGo Tarefa Semanal 3 Serie e Curso 5e961d9f0ad5fBaptistaAinda não há avaliações
- Teste 4 v1Documento5 páginasTeste 4 v1André MatosAinda não há avaliações
- Kc Equilíbrio QuímicoDocumento2 páginasKc Equilíbrio QuímicoLuna SchlittlerAinda não há avaliações
- Lista de Equilíbrio QuímicoDocumento5 páginasLista de Equilíbrio QuímicoMÁRIO LIMAAinda não há avaliações
- Trabalho Rec Final Quim 9anoDocumento7 páginasTrabalho Rec Final Quim 9anoGuilherme MaiaAinda não há avaliações
- Exerc EquilibrioDocumento4 páginasExerc EquilibrioJr FantinellAinda não há avaliações
- Química - Lista de exercícios: Cálculo estequiométrico e estudo dos gases – 1o anoDocumento5 páginasQuímica - Lista de exercícios: Cálculo estequiométrico e estudo dos gases – 1o anoNina SinghAinda não há avaliações
- FCMMG 2007 Prova MedicinaDocumento72 páginasFCMMG 2007 Prova MedicinaGustavo Mayrink Torres0% (1)
- Exercícios de Equilíbrio - Módulo 43Documento31 páginasExercícios de Equilíbrio - Módulo 43frechesAinda não há avaliações
- Teoria de ácidos e bases de Bronsted-Lowry e equilíbrios químicosDocumento10 páginasTeoria de ácidos e bases de Bronsted-Lowry e equilíbrios químicosBelsia AlmeidaAinda não há avaliações
- calculos_das_constantes_intermediarioDocumento2 páginascalculos_das_constantes_intermediariovmosconta4Ainda não há avaliações
- Equilíbrio químico - Lista de exercíciosDocumento4 páginasEquilíbrio químico - Lista de exercíciosSamara CristinyAinda não há avaliações
- Lista de Exercícios II - Equilíbrio QuímicoDocumento6 páginasLista de Exercícios II - Equilíbrio QuímicoErenilson SantosAinda não há avaliações
- 51 20equil C3 ADbrio 20qu C3 ADmico 20ADocumento49 páginas51 20equil C3 ADbrio 20qu C3 ADmico 20AJohn Vieira OliveiraAinda não há avaliações
- Lista de Exercicio 1 CEFETDocumento6 páginasLista de Exercicio 1 CEFETVictor FabianoAinda não há avaliações
- Equilíbrio químico - Constante de equilíbrio KcDocumento8 páginasEquilíbrio químico - Constante de equilíbrio Kcprofmarkao0% (1)
- Química - 2º Ano - Estudo de Gases e Estequiometria - AtividadeDocumento59 páginasQuímica - 2º Ano - Estudo de Gases e Estequiometria - AtividadeGustavo100% (1)
- Alfa - Módulo 43 PDFDocumento31 páginasAlfa - Módulo 43 PDFjparatyAinda não há avaliações
- Questionário sobre Química geral experimental (2021/1Documento5 páginasQuestionário sobre Química geral experimental (2021/1Abraao SantanaAinda não há avaliações
- 40-Cálculos de EquilíbrioDocumento4 páginas40-Cálculos de Equilíbrionv77vnmAinda não há avaliações
- Equilíbrio químico e cálculos estequiométricosDocumento3 páginasEquilíbrio químico e cálculos estequiométricosnelson_honorioAinda não há avaliações
- Equilíbrio químico - exercícios de químicaDocumento8 páginasEquilíbrio químico - exercícios de químicaThania ArrudaAinda não há avaliações
- Resolução Da 2a Fase Da Fuvest 2008 QuímicaDocumento0 páginaResolução Da 2a Fase Da Fuvest 2008 QuímicaAndré Luís Della VolpeAinda não há avaliações
- Prova FinalDocumento2 páginasProva FinalLuna SchlittlerAinda não há avaliações
- Equilíbrios químicos e iônicosDocumento4 páginasEquilíbrios químicos e iônicosmailas33Ainda não há avaliações
- Lista de QuimicaDocumento9 páginasLista de QuimicaBeatriz Miranda MoreiraAinda não há avaliações
- Quimca 9cDocumento5 páginasQuimca 9cWalter BlerraAinda não há avaliações
- Fundamentos de Química - Propriedades dos Gases e Cinética QuímicaDocumento6 páginasFundamentos de Química - Propriedades dos Gases e Cinética QuímicaLaysa BebezinhaAinda não há avaliações
- Ficha Formativa Nº1 ReaçõesDocumento3 páginasFicha Formativa Nº1 ReaçõesMagda FerreiraAinda não há avaliações
- Lista de apoio química trimestralDocumento5 páginasLista de apoio química trimestralThaayna BarroosAinda não há avaliações
- Equilíbrio Químico: Reações e CálculosDocumento8 páginasEquilíbrio Químico: Reações e Cálculosbernardo garciaAinda não há avaliações
- F. T. Nº 1 - Q - Acerto - Cálculo Estequiométrico - Reagente Limitante PDFDocumento3 páginasF. T. Nº 1 - Q - Acerto - Cálculo Estequiométrico - Reagente Limitante PDFMarianaAinda não há avaliações
- Exercícios S3 (2) QuímicaDocumento14 páginasExercícios S3 (2) QuímicaademairmoreiraAinda não há avaliações
- Cinética da reação entre NO e Br2Documento2 páginasCinética da reação entre NO e Br2Alexander OrtizAinda não há avaliações
- Ligações intermoleculares e polaridadeDocumento9 páginasLigações intermoleculares e polaridadePedro FloresAinda não há avaliações
- Lista de Exercícios - Equilíbrio QuímicoDocumento3 páginasLista de Exercícios - Equilíbrio QuímicoBrunno AndradeAinda não há avaliações
- Exercícios CAp-COLUNIDocumento3 páginasExercícios CAp-COLUNImaiaAinda não há avaliações
- Kc de reações químicas em equilíbrioDocumento3 páginasKc de reações químicas em equilíbrioJr.estudos CavalcanteAinda não há avaliações
- Lista de exercícios equilíbrio químicoDocumento6 páginasLista de exercícios equilíbrio químicoJoice BeatrizAinda não há avaliações
- Trabalho de Recuperacao Final Quimica 3 Ano10115910Documento6 páginasTrabalho de Recuperacao Final Quimica 3 Ano10115910Vitória BarrosAinda não há avaliações
- Prova Recuperação - 1º Ano - 4º Bimestre - RomuloDocumento5 páginasProva Recuperação - 1º Ano - 4º Bimestre - RomuloromuloAinda não há avaliações
- Prova Final Química IDocumento2 páginasProva Final Química ILuna SchlittlerAinda não há avaliações
- Prova FinalDocumento2 páginasProva FinalLuna SchlittlerAinda não há avaliações
- Kc Equilíbrio QuímicoDocumento2 páginasKc Equilíbrio QuímicoLuna SchlittlerAinda não há avaliações
- Revisão Estrutura Atômica e Tabela PeriódicaDocumento25 páginasRevisão Estrutura Atômica e Tabela PeriódicaLuna SchlittlerAinda não há avaliações
- E Book O Ensino de Quimica PDFDocumento365 páginasE Book O Ensino de Quimica PDFbolota4Ainda não há avaliações
- Separação de MisturasDocumento1 páginaSeparação de MisturasMicaela KogelskiAinda não há avaliações
- Material Didático Refrigeração PDFDocumento97 páginasMaterial Didático Refrigeração PDFRílammis SantosAinda não há avaliações
- Como aplicar emulsão asfáltica e asfalto líquido de forma corretaDocumento7 páginasComo aplicar emulsão asfáltica e asfalto líquido de forma corretaEdson MiguelAinda não há avaliações
- Preços unitários de serviços topográficos e sondagensDocumento85 páginasPreços unitários de serviços topográficos e sondagensFilipeAinda não há avaliações
- 01 ETEC PotênciaDocumento5 páginas01 ETEC Potênciaevaristo gonçalves oliveiraAinda não há avaliações
- Segunda Lei de Newton - RelatórioDocumento6 páginasSegunda Lei de Newton - RelatórioBruno MendesAinda não há avaliações
- Recomendação Técnica para Projetos de Estruturas Autoportantes de Concreto Armado para Linhas de TransmissãoDocumento31 páginasRecomendação Técnica para Projetos de Estruturas Autoportantes de Concreto Armado para Linhas de TransmissãoFelipe DornellesAinda não há avaliações
- Máquinas simples: ferramentas que facilitam o trabalhoDocumento3 páginasMáquinas simples: ferramentas que facilitam o trabalhoCarla CardosoAinda não há avaliações
- 365838-Material de Aula Escoamento Interno ViscosoDocumento46 páginas365838-Material de Aula Escoamento Interno ViscosobeforeRGAinda não há avaliações
- 03 - Dee261 - Operacoes - Unitarias - Metodos - de - Operação - Dos - Evaporadores - 2023 - 2Documento23 páginas03 - Dee261 - Operacoes - Unitarias - Metodos - de - Operação - Dos - Evaporadores - 2023 - 2natalianeumannAinda não há avaliações
- Propriedades e fatores que influenciam a formação e estabilidade de espumas alimentíciasDocumento4 páginasPropriedades e fatores que influenciam a formação e estabilidade de espumas alimentíciasRenata KellyAinda não há avaliações
- Principios Da Optica Geometrica e Suas eDocumento9 páginasPrincipios Da Optica Geometrica e Suas eJair Valadares CostaAinda não há avaliações
- Soluções Teoria e ExercíciosDocumento15 páginasSoluções Teoria e ExercíciosANA RITA MACHADOAinda não há avaliações
- Exercícios GeotecniaDocumento2 páginasExercícios GeotecniaMaiara NascimentoAinda não há avaliações
- Máquinas síncronas: ajuste do fator de potência e impacto nas perdas da redeDocumento27 páginasMáquinas síncronas: ajuste do fator de potência e impacto nas perdas da redeFernando SouzaAinda não há avaliações
- TECHNOSAFEDocumento20 páginasTECHNOSAFErenato cesar de andradeAinda não há avaliações
- Relatório sobre experimento de força elástica em molasDocumento11 páginasRelatório sobre experimento de força elástica em molasLincoln CesarAinda não há avaliações
- Problemas de TrigonometriaDocumento2 páginasProblemas de TrigonometriaRogério CostaAinda não há avaliações
- Pneumática Fatec Taubaté 2014Documento11 páginasPneumática Fatec Taubaté 2014pmarcelofAinda não há avaliações
- Mecânica dos Fluidos e Transferência de Calor - Prova P02Documento2 páginasMecânica dos Fluidos e Transferência de Calor - Prova P02THAISA CRISTINA DEMARCOAinda não há avaliações
- ARENDT Hannah O Conceito de Historia Antigo e Moderno in Entre o Passado e o Futuro Sao Paulo Perspectiva 2007 PDFDocumento81 páginasARENDT Hannah O Conceito de Historia Antigo e Moderno in Entre o Passado e o Futuro Sao Paulo Perspectiva 2007 PDFRoger BianchiAinda não há avaliações
- Atividade Laboratório Físico-QuímicaDocumento9 páginasAtividade Laboratório Físico-QuímicaOtoazevedo OtoazevedoAinda não há avaliações
- Diagrama Eletrico d61Documento12 páginasDiagrama Eletrico d61Filipe MartimilianoAinda não há avaliações
- Ligações Químicas 3Documento65 páginasLigações Químicas 3Michel SouzaAinda não há avaliações
- Lista 2Documento21 páginasLista 2Gráfica Grafitec100% (2)