Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista 11 - Polaridade Das Moléculas e Forças Intermoleculares
Enviado por
Vinícius Oliveira da Silva PintoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Lista 11 - Polaridade Das Moléculas e Forças Intermoleculares
Enviado por
Vinícius Oliveira da Silva PintoDireitos autorais:
Formatos disponíveis
Lista 11 – Polaridade das moléculas
e Forças intermoleculares
1) Determine se as ligações a seguir são polares ou I. A molécula CO2 é apolar, sendo formada por
apolares e especifique também se são iônicas ou ligações covalentes polares.
covalentes: II. A molécula H2O é polar, sendo formada por ligações
a) H2 covalentes apolares.
b) HCl III. A molécula NH3 é polar, sendo formada por
c) Cl2 ligações iônicas.
d) CO2 Concluiu-se que:
e) NH3 a) somente I é correta.
b) somente II é correta.
2) Escreva as fórmulas estruturais de cada uma das c) somente III é correta.
moléculas abaixo. Depois classifique-as como polares d) somente II e III são corretas.
ou apolares. e) somente I e III são corretas.
a) N2
b) HCN 6) Dentre as afirmativas abaixo, assinalar a que
c) H2O contém a afirmação incorreta.
d) O2 a) Ligação covalente é aquela que se dá pelo
compartilhamento de elétrons entre dois átomos.
3) A ligação covalente de maior polaridade ocorre b) O composto covalente HCℓ é polar, devido à
entre H e átomos de: diferença de eletronegatividade existente entre os
a) F átomos de hidrogênio e cloro.
b) Cl c) O composto formado entre um metal alcalino e
c) Br halogênio é covalente.
d) I d) A substância da fórmula Br2 é apolar.
e) At e) A substância da fórmula CaI2 é iônica.
4) Na escala de eletronegatividade, tem-se: 7) Relacione as colunas abaixo e indique quais são as
Li H Br N O principais forças intermoleculares (coluna I) que
1,0 2,1 2,8 3,0 3,5 ocorrem entre as moléculas das substâncias
Esses dados permitem afirmar que, entre as moléculas moleculares listadas na coluna II.
a seguir, a mais polar é:
Coluna I:
a) O2 (g)
I- Ligação de hidrogênio;
b) LiBr (g)
II- Interação dipolo-dipolo;
c) NO (g)
III- Interação dipolo induzido-dipolo induzido.
d) HBr (g)
Coluna II:
e) Li2 (g)
a) Amônia (NH3).
b) Água (H2O).
5) Analise as seguintes informações:
c) Bromo (Br2).
d) Cianeto de hidrogênio (HCN).
10) Uma pesquisa publicada na revista Nature (Ano:
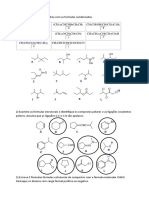
8) O conhecimento das estruturas das moléculas é um 2000, vol.405, pg. 681,) mostrou que a habilidade das
assunto bastante relevante, já que as formas das lagartixas (víboras) em escalar superfícies lisas como
moléculas determinam propriedades das substâncias uma parede, por exemplo, é resultado de interações
como odor, sabor, coloração e solubilidade. As figuras intermoleculares. Admitindo que a parede é recoberta
apresentam as estruturas das moléculas de CO 2, H2O, por um material apolar e encontra‐se seca, assinale a
NH3, CH4, H2S e PH3. alternativa que classifica corretamente o tipo
de interação que prevalece entre as lagartixas e a
parede, respectivamente:
a) íon – íon.
b) íon – dipolo permanente.
c) dipolo induzido – dipolo induzido.
d) dipolo permanente – dipolo induzido.
e) dipolo permanente – dipolo permanente.
11) Um dos testes realizados para a determinação da
Estruturas de moléculas em exercícios sobre
quantidade de álcool na gasolina é aquele em que se
interações intermoleculares
lhe adiciona água, ocasionando a extração do álcool
Quanto às forças intermoleculares, a molécula que
pela água. Isso pode ser explicado pelo fato de álcool
forma ligações de hidrogênio (pontes de hidrogênio)
e água possuírem:
com a água é:
a) ligações covalentes simples e dativas.
a) H2S.
b) forças de atração por ligações de hidrogênio.
b) CH4.
c) forças de atração por forças de Van der Waals.
c) NH3.
d) o grupo OH- carboxila.
d) PH3.
e) moléculas apolares.
e) CO2.
12) Analise as seguintes afirmativas em relação à
9) O dióxido de carbono, presente na atmosfera e nos
molécula de iodo (I2) e à sua dissolução direta em
extintores de incêndio, apresenta ligação entre os
água:
seus átomos do tipo....... e suas moléculas estão
I. A molécula de iodo é facilmente dissolvida em água.
unidas por ....... .
II. A molécula de iodo é apolar.
Os espaços acima são corretamente preenchidos pela
III. São estabelecidas ligações de hidrogênio entre o I 2
alternativa:
e a água.
a) covalente apolar - forças de London
b) covalente apolar - atração dipolo induzido-dipolo
Está(ão) CORRETA(S) a(s) afirmativa(s)
induzido
a) I apenas.
c) covalente polar - ligações de hidrogênio
b) II apenas.
d) covalente polar - forças de London
c) III apenas.
e) covalente polar - atração dipolo-dipolo
d) I e II apenas.
e) II e III apenas.
Você também pode gostar
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- DEPENDENCIA - 1°ano (30-04)Documento2 páginasDEPENDENCIA - 1°ano (30-04)Junior MottaAinda não há avaliações
- Lista 3 Forcas Intermoleculares - QGE TPQ 2017Documento2 páginasLista 3 Forcas Intermoleculares - QGE TPQ 2017Bia CabralAinda não há avaliações
- Atividade Complementar 2 - 1º Ano - 3 EtapaDocumento3 páginasAtividade Complementar 2 - 1º Ano - 3 EtapaWard LauarAinda não há avaliações
- Lista Exercícios - Interações IntermolecularesDocumento2 páginasLista Exercícios - Interações IntermolecularesalexchacalAinda não há avaliações
- QUIMICA, Primeira ListaDocumento3 páginasQUIMICA, Primeira ListaJúlia PioAinda não há avaliações
- Lista Extra 14 - Química - Espcex - Forças Intermoleculares - Paulo - Dia 16 de Fevereiro 2024Documento5 páginasLista Extra 14 - Química - Espcex - Forças Intermoleculares - Paulo - Dia 16 de Fevereiro 2024denysvictorcAinda não há avaliações
- FF3.4 - 2.1.3 - CCDocumento4 páginasFF3.4 - 2.1.3 - CCiolaAinda não há avaliações
- 010 Lista 10 - Polaridade Molecular e Forças Intermoleculares (Aluno)Documento3 páginas010 Lista 10 - Polaridade Molecular e Forças Intermoleculares (Aluno)Ana Célia FerreiraAinda não há avaliações
- FT 11 - Ligações Intermoleculares.Documento2 páginasFT 11 - Ligações Intermoleculares.Rita OliveiraAinda não há avaliações
- 11 20polaridade 20de 20mol C3 A9culasDocumento5 páginas11 20polaridade 20de 20mol C3 A9culasTatiana Ronsani MartinsAinda não há avaliações
- Lista Ligaçoes 1Documento1 páginaLista Ligaçoes 1rubens.costaAinda não há avaliações
- Q10. A3 - Ficha Treino N.º 1 - Ligação QuimicaDocumento3 páginasQ10. A3 - Ficha Treino N.º 1 - Ligação QuimicaMiguel AntonioAinda não há avaliações
- 11 20polaridade 20de 20mol C3 A9culas 20VDocumento16 páginas11 20polaridade 20de 20mol C3 A9culas 20Vlucas melloAinda não há avaliações
- Cópia de Exercícios Ligações (1) ADocumento6 páginasCópia de Exercícios Ligações (1) Alorenzo flores dalla corteAinda não há avaliações
- 10FQA Ficha Trab Ini Q2.1 - N.º 4Documento2 páginas10FQA Ficha Trab Ini Q2.1 - N.º 4Bia100% (1)
- Lista de Exerccios 2022Documento18 páginasLista de Exerccios 2022Ralac MajavAinda não há avaliações
- Forças Intermoleculares PDFDocumento8 páginasForças Intermoleculares PDFlucas senaAinda não há avaliações
- 3AV2 QUIM 1EM ANA TipoADocumento2 páginas3AV2 QUIM 1EM ANA TipoAAna Célia FerreiraAinda não há avaliações
- Aquecimento de Ligacoes Quimicas... 1ºDocumento3 páginasAquecimento de Ligacoes Quimicas... 1ºJean Neves dos Santos SerraAinda não há avaliações
- Ligacoes QuimicasDocumento5 páginasLigacoes QuimicasJamirJamirJamirAinda não há avaliações
- 5 - Lista de ExercíciosDocumento6 páginas5 - Lista de ExercíciosjessicatoquiAinda não há avaliações
- Aula15 Quimica1 ExercíciosDocumento4 páginasAula15 Quimica1 ExercíciosSayori CosmeticosAinda não há avaliações
- Ligações Químicas, Forças Intermoleculares e Geometria MolecularDocumento4 páginasLigações Químicas, Forças Intermoleculares e Geometria MolecularRayane MariaAinda não há avaliações
- Efqg15. Forças Intermoleculares PDFDocumento6 páginasEfqg15. Forças Intermoleculares PDFsandraAinda não há avaliações
- Ligações Quimica 2 - A GraçaDocumento2 páginasLigações Quimica 2 - A GraçaPetrustn50% (2)
- POLARIDADEDocumento16 páginasPOLARIDADEDangley CoserAinda não há avaliações
- Exercício de Revisão Ligações QuímicasDocumento8 páginasExercício de Revisão Ligações QuímicascarlostucupiAinda não há avaliações
- GABARITO Exercicios Extras Aulas 2Documento4 páginasGABARITO Exercicios Extras Aulas 2Julia Helena RossieriAinda não há avaliações
- TD de Química 1-1Documento2 páginasTD de Química 1-1Kosair TroviAinda não há avaliações
- Revisão Química 2Documento6 páginasRevisão Química 2pixkaraAinda não há avaliações
- Lista 2Documento2 páginasLista 2Marcilio Santos SilvaAinda não há avaliações
- Lista 8 - Química I - PMT CG (GEOMETRIA MOLECULAR) SEM GABARITO PDFDocumento5 páginasLista 8 - Química I - PMT CG (GEOMETRIA MOLECULAR) SEM GABARITO PDFCamillaCarvalhoAinda não há avaliações
- QuimicaDocumento12 páginasQuimicaHellyan WilkerAinda não há avaliações
- Alista 06 - Geometria e Polaridade Das Moelculas - Inmteracoes IntermolecularesDocumento6 páginasAlista 06 - Geometria e Polaridade Das Moelculas - Inmteracoes IntermolecularesHeitorAinda não há avaliações
- Projeto Med Ligações QuimicasDocumento12 páginasProjeto Med Ligações Quimicassofia brasileiroAinda não há avaliações
- Ligações Químicas ExercíciosDocumento2 páginasLigações Químicas ExercíciosRafael Ramos Castellari100% (1)
- Exercicios de Ligacoes Quimicas... 1ºDocumento3 páginasExercicios de Ligacoes Quimicas... 1ºNathalya BeatrizAinda não há avaliações
- Lista de Exercícios #1Documento6 páginasLista de Exercícios #1Matheus MatosAinda não há avaliações
- Ligações IntermolecularesDocumento39 páginasLigações IntermolecularesDangley CoserAinda não há avaliações
- 06-03 - Ligações Químicas - Ligação CovalenteDocumento12 páginas06-03 - Ligações Químicas - Ligação CovalenteThais DantasAinda não há avaliações
- Quimica 1 Exercicios Anamnese 5Documento6 páginasQuimica 1 Exercicios Anamnese 5Prof GabrielaAinda não há avaliações
- Ligacoes Quimicas IIDocumento4 páginasLigacoes Quimicas IIsrfesjiunAinda não há avaliações
- LISTA QuimDocumento2 páginasLISTA QuimCursinho AcepuspAinda não há avaliações
- Geometria MolecularDocumento4 páginasGeometria MolecularemyllekAinda não há avaliações
- P01070903 - 9 Avaliação de Química 9º Ano 3º BimestreDocumento2 páginasP01070903 - 9 Avaliação de Química 9º Ano 3º BimestreVanessa BorgesAinda não há avaliações
- Estudo Dirigido 3 - Ligaes Qumicas e Propriedades CompostosDocumento3 páginasEstudo Dirigido 3 - Ligaes Qumicas e Propriedades CompostosMaria Luiza FachinettoAinda não há avaliações
- Exercícios - Lista (Aula 5)Documento5 páginasExercícios - Lista (Aula 5)Cursinho AcepuspAinda não há avaliações
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Tópico 9 - Listas e Provas - RevDocumento6 páginasTópico 9 - Listas e Provas - RevJulia GonçalvesAinda não há avaliações
- Avaliação Do 9º Ano A - Tabela e Ligações Químicas - 3º BimestreDocumento1 páginaAvaliação Do 9º Ano A - Tabela e Ligações Químicas - 3º BimestreMarina Cangussu Starling AmorimAinda não há avaliações
- Lista Exercícios TomDocumento2 páginasLista Exercícios TomLEE MARXAinda não há avaliações
- Materiais Cerâmicos-Unidade I-Ligações Quimicas 1Documento16 páginasMateriais Cerâmicos-Unidade I-Ligações Quimicas 1Willian SilveiraAinda não há avaliações
- Terceira Lista de ExerciciosDocumento3 páginasTerceira Lista de ExerciciosSamantha CarlaAinda não há avaliações
- Por Que Os Átomos Se LigamDocumento9 páginasPor Que Os Átomos Se LigampmarcelopontesAinda não há avaliações
- Aula 3 - LigaçãoquimicaDocumento65 páginasAula 3 - LigaçãoquimicaLeonardo MacielAinda não há avaliações
- TOM - Teoria de Orbital MolecularDocumento36 páginasTOM - Teoria de Orbital MolecularMateus Bichels De OliveiraAinda não há avaliações
- 1º ANO - LigaçõesquimicasDocumento6 páginas1º ANO - Ligaçõesquimicasmatheus xexeuAinda não há avaliações
- Química OrgânicaDocumento136 páginasQuímica OrgânicaRick ManoelAinda não há avaliações
- Primeira Prova Quimica Geral 02Documento4 páginasPrimeira Prova Quimica Geral 02Luis CarvalhoAinda não há avaliações
- Aula 1 IntroduçãoDocumento34 páginasAula 1 IntroduçãoMarcelo RibeiroAinda não há avaliações
- Lista de Exercício Tabela e Ligações QuimicasDocumento2 páginasLista de Exercício Tabela e Ligações Quimicaszilver2010Ainda não há avaliações
- Lista de Exercícios I GabaritoDocumento15 páginasLista de Exercícios I GabaritoThais Eliel De SouzaAinda não há avaliações
- Exercicio 15 HibridizacaoDocumento5 páginasExercicio 15 HibridizacaoJayAinda não há avaliações
- PROVA Ligações Ionicas e Covalentes 9ºanoDocumento1 páginaPROVA Ligações Ionicas e Covalentes 9ºanoMari_VAMAinda não há avaliações
- Lista 2geometria Molecular PDFDocumento2 páginasLista 2geometria Molecular PDFVictor EduardoAinda não há avaliações
- Ligações QuímicasDocumento9 páginasLigações QuímicasGonçalo Rilhas100% (1)
- Aula 9 - Teoria Do Orbital MolecularDocumento32 páginasAula 9 - Teoria Do Orbital Molecularmax_patricioAinda não há avaliações
- Ligação CovalenteDocumento25 páginasLigação CovalenteAlexandre PereiraAinda não há avaliações
- Química - 1º Ano - LigaçõesDocumento17 páginasQuímica - 1º Ano - LigaçõesBianca SiqueiraAinda não há avaliações
- Polaridade Das LigaçõesDocumento11 páginasPolaridade Das LigaçõesjianzinhooAinda não há avaliações
- Ligações QuímicasDocumento30 páginasLigações QuímicasAnimes BackupAinda não há avaliações
- Apostila - Química Orgânica - 1º SemestreDocumento246 páginasApostila - Química Orgânica - 1º SemestreGustavo AngelimAinda não há avaliações
- Bloco 5 AULA Tópicos 32-38Documento11 páginasBloco 5 AULA Tópicos 32-38Gabriel Ângelo Tavares Alves Da SilvaAinda não há avaliações
- 2 Ligações CovalentesDocumento3 páginas2 Ligações CovalentesGuilherme CantanteAinda não há avaliações
- Aula 06 - Molécula Geometria e Interações - EnEM 2023Documento122 páginasAula 06 - Molécula Geometria e Interações - EnEM 2023Endro PeixotoAinda não há avaliações
- Exercícios Extras Estruturas ResolvidosDocumento4 páginasExercícios Extras Estruturas ResolvidosjlopesscridbAinda não há avaliações
- Exercícios - LigaçõesDocumento1 páginaExercícios - LigaçõesnayaracoriolanoAinda não há avaliações
- Lista de Exercícios 3Documento3 páginasLista de Exercícios 3LucaGamerHue BRAinda não há avaliações