Escolar Documentos
Profissional Documentos
Cultura Documentos
Exercícios (Pós Experimento) Aula 3
Enviado por
Diico Marcondes0 notas0% acharam este documento útil (0 voto)
5 visualizações2 páginasEste documento discute as forças intermoleculares e seus efeitos no ponto de fusão de materiais. As principais ideias são:
1) As forças intermoleculares mais intensas, como as ligações de hidrogênio, requerem temperaturas mais elevadas para quebrar, resultando em pontos de fusão mais altos.
2) O gelo seco se mantém sólido devido às forças de Van der Waals entre suas moléculas apolares de CO2.
3) Diferentes tipos de forças intermoleculares, como l
Descrição original:
Título original
Exercícios (pós experimento) Aula 3
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoEste documento discute as forças intermoleculares e seus efeitos no ponto de fusão de materiais. As principais ideias são:
1) As forças intermoleculares mais intensas, como as ligações de hidrogênio, requerem temperaturas mais elevadas para quebrar, resultando em pontos de fusão mais altos.
2) O gelo seco se mantém sólido devido às forças de Van der Waals entre suas moléculas apolares de CO2.
3) Diferentes tipos de forças intermoleculares, como l
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
5 visualizações2 páginasExercícios (Pós Experimento) Aula 3
Enviado por
Diico MarcondesEste documento discute as forças intermoleculares e seus efeitos no ponto de fusão de materiais. As principais ideias são:
1) As forças intermoleculares mais intensas, como as ligações de hidrogênio, requerem temperaturas mais elevadas para quebrar, resultando em pontos de fusão mais altos.
2) O gelo seco se mantém sólido devido às forças de Van der Waals entre suas moléculas apolares de CO2.
3) Diferentes tipos de forças intermoleculares, como l
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 2
CIÊNCIA DOS MATERIAIS
AULA 3
FORÇAS INTERMOLECULARES – PONTO DE FUSÃO
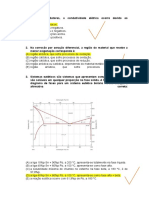
1. Os hidrocarbonetos são moléculas orgânicas com uma série de aplicações industriais.
Por exemplo, eles estão presentes em grande quantidade nas diversas frações do
petróleo e normalmente são separados por destilação fracionada, com base em suas
temperaturas de ebulição. O quadro apresenta as principais frações obtidas na
destilação do petróleo em diferentes faixas de temperaturas.
Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas
porque
a) suas densidades são maiores.
b) o número de ramificações é maior.
c) sua solubilidade no petróleo é maior.
d) as forças intermoleculares são mais intensas.
e) a cadeia carbônica é mais difícil de ser quebrada.
2. O gelo seco corresponde ao CO2 solidificado, cuja fórmula estrutural é O=C=O. O
estado sólido é explicado por uma única proposição. Identifique-a:
a. Forças de Van der Waals entre moléculas fortemente polares do CO 2.
b. Pontes de hidrogênio entre moléculas do CO 2.
c. Pontes de hidrogênio entre a água e o CO 2.
d. Forças de Van der Waals entre as moléculas apolares do CO 2.
e. Interações fortes entre os dipolos na molécula do CO 2.
3. Em substâncias moleculares, as moléculas se mantêm unidas nos estados sólido e
líquido por forças intermoleculares. Sobre esse tema, verifique se as afirmações abaixo
são verdadeiras ou falsas.
a. Os retículos cristalinos iônicos se originam a partir das ligações
intermoleculares de Van der Walls, formando arranjos cristalinos.
b. Em moléculas polares, que apresentam diferença de eletronegatividade entre
seus átomos, formam-se pólos positivos e negativos, e as forças atrativas
intermoleculares são do tipo dipolo permanente.
c. Em moléculas que apresentam hidrogênio ligado a um dos três elementos
mais eletronegativos (F, O e N) ocorre grande polarização, o que resulta em
uma interação forte denominada Ponte de Hidrogênio.
d. Em substâncias que apresentam moléculas apolares, as forças atrativas são do
tipo dipolo induzido, resultantes das distorções das nuvens eletrônicas das
moléculas.
e. Considerando duas substâncias com massas moleculares próximas, aquela que
apresenta forças intermoleculares mais intensas tem maior ponto de ebulição.
Você também pode gostar
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Apostila 6 - Forças IntermolecularesDocumento10 páginasApostila 6 - Forças IntermolecularesErik SpamAinda não há avaliações
- QFL-2340 2013 Aula 07 Propriedades FisicasDocumento61 páginasQFL-2340 2013 Aula 07 Propriedades FisicasHermerson MendesAinda não há avaliações
- 02 Forças Intermoleculares e Propriedades FísicasDocumento24 páginas02 Forças Intermoleculares e Propriedades Físicasluciano bragaAinda não há avaliações
- Lista de Atividades de Quimica MarçoDocumento3 páginasLista de Atividades de Quimica MarçokamillyAinda não há avaliações
- 10 FF 16 Ligacoes Intermoleculares Correcao 2023 24Documento3 páginas10 FF 16 Ligacoes Intermoleculares Correcao 2023 24Iara LançaAinda não há avaliações
- Aula15 Quimica1 ExercíciosDocumento4 páginasAula15 Quimica1 ExercíciosSayori CosmeticosAinda não há avaliações
- APOSTILA (Isomeria)Documento16 páginasAPOSTILA (Isomeria)Jonas SantosAinda não há avaliações
- Lista Polaridade e Interações IntermolecularesDocumento6 páginasLista Polaridade e Interações IntermolecularesjubskamarosAinda não há avaliações
- Exercícios de Estudo de MoléculasDocumento37 páginasExercícios de Estudo de MoléculasyagoAinda não há avaliações
- Forcas IntermolecularesDocumento40 páginasForcas IntermolecularesAna Cristina GarcezAinda não há avaliações
- 1° Revisão 3° Ano AlternativoDocumento6 páginas1° Revisão 3° Ano Alternativopaulo renato ribeiro santos RenatoAinda não há avaliações
- 10FQA Ficha Formativa Q2.1 - N.º 1Documento4 páginas10FQA Ficha Formativa Q2.1 - N.º 1Tiago SousaAinda não há avaliações
- Exercícios Sobre FI E ÁCIDOS - REVISÃOODocumento2 páginasExercícios Sobre FI E ÁCIDOS - REVISÃOOMariany SousaAinda não há avaliações
- QG108 Inter Intermolec Aula21Documento33 páginasQG108 Inter Intermolec Aula21Ricardo Alessandro Herides LaraAinda não há avaliações
- Aula16 - Quimica1 - Exercícios MarcelDocumento5 páginasAula16 - Quimica1 - Exercícios Marcelpedroemail67Ainda não há avaliações
- Teste Q2.1 N.º 2 - V1 10-4 CorrDocumento5 páginasTeste Q2.1 N.º 2 - V1 10-4 CorrBia100% (1)
- Ligacoes Intermoleculares Ficha 12Documento4 páginasLigacoes Intermoleculares Ficha 12SérgioAinda não há avaliações
- Ligacoes Intermoleculares Ficha 12Documento3 páginasLigacoes Intermoleculares Ficha 12Micaela AmimAinda não há avaliações
- Propriedades e Estruturas Dos Compostos QuímicosDocumento11 páginasPropriedades e Estruturas Dos Compostos QuímicosJonesM CraftAinda não há avaliações
- Modulo 6 - Estado Fisico Das Substancias e Interaccoes Modo de CompatibilidadeDocumento57 páginasModulo 6 - Estado Fisico Das Substancias e Interaccoes Modo de CompatibilidadeRita BastosAinda não há avaliações
- Forças Intermoleculares 1Documento4 páginasForças Intermoleculares 1carolinecpetilloAinda não há avaliações
- Questions Quimica Ligacoes-QuimicasDocumento25 páginasQuestions Quimica Ligacoes-QuimicassbjabxjhsacAinda não há avaliações
- Questions Quimica Ligacoes-QuimicasDocumento27 páginasQuestions Quimica Ligacoes-QuimicaslylshrtaaoAinda não há avaliações
- Q6Documento12 páginasQ6Carla ValentimAinda não há avaliações
- Aula 12 - Forças IntermolecularesDocumento3 páginasAula 12 - Forças IntermolecularesMariany SousaAinda não há avaliações
- Ligações Intermoleculares - Jogo de Partículas 10º CDocumento3 páginasLigações Intermoleculares - Jogo de Partículas 10º CAna Raquel PintoAinda não há avaliações
- Forças IntermolecularesDocumento59 páginasForças IntermolecularesSaverio Silva100% (1)
- Enem 2Documento17 páginasEnem 2GrimmAinda não há avaliações
- Avaliacao Quimica 2oserie 1obi 05maiol22Documento2 páginasAvaliacao Quimica 2oserie 1obi 05maiol22João NetoAinda não há avaliações
- Forças IntermolecularesDocumento6 páginasForças IntermoleculareslailacristinaAinda não há avaliações
- Química - Pré-Vestibular Impacto - Forças IntermolecularesDocumento2 páginasQuímica - Pré-Vestibular Impacto - Forças IntermolecularesQuímica Qui100% (2)
- Aula - 1 - de Forças IntemolecularesDocumento42 páginasAula - 1 - de Forças IntemolecularesLisandra K. CorsiAinda não há avaliações
- Resumo 16 - Propriedades Físicas - QODocumento4 páginasResumo 16 - Propriedades Físicas - QOEfwatAinda não há avaliações
- Ficha TrabalhoDocumento4 páginasFicha TrabalhoCarolina RibeiroAinda não há avaliações
- Interações IntermolecularesDocumento10 páginasInterações IntermolecularesHugo AraujoAinda não há avaliações
- Ligações Intermoleculares Aula 8Documento7 páginasLigações Intermoleculares Aula 8Camila da SilvaAinda não há avaliações
- 2019 2020 Eq10 02 Teste Propriedades Transf Materia v1Documento10 páginas2019 2020 Eq10 02 Teste Propriedades Transf Materia v1Vera TavaresAinda não há avaliações
- Trabalho FQ - GrupoDocumento11 páginasTrabalho FQ - GrupoNightbotAinda não há avaliações
- Respostas - Quimica OrgânicaDocumento50 páginasRespostas - Quimica OrgânicaGisela AlmeidaAinda não há avaliações
- 6c2ba Teste q12Documento4 páginas6c2ba Teste q12Tomás CostaAinda não há avaliações
- Revisao - Simulado - INTERAÇÃO INTERMOLECULARESDocumento4 páginasRevisao - Simulado - INTERAÇÃO INTERMOLECULARESsamyra diverteAinda não há avaliações
- 5 - Lista de ExercíciosDocumento6 páginas5 - Lista de ExercíciosjessicatoquiAinda não há avaliações
- Ligações IntermolecularesDocumento22 páginasLigações Intermoleculares22158Ainda não há avaliações
- A Química Do Macro Ao MicroDocumento6 páginasA Química Do Macro Ao MicrodeboracorrAinda não há avaliações
- Exercícios - Moléculas e Propriedades - Ligações e GeometriaDocumento14 páginasExercícios - Moléculas e Propriedades - Ligações e GeometriaAndrea LastorinaAinda não há avaliações
- Estudo Dirigido 3 - Ligaes Qumicas e Propriedades CompostosDocumento3 páginasEstudo Dirigido 3 - Ligaes Qumicas e Propriedades CompostosMaria Luiza FachinettoAinda não há avaliações
- Poluição Atmosférica e Alternativas Aos Combustíveis FósseisDocumento18 páginasPoluição Atmosférica e Alternativas Aos Combustíveis FósseisÓ Stora ApoioAinda não há avaliações
- Ligação Quimica e CorreçãoDocumento6 páginasLigação Quimica e CorreçãodropadatiponeymarAinda não há avaliações
- Gabarito Lista IIDocumento2 páginasGabarito Lista IIueidson.b6724Ainda não há avaliações
- 15325216022012fundamentos de Quimica Aula 7Documento17 páginas15325216022012fundamentos de Quimica Aula 7Jefferson RibeiroAinda não há avaliações
- Questc3b4es de Quc3admica 3c2ba Ano Com DescritoresDocumento26 páginasQuestc3b4es de Quc3admica 3c2ba Ano Com DescritoresCirlene Oliveira Sousa0% (1)
- Quimica Geral Exercicios Resolvidos PolaridadeDocumento15 páginasQuimica Geral Exercicios Resolvidos PolaridadeMarina Serra100% (1)
- Ligao Quimica Foras-IntermolecularesDocumento54 páginasLigao Quimica Foras-Intermolecularesprof.amanluisaAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Enem 2018 - Ciências Da Natureza E Suas TecnologiasNo EverandEnem 2018 - Ciências Da Natureza E Suas TecnologiasAinda não há avaliações
- Sindrome Da Suspensão InerteDocumento2 páginasSindrome Da Suspensão InerteAnjos Do Resgate Mato GrossoAinda não há avaliações
- Plano de Aprendizagem 2021.2Documento7 páginasPlano de Aprendizagem 2021.2Diico MarcondesAinda não há avaliações
- Aula 7 - EscritaDocumento22 páginasAula 7 - EscritaDiico MarcondesAinda não há avaliações
- Aula1 TDEDocumento2 páginasAula1 TDEDiico MarcondesAinda não há avaliações
- Conhecendo Os Itens Da Semana de EstudoDocumento2 páginasConhecendo Os Itens Da Semana de EstudoDiico MarcondesAinda não há avaliações
- Todas Questões AsDocumento25 páginasTodas Questões AsDiico MarcondesAinda não há avaliações
- Aula 6escritoDocumento25 páginasAula 6escritoDiico MarcondesAinda não há avaliações
- Como Passar As Legendas Dos Vídeos Do YouTube Do Inglês para o PortuguêsDocumento2 páginasComo Passar As Legendas Dos Vídeos Do YouTube Do Inglês para o PortuguêsDiico MarcondesAinda não há avaliações
- TEMA 1 v1 Sem RespostasDocumento3 páginasTEMA 1 v1 Sem RespostasDiico MarcondesAinda não há avaliações
- Treinamento - Proteção em Máquinas (Novo)Documento47 páginasTreinamento - Proteção em Máquinas (Novo)Diico MarcondesAinda não há avaliações
- TEMA 1 GabaritoDocumento1 páginaTEMA 1 GabaritoDiico MarcondesAinda não há avaliações
- Questionário 01 NR-12Documento1 páginaQuestionário 01 NR-12Diico MarcondesAinda não há avaliações
- Treinamento - Proteção em Máquinas (Novo)Documento47 páginasTreinamento - Proteção em Máquinas (Novo)Diico MarcondesAinda não há avaliações