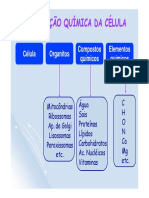
Estrutura Atômica e Conceitos Químicos
Enviado por
welecyjeas4Estrutura Atômica e Conceitos Químicos
Enviado por
welecyjeas4Explicações para Medicina – 2017 João, 3:16
A estrutura electrónica dos átomos
Em física e química, a teoria atómica da natureza da matéria, afirma que toda matéria
está composta por pequenas partículas chamadas átomos.
Constituição de um átomo
Os átomos têm uma zona central ou núcleo, à volta do qual giram os electrões (nuvem
electrónica).
O núcleo do átomo é formado por protões e por neutrões enquanto a nuvem
electrónica é formada pelos electrões.
Como o núcleo do átomo tem protões na sua constituição e cada protão tem carga
positiva (+1) e os neutrões não têm carga, conclui-se que o núcleo tem carga positiva.
A nuvem electrónica como é formada por electrões tem carga negativa.
Assim, diz-se que o átomo é eletricamente neutro porque a carga positiva do núcleo é
suficiente para anular a carga negativa da nuvem electrónica.
Número atómico (Z)
É o número de protões do núcleo do átomo. Caracteriza o elemento químico,
representa-se pela letra (Z).
Número de massa (A)
É o número de protões e neutrões existentes no núcleo do átomo, ou seja:
A=Z+N
A = número de massa
Z = número atómico
N = número de neutrões
A
Z X Símbolo do elemento químico.
Exemplo 1:
Número atómico – 6 C12 – Número de massa
A=Z+N
N=A-Z
N = 12 - 6
N = 6; (número de neutrões).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
1
Explicações para Medicina – 2017 João, 3:16
Exemplo: Na (sódio)
11 Na23
A = 11
N = 23 – 11
N = 12; (número de neutrões)
Elemento químico
É o conjunto de átomos que possuem o mesmo número atómico (Z).
Exemplo: todos os átomos que possuem 6 protões no seu núcleo são átomos de
carbono.
Massa atómica
Unidade de massa atómica (µ): esta unidade equivale a 1/12 da massa de um
átomo de carbono -12 (C12).
Representa-se pela letra minúscula µ.
Massa atómica
Representa o quanto mais pesado que 1/12 de um átomo de carbono -12 um átomo
químico qualquer é.
Exemplo: o oxigénio tem massa atómica de 16 µ, pois é 16 vezes mais pesado em
relação a uma parte ou a 1/12 de um átomo de 12C.
Massa Molecular (M.M)
É a soma das massas atómicas dos átomos que compõem uma molécula.
Exemplo: Numa molécula de água H2O teremos;
H=1; como são 2 H = 2 µ
O=16 µ
H2O = 2 µ + 16 µ = 18 µ
Relações atómicas
Isótopos
São átomos com o mesmo número atómico (Z), logo, pertencem ao mesmo elemento
químico, mas os seus números de neutrões são diferentes, portanto, têm diferentes
números de massa (A).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
2
Explicações para Medicina – 2017 João, 3:16
Um elemento químico pode ter vários isótopos, que diferem uns aos outros pelo
número de neutrões contidos no núcleo.
Exemplos:
16
Isótopos do elemento oxigénio: 8 O,178O,88O
Isótopos do elemento potássio: 39 19K,4019K,419K
Isótopos dos elementos hidrogénio:
O hidrogénio é o único elemento químico cujos isótopos possuem nome próprio. O
hidrogénio está constituído por três isótopos:
1 2 3
1 H 1H 1H
Prótio Deutrio Trítio
Isóbaros
São átomos com o mesmo número de massa (A). São átomos de diferentes elementos
químicos (de números atómicos diferentes, mas que apresentam o mesmo número de
massa).
Exemplo: o Argónio (Ar) e o cálcio (Ca).
18 Ar40 20Ca40
Ar
A = 40 A=Z+N
Z = 18 N=A–Z
N = 22 N = 40 – 18
N = 22
Ca
A = 40 A=Z+N
Z = 20 N=A–Z
N = 40 – 20
N = 20
Ambos com o mesmo número de massa (p + n). p=Z
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
3
Explicações para Medicina – 2017 João, 3:16
Isótonos
São átomos com o mesmo número de neutrões (N).Têm o mesmo número de
neutrões, mas diferentes números de protões e diferentes números de massa.
Exemplo: o boro e o carbono.
5B11 6C12
A = 11 A = 12
p=5 p=6
n=6 n=6
Ambos com o mesmo número de neutrões.
Número ou constante de avogado
É uma constante física fundamental que representa uma mol de entidades
elementares (átomos, moléculas, iões ou electrões).
A constante de avogado é definida como o número de átomos de carbono -12 em 12
gramas (0,12kg) de carbono -12, o que é aproximadamente igual a 6,022.10 23, que é o
seu valor.
Modelo estrutural do átomo
O átomo é a menor partícula que ainda caracteriza o elemento químico.
Modelos atómicos são os modelos que se usam para representar o átomo.
Atualmente, é o modelo da mecânica quântica ou da mecânica ondulatória ou modelo
orbital ou da nuvem eletrônica o aceito para definir a estrutura atômica.
Antiguidade
Na antiguidade acreditava-se que dividindo a matéria em pedaços cada vez menores,
chegar-se-ia a um ponto onde partículas, cada vez menores, seriam invisíveis ao olho
humano e, segundo alguns pensadores, indivisíveis. Graças a essa propriedade,
receberam o nome de átomos, termo que significa indivisíveis, em grego. Foi quando
surgiu entre os filósofos gregos o termo atomismo.
No século V a.C. Leucipo de Mileto juntamente a seu discípulo Demócrito de Abdera,
(400 a.C.), considerado o pai do atomismo grego, discorreram sobre a natureza da
matéria de forma elegante e precisa.
Segundo Demócrito a matéria era descontínua, portanto, ao invés dos corpos
macroscópicos, os corpos microscópicos, ou átomos não interpenetram-se nem
dividem-se, sendo suas mudanças observadas em certos fenômenos físicos e
químicos como associações de átomos e suas dissociações e que qualquer matéria é
resultado da combinação de átomos dos quatro elementos: ar; fogo; água e terra.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
4
Explicações para Medicina – 2017 João, 3:16
John Dalton
O professor da universidade inglesa New College de Manchester, John Dalton foi o
criador da primeira teoria atômica moderna na passagem do século XVIII para o
século XIX.
Em 1803 Dalton publicou o trabalho Absorption of Gases by Water and Other Liquids,
(Absorção de gases pela água e outros líquidos), neste delineou os princípios de seu
modelo atômico.
Segundo Dalton:
Átomos de elementos diferentes possuem propriedades diferentes entre si;
Átomos de um mesmo elemento possuem propriedades iguais e de peso
invariável;
Átomo é a menor porção da matéria, e são esferas maciças e indivisíveis;
Nas reações químicas, os átomos permanecem inalterados;
Na formação dos compostos, os átomos entram em proporções numéricas
fixas 1:1, 1:2, 1:3, 2:3, 2:5 etc.;
O peso total de um composto é igual à soma dos pesos dos átomos dos
elementos que o constituem.
Em 1808, John Dalton propôs a teoria do modelo atômico, onde o átomo é uma
minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga. Todos os
átomos de um mesmo elemento químico são idênticos. Seu modelo atômico foi
chamado de modelo atômico da bola de bilhar.
Em 1810 foi publicada a obra New System of Chemical Philosophy (Novo sistema de
filosofia química), nesse trabalho havia testes que provavam suas observações, como
a lei das pressões parciais, chamada de Lei de Dalton, entre outras relativas à
constituição da matéria.
Os átomos são indivisíveis e indestrutíveis;
Existe um número pequeno de elementos químicos diferentes na natureza;
Reunindo átomos iguais ou diferentes nas variadas proporções, podemos
formar todas as matérias do universo conhecidas (Como os Diamantes);
Joseph John Thompson
Em 1897, Joseph John Thompson formulou a teoria segundo a qual a matéria,
independente de suas propriedades, contém partículas de massa muito menores que
o átomo do hidrogênio. Inicialmente denominou-as de corpúsculos, depois conhecidas
como electrões e acreditava que era impossível auto-dividir as partes sem que ocorra
um serramento de fissão nuclear no átomo. A demonstração se deu ao comprovar a
existência daqueles corpúsculos nos raios catódicos disparados na ampola de crookes
(um tubo que continha vácuo), depois da passagem da corrente elétrica. Através de
suas experiências, Thompson concluiu que a matéria era formada por um modelo
atômico diferente do modelo atômico de Dalton: uma esfera de carga positiva continha
corpúsculos (electrões) de carga negativa distribuídos uniformemente. Tal modelo
ficou conhecido como pudim de passa.
Ernest Rutherford
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
5
Explicações para Medicina – 2017 João, 3:16
As bases para o desenvolvimento da física nuclear foram lançadas por Ernest
Rutherford ao desenvolver sua teoria sobre a estrutura atômica. O cientista estudou
por três anos o comportamento dos feixes de partículas ou raios X, além da emissão
de radioatividade pelo elemento Urânio. Uma das inúmeras experiências realizadas,
foi a que demonstrava o espalhamento das partículas alfa. Esta foi base experimental
do modelo atômico do chamado átomo nucleado onde electrões orbitavam em torno
de um núcleo. Durante suas pesquisas Rutherford observou que para cada 10.000
partículas alfa aceleradas incidindo numa lâmina de ouro, apenas uma refletia ou se
desviava de sua trajetória. A conclusão foi que o raio de um átomo poderia ser em
torno de 10.000 vezes maior que o raio de seu núcleo. Rutherford e Frederick Soddy
ainda, descobriram a existência dos raios gama e estabeleceram as leis das
transições radioativas das séries do tório, do actínio e do rádio. O modelo atômico de
Rutherford ficou conhecido como modelo planetário, pela sua semelhança com a
formação do Sistema Solar. Em 1911, Ernest Rutherford propôs o modelo de átomo
com movimentos planetários. Este modelo foi estudado e aperfeiçoado por Niels Bohr,
que acabou por demonstrar a natureza das partículas alfa como núcleos de hélio.
Niels Bohr
A teoria orbital de Rutherford encontrou uma dificuldade teórica resolvida por Niels
Bohr.
O modelo atómico de Bohr explicava os seguintes postulados:
1. O átomo possui um núcleo positivo que está rodeado de cargas negativas.
2. A electrosfera está dividida em camadas ou níveis eletrónicos e os electrões
nessas camadas apresentam energia constante.
3. Em sua camada de origem (camada estacionária) a energia é constante, mas o
electrão pode saltar para a camada mais externa, sendo que para tal é
necessário que ele ganhe energia externa.
4. Um electrão que saltou para uma camada de maior energia fica instável e
tende a voltar a sua camada de origem. Nesta volta o mesmo electrão devolve
a mesma quantidade de energia que havia ganho para saltar e emite em fotão
de luz (definido como um quantum de energia eletromagnética). A energia
recebida corresponde a um quantum e é dada por E = h x γ, onde:
E = é a energia do electrão.
h = é a constante de Planck que tem o valor de 6,63.10-34 J/s.
γ = Frequência de radiação. Portanto a energia absorvida é logo emitida e igual a
diferença entre os níveis 1 e 2: ΔE = h x γ = E2 – E1
O atual modelo atômico
Se sabe que os electrões possuem carga negativa, massa muito pequena e
que se movem em órbitas ao redor do núcleo atômico.
O núcleo atômico é situado no centro do átomo e constituído por protões que
são partículas de Carga elétrica positiva, cuja massa é aproximadamente 1.837
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
6
Explicações para Medicina – 2017 João, 3:16
vezes superior a massa do electrão, e por neutrões, partículas sem carga e
com massa ligeiramente superior a dos protões.
O átomo é eletricamente neutro, por possuir números iguais de electrões e
protões.
O número de protões no átomo se chama número atômico, este valor é
utilizado para estabelecer o lugar de um determinado elemento na tabela
periódica.
A tabela periódica é uma ordenação sistemática dos elementos químicos
conhecidos.
Cada elemento se caracteriza por possuir um número de electrões que se
distribuem nos diferentes níveis de energia do átomo correspondente.
Os níveis energéticos ou camadas, são denominados pelos símbolos K, L, M,
N, O, P e Q.
Cada camada possui uma quantidade máxima de electrões. A camada mais
próxima do núcleo K, comporta somente dois electrões; a camada L,
imediatamente posterior, oito, M, dezoito, N, trinta e dois, O, trinta e dois, P,
dezoito e Q possui oito.
Os electrões da última camada (mais afastados do núcleo) são responsáveis
pelo comportamento químico do elemento, por isso são denominados electrões
de valência.
O número de massa é equivalente à soma do número de protões e neutrões
presentes no núcleo.
O átomo pode perder electrões, carregando-se positivamente, é chamado de
ião positivo (catião).
Ao receber electrões, o átomo se torna negativo, sendo chamado ião negativo
(anião).
O deslocamento dos electrões provoca uma corrente elétrica, que dá origem a
todos os fenômenos relacionados à Eletricidade e ao magnetismo.
No núcleo do átomo existem duas forças de interação a chamada interação
nuclear forte, responsável pela coesão do núcleo, e a interação nuclear fraca,
ou força forte e força fraca respectivamente.
As forças de interação nuclear são responsáveis pelo comportamento do
átomo quase em sua totalidade.
As propriedades físico-químicas de um determinado elemento são
predominantemente dadas pela sua configuração electrónica, principalmente
pela estrutura da última camada, ou camada de valência.
As propriedades que são atribuídas aos elementos na tabela, se repetem
ciclicamente, por isso se denominou como tabela periódica dos elementos.
Os isótopos são átomos de um mesmo elemento com mesmo número de
protões (podem ter quantidade diferente de neutrões).
Os isótonos são átomos que possuem o mesmo número de neutrões
Os isóbaros são átomos que possuem o mesmo número de massa
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
7
Explicações para Medicina – 2017 João, 3:16
Configurações eletrónicas dos elementos na tabela periódica.
A configuração electrónica de um átomo ou ião, é uma descrição da distribuição dos
seus electrões por nível de energia.
Níveis de energia ou camadas eletrónicas
A coroa ou electrosfera está dividida em 7 camadas designadas por K, L, M, N, O, P,
Q ou pelos números: n = 1, 2, 3, 4, 5, 6, 7. O número de camada é chamado Número
Quântico Principal (n).
Número máximo de electrões em cada nível de energia:
K L M N O P Q
2 8 18 32 32 18 2
Camada de valência, é a camada mais externa do átomo e pode conter no máximo 8
electrões.
Subcamadas ou níveis de energia
Uma camada ou nível de energia será subdividida nos subníveis:
s, p, d, f
Número máximo de electrões em cada subnível:
S P D f
2 6 10 14
Distribuição electrónica nos subníveis (configuração electrónica)
Os subníveis são preenchidos em ordem crescente de energia (ordem energética).
Linus Pauling descobriu que a energia dos subníveis cresce na ordem: 1s 2s 2p 3s 3p
4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
É nessa ordem que os subníveis são preenchidos. Para obter essa ordem basta seguir
as diagonais no diagrama de Pauling abaixo:
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
8
Explicações para Medicina – 2017 João, 3:16
Ordem geométrica, é a ordenação crescente de níveis energéticos.
Exemplo: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p…
Camada de Valência, é o último nível de uma distribuição eletrônica, normalmente os
electrões pertencentes à camada de valência, são os que participam de alguma
ligação química.
Exemplo: Arsênio (As): Z = 33
- Ordem energética (ordem de preenchimento): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
- Ordem geométrica (ordem de camada): 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Camadas Energéticas: K = 2; L = 8; M = 18; N = 5 A camada de valência do As é a
camada N, pois é o último nível que contém electrões.
Números quânticos
Os números quânticos são números que servem para descrer o estado de um electrão
no átomo.
Existem quatro números quânticos:
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
9
Explicações para Medicina – 2017 João, 3:16
1º, Número quântico principal (n) – indica a camada ou o nível de energia onde está
localizado o electrão. São conhecidas 7 camadas designadas pelos valores de 1 a 7
ou pelas letras de K a Q.
Exemplo: K, L, M, N, O, P, Q
N = 1, 2, 3, 4, 5, 6, 7
2º, Número quântico secundário ou azimutal (l) – indica o subnível de energia do
electrão e a forma da orbital. Os valores do numero quântico secundário dependem
dos valores do numero quântico principal e vão desde (0) até (n -1). São conhecidos 4
subníveis designados pelas letras minúsculas s, p, d, f.
Exemplo:
n = 1 quantos subníveis existem neste nível? R: Para n = 1, l = n -1, l = 1 – 1, l = 0,
o que quer dizer que o primeiro nível tem apenas um subnível chamado s, que
corresponde ao valor zero (0) e uma orbital, também chamada s.
Exemplo:
Para n = 1, l = 1 – 1 = 0 [s]
Para n = 2, l = 2 – 1 = 1 [s,p]
Para n = 3, l = 3 – 1 = 2 [s, p,d]
Para n = 4, l = 4 – 1 = 3 [s, p, d, f]
Para n = 5, l = 5 – 1 = 4 [s, p, d, f]
Do quarto nível adiante se encontram todos subníveis.
3º, Número quântico magnético (m) – indica o número de orbitais existentes em cada
subnível de energia. Os valores do numero quântico magnético dependem dos valores
do numero quântico secundário e vão desde –l até +l, passando pelo valor zero (0).
Subnível Valor de l Valor de (m) Nº de orbitais
S 0 0 1 orbital s
P 1 -1, 0, +1 3 orbitais p
D 2 -2, -1, 0, +1, +2 5 orbitais d
F 3 -3, -2, -1, 0, +1, +2, +3 7 orbitais f
Para determinar o número de orbitais para cada subnível usa-se a fórmula:
m = 2l + 1
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
10
Explicações para Medicina – 2017 João, 3:16
4º, Número quântico spin – determina o movimento de rotação do próprio electrão. Um
electrão pode ter dois tipos de spin:
s = + ½ ou ꜛ
s = - ½ ou ꜜ
Ver em anexos
Modelo da nuvem electrónica.
Níveis e subníveis de energia.
Princípio de exclusão de Pauli.
Preenchimento dos orbitais. Regra de Hund.
Configuração electrónica pela notação nlx.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
11
Explicações para Medicina – 2017 João, 3:16
Ligação química
A Ligação Química é a união entre átomos, ou de outra maneira, os enlaces ou
interações químicas constituem as forças interatómicas que permitem a formação de
moléculas e podem ser iónicas ou covalentes.
A ligação covalente caracteriza-se por haver partilha de electrões e pode ser polar ou
apolar.
A ligação iónica produz-se entre átomos de elementos metálicos e elementos não
metálicos por meio da transferência de electrões, ou seja, um átomo de metal perde
electrões e o outro átomo (não metálico) ganha electrões.
Toda substância que contém ligação iónica denomina-se substância iónica. Ex: NaCl
Polaridade da ligação covalente
A principal característica da ligação covalente é a partilha de electrões que forma o par
eletrónico da ligação.
Quando a ligação se realiza entre átomos de diferente Electronegatividade, o átomo
mais electronegativo atrai mais fortemente os electrões da ligação, e isso faz com que
a zona onde se encontra o átomo de maior Electronegatividade seja a zona negativa e
a zona onde se encontra o átomo com menor Electronegatividade seja a zona positiva.
A ligação covalente entre dois átomos diferentes denomina-se ligação covalente polar.
As moléculas resultantes desta ligação chamam-se moléculas polares. Ex: ácido
clorídrico (HCl).
Quando se unem átomos de igual eletronegatividade, a densidade eléctrica fica
uniformemente distribuída pelos átomos que formam a ligação e denomina-se ligação
covalente apolar.
As moléculas resultantes desta ligação chamam-se moléculas apolares. Ex: H2; O2; Cl2;
Ligação Intermolecular
Estas ligações servem para manter as estruturas das biomoléculas e dos compostos
orgânicos. Classificam-se em débeis (fracas) e fortes.
Débeis ou fracas:
Pontes de hidrogénio
Interações hidrofóbicas.
Interações eletrostáticas.
Forças de Van der Waals.
Interações eletrovalentes ou salinas.
Fortes:
Ligação covalente (polar ou apolar).
Ligação iónica.
Ligação metálica.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
12
Explicações para Medicina – 2017 João, 3:16
Na formação das biomoléculas são muito importantes as ligações ou
interações débeis ou fracas.
Ver anexo
Ligações químicas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
13
Explicações para Medicina – 2017 João, 3:16
A classificação periódica
Dentro da tabela periódica, os elementos químicos também podem ser classificados
em conjuntos, chamados de séries químicas, de acordo com sua configuração
eletrônica:
Elementos Representativos: pertencentes aos grupos 1, 2 e dos grupos de 13
a 17.
Elementos ou Metais de Transição: pertencentes aos grupos de 3 a 12.
Elementos ou Metais de transição Interna: pertencentes às séries dos
lantanídeos e dos actinídeos.
Gases nobres: pertencentes ao grupo 18.
Além disso, podem ser classificados de acordo com suas propriedades físicas nos
grupos a seguir:
Metais;
Semimetais ou metaloides (termo não mais usado pela IUPAC: os elementos
desse grupo distribuíram-se entre os metais e os ametais);
Ametais (ou não-metais);
Gases nobres;
Hidrogênio.
Propriedades periódicas dos elementos
São características ou tendências químicas que certos elementos químicos podem
revelar segundo a sua posição na tabela periódica e ocorrem a medida que o número
atómico de um elemento químico aumenta, ou seja, assume valores que crescem e
decrescem em cada período da tabela periódica. São propriedades que se repetem de
período em período.
As principais propriedades periódicas são as seguintes:
Raio atómico.
Energia de ionização.
Afinidade electrónica.
Electronegatividade.
Electropositividade.
Densidade.
Ponto de fusão.
Volume atómico.
Energia de ionização: também chamada de Potencial de Ionização, é a energia
mínima necessária para remover um electrão de um átomo no seu estado fundamental
(gasoso e isolado).
Variação periódica da energia de ionização (I)
No grupo, a energia de ionização diminui com o aumento do número atómico.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
14
Explicações para Medicina – 2017 João, 3:16
No período, a energia de ionização aumenta com o aumento do número
atómico.
Afinidade electrónica (A): é a capacidade do átomo para aceitar um ou mais electrões.
Variação periódica da afinidade electrónica
No grupo, de cima para baixo, a afinidade electrónica diminui com o aumento
do número atómico.
No período, da esquerda para a direita, a afinidade electrónica aumenta com o
aumento do número atómico.
Electronegatividade: é a tendência que um átomo possui de atrair electrões de outros
átomos.
Variação periódica da Electronegatividade
No grupo, a Electronegatividade diminui a medida que o número atómico
aumenta.
No período, a Electronegatividade aumenta da esquerda para a direita com o
aumento do número atómico.
Ver anexo
Periodicidade de algumas propriedades periódicas (tamanho dos átomos e dos iões,
energia de ionização, afinidade electrónica, carácter metálico).
Caracerísticas electrónicas e posição dos elementos na tabela periódica.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
15
Explicações para Medicina – 2017 João, 3:16
Fórmulas químicas, funções inorgânicas
A Química inorgânica ou Química Mineral, é o ramo da química que estuda os
elementos químicos e as substâncias da natureza que não possuem o carbono
coordenados em cadeias, investigando as suas estruturas, propriedades e a
explicação do mecanismo de suas reações e transformações. Os materiais
inorgânicos compreendem cerca de 95% das substâncias existentes no planeta Terra.
Fórmulas químicas – funções inorgânicas
Em química, o grupo de algumas substâncias compostas que possuem propriedades
químicas semelhantes, denominadas propriedades funcionais, recebe o nome de
função química. Quando um determinado composto possui características como
acidez ou basicidade, solubilidade em água, reatividade de acordo com determinada
função química, diz-se que este pertence a esta função química.
As chamadas "substâncias inorgânicas" que servem de foco de estudo para a química
inorgânica, são divididas em 4 grupos denominados como "funções inorgânicas". São
eles:
Ácidos.
Bases ou hidróxidos.
Sais.
Óxidos.
O critério de classificação dessas funções é o tipo de iões que se formam quando ela
é dissolvida em água.
Em função da natureza dos compostos químicos, as funções podem primariamente
ser divididas entre funções inorgânicas, que são as funções de compostos que não
possuem cadeia carbônica, que é a principal característica desses compostos, e que
são divididas em ácidos, bases, sais e óxidos e funções orgânicas que são as relativas
aos compostos orgânicos.
Ácidos
Segundo Arrhenius, ácido é toda a substância que libera um ião H+ em água, ou, são
todas substâncias que em um meio aquoso se dissociam, liberando o catião H+ e um
anião diferente de OH+. A teoria atual de Brønsted-Lowry define como ácido uma
substância capaz de receber um par de electrões. Além disso, a teoria de Arrhenius
também foi atualizada:
“Ácido é toda a substância que libera um ião H3O+.”
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
16
Explicações para Medicina – 2017 João, 3:16
Classificação dos ácidos
a) De acordo com a presença de oxigênio:
1. Hidrácidos: não possuem oxigênio na fórmula.
o Exemplos: HI, HCl, HF.
1. Oxiácidos: possuem oxigênio na fórmula.
o Exemplos: H2CO3, H2SO3, H2SO4, HNO2.
b) De acordo com o grau de dissociação iônica:
1. Hidrácidos:
o Fortes: HCl < HBr < HI
o Médios: HF (pode ser considerado fraco)
o Fracos: os demais
1. Oxiácidos:
o Fortes: se x > 1 (H2SO4)
o Médios: se x = 1 (HClO2)
o Fracos: se x < 1 (HClO)
x = número de oxigênio - número de hidrogênio
Nomenclatura dos ácidos
a) Hidrácidos
ácido + elemento + ídrico
Exemplos:
HI = ácido iodídrico
HCl = ácido clorhídrico
H2S = ácido sulfídrico
b) Oxiácidos
Exemplos:
HClO = ácido hipocloroso
HClO2 = ácido cloroso
HClO3 = ácido clórico
HClO4 = ácido perclórico
Bases ou hidróxidos
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
17
Explicações para Medicina – 2017 João, 3:16
Bases são, segundo Arrhenius, compostos que em um meio aquoso se dissociam,
liberando como anião OH- e um catião diferente de H+. A teoria atual de Lewis define
como base uma substância capaz de doar um par de electrões.
Classificação das bases
a) De acordo com o grau de dissociação
Fortes: é o caso dos hidróxidos dos metais alcalinos e dos metais alcalinos
terrosos.
Fracas: é o caso do hidróxido de amônio e dos hidróxidos dos metais em geral
excluídos os metais alcalinos e alcalinos terrosos.
Nomenclatura das bases
a) Primeiro:
hidróxido de + catião
Exemplo:
KOH = Hidróxido de Potássio
b) Segundo:
hidróxido de + catião + sufixo OU hidróxido + catião + nox em algarismo
romano
Exemplos:
Fe(OH)2 = hidróxido de ferro II ou hidróxido ferroso
Fe(OH)3 = hidróxido de ferro III ou hidróxido férrico
Sais
Sais são compostos que em meio aquoso se dissociam, liberando pelo menos um
catião diferente de H+ e pelo menos um anião diferente de OH -. São definidos,
também, como compostos binários resultante da reação de um ácido e uma base.
Classificação dos sais
a) De acordo com a presença de oxigênio
1. Sais haloides: não possuem oxigênio.
o Exemplos: NaI, KBr
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
18
Explicações para Medicina – 2017 João, 3:16
1. Oxissais: possuem oxigênio
o Exemplos: CaCO3, MgSO4
b) De acordo com a presença de H+ ou OH-
1. Sal normal: é formado pela neutralização completa entre um ácido e uma base.
Não possui nem H+ nem OH-
o Exemplo: HCl + NaOH ͢ NaCl + H2O
2. Hidrogenossal ou hidroxissal: é formado numa reação de neutralização quando
o ácido e a base não estão em proporção estequiométrica. Sendo assim, há
uma neutralização parcial, sobrando H+ ou OH-
o Exemplo (hidrogenossal):
H2CO3 + NaOH ͢ NaHCO3 + H2O
o Exemplo (hidroxissal):
Mg(OH)2 + HCl + ͢ Mg(OH)Cl + H2O
3. Sal misto: o sal apresenta em sua fórmula mais de um catião ou mais de um
anião diferentes. É formado a partir da neutralização de um ácido por mais de
uma base ou de uma base por mais de um ácido.
o Exemplo:
Al(OH)3 + HCl + H2SO4 ͢ AlClSO4 + 3H2O
Nomenclatura dos sais
a) Para sais haloides
metal + eto de catião
Exemplo:
NaCl = cloreto de sódio
b) Para oxissais
Exemplos:
KNO2 = nitrito de potássio
NaClO = hipoclorito de sódio
KMnO4 = permanganato de potássio
Obs: quando na fórmula do sal há um hidrogênio, acrescentamos o prefixo "bi" ao
nome do catião.
NaHCO3 = bicarbonato de sódio
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
19
Explicações para Medicina – 2017 João, 3:16
Óxidos
Óxidos são compostos binários em que o elemento oxigênio apresenta número de
oxidação igual a -2 e é o mais eletronegativo da fórmula tornando-o o mais potente
elemento.
As propriedades de um óxido dependem das características esperticunstulares do
elemento formador.
Classificação dos óxidos
Classificação Exemplos
Básicos CaO, FeO, K2O
Ácidos ou anidridos SO3, Cl2O, MnO7
Neutros NO, CO, N2O
Anfóteros Al2O3, MnO2, ZnO, PbO,
SnO
Salinos, mistos ou duplos Pb3O4, Fe3O3
Os óxidos anfóteros se comportam como óxidos básicos na presença de
ácidos e como óxidos ácidos na presença de bases.
Nomenclatura dos óxidos
Para qualquer óxido
prefixo + óxido de + prefixo + elemento
Exemplos:
Fe3O4 = tetróxido de triferro de ferro
N2O3 = trióxido de nitrogênio
Para outros óxidos
óxido de + elemento
Exemplos:
Na2O - óxido de sódio
Al2O3 - óxido de alumínio
Para outros óxidos ainda
FeO = óxido ferroso ou óxido de ferro II
Fe2O3 = óxido férrico ou óxido de ferro III
Para óxidos ácidos (ou anidridos)
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
20
Explicações para Medicina – 2017 João, 3:16
anidrido + prefixo + elemento + sufixo
CO2 = anidrido carbônico
Mn2O7 = anidrido permangânico
Nomenclatura dos peróxidos
peróxido de + elemento
Exemplos:
H2O2 = peróxido de hidrogênio
K2O2 = peróxido de potássio
Nomenclatura dos superóxidos
superóxido de + elemento
Exemplo:
NaOH2 = superóxido de sódio
Ver anexo
Funções inorgânicas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
21
Explicações para Medicina – 2017 João, 3:16
Reações químicas e concentração das soluções
Reversibilidade das transformações físicas e químicas
1. A reação dá-se gastando totalmente os reagentes, isto é, ocorre uma
conversão total deste em produto. Diz-se então que a reação é completa ou
irreversível.
Exemplo: a combustão do gás natural.
CH4 + 2 O2 CO 2 + 2 H2O
2. Os reagentes não se convertem totalmente em produtos. As concentrações
dos reagentes diminui a medida que a reação progride até que decorrido um
certo tempo atinge um valor em que deste adiante se mantem constante. Neste
caso a reação é incompleta ou reversível.
Exemplo: a sublimação do iodo e a vaporização da água.
H2 + I 2 2 HI
Noção de sistema
Ao fazer o estudo de qualquer transformação química ou física, concentração a nossa
atenção sobre uma parte do universo a que chamamos sistema.
Os sistemas classificam-se usualmente como: abertos, fechados e isolados.
Um sistema aberto é aquele em que há troca de matéria e energia entre o sistema e o
meio. Exemplo: o caso da chama de um bico de bunsem.
Um sistema fechado é um sistema que não cede matéria ao meio exterior, apenas há
troca de energia com o meio. Exemplo: é o caso da sublimação do iodo (I) em
recipiente fechado. Os reagentes e os produtos de uma reação que ocorra num
recipiente fechado, constituem um sistema fechado.
Num sistema isolado, não há troca de matéria nem energia com o meio exterior.
Exemplo: uma garrafa térmica pode constituir uma aproximação de um sistema
isolado. Como o isolamento nunca é 100% perfeito, é fácil prever que não existem
sistemas rigorosamente isolados, no entanto, alguns podem ser concebidos como tal,
dentro de razoáveis aproximações.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
22
Explicações para Medicina – 2017 João, 3:16
Os sistemas físicos e químicos classificam-se como: homogéneos e heterogéneos.
Um sistema diz-se homogéneo quando é constituído por uma única fase. É o caso do
ar ou de uma solução aquosa de cloreto de sódio NaCl.
Se o sistema é constituído por duas ou mais fases diz-se heterogéneo. Exemplo: a
mistura do azeite e água (duas fases liquidas). A água e o metal (uma fase líquida e
uma fase sólida).
Fase – é uma porção de matéria homogénea e fisicamente distinta com limites bem
definidos.
Note-se que a fase não é sinonimo de estado físico ou de agregação.
A mistura de azeite e água é um sistema constituído por duas fazes distintas, ambos
com o mesmo estado físico, líquido.
Sistema químico em equilíbrio
Um sistema está em equilíbrio quando:
Não há troca de matéria nem de energia com o meio exterior.
As propriedades macroscópicas mensuráveis do sistema (cor, concentração,
pressão, volume, temperatura e outros) não variam com o tempo.
Formas de expressar as concentrações das soluções
Dissolução: é um fenómeno físico que ocorre quando se mistura um soluto com o
solvente.
Exemplo: a água e o açúcar.
H2O + C12H22O11
As formas de expressar a concentração das soluções são:
Concentração em percentagem
É a concentração de uma solução expressa em gramas de soluto presente em 100g
de solução.
Fórmula
P B
=
p 100 %
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
23
Explicações para Medicina – 2017 João, 3:16
Onde:
P: massa do soluto (ms).
p: concentração do soluto.
B: massa da solução.
md: massa do solvente.
B = ms + md
Exercício
Quantos gramas de cloreto de sódio (NaCl) serão necessários para preparar 500g de
solução a 10%?
Dados
B = 500g
p = 10%
P=?
RESOLVER
Concentração molar ou molaridade (M)
A molaridade de uma solução é a razão entre o número de moles do soluto e o volume
da solução.
Fórmula
mA
M=
PM x V
M = concentração molar ou molaridade.
PM = massa molecular ou peso molecular.
mA = massa do soluto.
n = número de moles.
V = volume da solução.
Exercício
Calcular a concentração molar de uma solução que contém dissolvidos 68,4g de
açúcar (C12H22O4) em 800 ml.
Dados
mA = 68,4g
V = 800 ml
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
24
Explicações para Medicina – 2017 João, 3:16
PM = 342g/mol
RESOLVER
Concentração normal ou normalidade (N)
A normalidade de uma solução é a razão entre o número de equivalente grama (nº eq
– gr) do soluto dissolvido num volume de solução.
Fórmula
mA x K
N=
PM x V
Onde:
N = normalidade ou concentração normal.
nº equivalente – grama = eq – gr.
K = constante de dissociação eletrolítica.
Exercício
Qual é a concentração normal de uma solução que contém dissolvidos 39,6 kg de
ácido carbónico (H2CO3) em 100 ml da solução?
Dados
mA = 39,6 Kg
V = 100 ml
PM = 62 g/mol
K=2
RESOLVER
Concentração molal ou molalidade (m)
A molalidade de uma solução é a razão entre o número de moles do soluto dissolvido
em 1000 gramas da solução.
Fórmula
m
m=
PM x 1000 g
Exercício
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
25
Explicações para Medicina – 2017 João, 3:16
Determinar a molalidade de uma solução que contem 15,8g de brometo de magnésio
(MgBr2).
Dados
m = 15,8 g
PM = 184 g/mol
m=?
RESOLVER
Concentração simples (C)
É a razão entre a massa do soluto dissolvido no volume de solução.
Fórmula
mA
C=
V
Exercício
Determinar a concentração de uma solução em que se dissolvem 5g de açúcar em 20
ml de solução.
Dados
mA = 5g
V = 25 ml
RESOLVER
Soluções
Solução é qualquer mistura homogénea formada por uma ou várias substâncias.
Tipos de soluções
Solução liquida – refrigerante.
Solução solida – cobre + estanho = bronze.
Solução gasosa – ar atmosférico.
Componentes de uma solução
Soluto: é a substancia dissolvida no solvente (substancia dispersa).
Solvente: é a substancia que dissolve o soluto (substancia dispersante).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
26
Explicações para Medicina – 2017 João, 3:16
Classificação das soluções
Quanto ao estado físico: solidas, líquidas e gasosas.
Quanto a condutibilidade eléctrica: eletrolíticas e não eletrolíticas.
Quanto a proporção soluto/solvente: diluída, concentrada, não saturada,
saturada e supersaturada.
Solução concentrada: quando o soluto se encontra na quantidade máxima que o
solvente pode diluir.
Coeficiente de solubilidade: é a máxima quantidade de soluto que um solvente pode
dissolver.
Solução diluída ou insaturada: quando a quantidade de soluto é inferior ao coeficiente
de solubilidade.
Solução saturada: quando o solvente já dissolveu toda quantidade possível de soluto e
qualquer soluto adicionado já não será dissolvido.
Solução supersaturada: quando o soluto está em maior proporção que o solvente, e
depois a solução é resfriada ou aquecida para reduzir o coeficiente de solubilidade.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
27
Explicações para Medicina – 2017 João, 3:16
Equação química
Reação química: é a modificação sofrida por uma ou várias substâncias dando lugar a
outra ou outras substâncias com propriedades diferentes.
Exemplo: H2 + O2 2 H2O
Numa reação química, há transformação das substâncias e conservação dos
elementos químicos.
Equação química: é a representação gráfica de uma reação química através de
símbolos e formulas.
Os elementos que causam a reação química chamam-se reagentes; o resultado da
reação química chama-se produto. Os reagentes representam-se a esquerda e os
produtos a direita.
Uma reação química apresenta dois aspectos: o microscópico e o macroscópico.
Estequiometria: é a parte da química que trata dos cálculos numéricos aplicados as
reações químicas.
Numa reação química, o número de átomos de reagentes e dos produtos deve ser
sempre igual. Isto de acordo com a Lei de Lavoisier. Esta igualdade é obtida
escrevendo em frente das fórmulas números chamados coeficientes.
Tipos de reações químicas
Reações de síntese, composição ou adição.
A+B AB
Reações de análise ou de decomposição.
AB A+B
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
28
Explicações para Medicina – 2017 João, 3:16
Reações de simples troca ou deslocamento.
AB + C AC + B
Reações de dupla troca.
AB + CD AC + CB
Acerto de uma equação
N2O5 NO2 + O2
C3H8 + O2 CO 2 + H2O
N2 + H 2 NH 3
HBr2 + O2 H 2O + BrO2
NO2 + H2O HNO 3 + NO
RESOLVER
Ver anexo
Apresentação das equações químicas.
Estado físico.
Tipos de equações: forma molecular e forma iónica.
Acerto de equações químicas. Lei de Lavoisier.
Cálculos baseados nas equações químicas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
29
Explicações para Medicina – 2017 João, 3:16
Equilíbrio químico
É a situação em que a proporção entre as quantidades de reagentes e produtos em
uma reação química se mantem constante ao longo do tempo.
Princípio de Le Chatelier
“Quando um sistema em equilíbrio é sujeito a uma perturbação (tal como um alteração
de temperatura, pressão ou concentração), o equilíbrio desloca-se no sentido que
contraria esta alteração até que se estabeleça um novo equilíbrio.”
Assim:
Se se aumentar a concentração de um reagente de um sistema em equilíbrio,
este reage no sentido em que se contraria este aumento, ou seja, no sentido
em que se consome este reagente.
Aumentando a temperatura de um sistema em equilíbrio, este reage de modo a
contrariar esta alteração, isto é, no sentido em que há absorção de calor. A
reação endotérmica é então favorecida até que novo equilíbrio seja atingido.
Aumentando a pressão de um sistema gasoso em equilíbrio, este evolui no
sentido em que se diminui a pressão, isto é, no sentido em que se forma
menos número de moles.
Ver anexo
Factores que afectam o estado de equilíbrio de um sistema (efeito da alteração da
concentração, efeito da temperatura, princípio de Le Chatelier).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
30
Explicações para Medicina – 2017 João, 3:16
Cinética das reacções
Aqui veremos apenas a matéria em anexo.
Ver anexo
Avaliação da rapidez de uma reação química.
Factores que influenciam a velocidade de uma reação: concentração dos reagentes,
temperatura e catalisadores.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
31
Explicações para Medicina – 2017 João, 3:16
Reacções ácido-base
Uma reação ácido-base é uma reação química que ocorre entre um ácido e uma base.
pH
pH, é o símbolo para a grandeza físico-química potencial hidrogeniônico ou potencial
de hidrogénio, que indica a acidez, neutralidade ou alcalinidade de uma solução
aquosa.
O termo pH foi introduzido, em 1909, pelo bioquímico dinamarquês Søren Peter
Lauritz Sørensen (1868-1939) com o objetivo de facilitar seus trabalhos no controle de
qualidade de cervejas.
Às vezes é referido do latim pondus hydrogenii. O "p" equivale ao simétrico do
logaritmo de base 10 da actividade dos iões a que se refere, ou seja:
pH = - log10 [H+]
em que [H+] representa a concentração de iões H+ expressa em mol/dm3.
Escala de pH e sua relação com a acidez e basicidade de uma solução.
A escala de pH é uma maneira de indicar a concentração de H+ numa solução.
Esta escala varia entre o valor mínimo 0 (acidez máxima), e o máximo 14 (acidez
mínima ou basicidade máxima).
A 25 °C uma solução neutra tem um valor de pH = 7.
É uma escala de valores que serve para determinar o grau de acidez ou de basicidade
de uma dada substância. Varia entre 0 e 14, sendo o valor médio, o sete,
correspondente a soluções neutras. Para valores superiores a 7 as soluções são
consideradas básicas, e para valores inferiores a 7, serão ácidas.
O pH pode ser determinado usando um medidor de pH (também conhecido como
pHmetro) que consiste em um eletrodo acoplado a um potenciômetro. O medidor de
pH é um milivoltímetro com uma escala que converte o valor de potencial do eletrodo
em unidades de pH.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
32
Explicações para Medicina – 2017 João, 3:16
Valores comuns de pH
Ácido de bateria - <1,0
Suco gástrico – 1,0 – 3,0
Sumo de limão – 2,2 – 2,4
Refrigerante tipo cola – 2,5
Vinagre – 2,4 – 3,4
Cervejas – 4,0 – 5,0
Café – 5,0
Chá – 5,5
Chuva ácida - <5,6
Leite – 6,3 – 6,6
Água pura – 7,0
Saliva humana – 6,5 - 7,5
Sangue humano – 7,35 – 7,45
Água do mar – 8,0
Espécies anfotéricas ou anfitrópicas
São substâncias como a água e o hidrogenossulfureto, que podem funcionar ora como
ácidos ora como bases, conforme as condições.
Assim, a água quando reage com HCl ou ácido acético, CH 3COOH, comporta-se como
base, porque as moléculas destes têm maior tendência a ceder H +; e quando reage
com amoníaco, NH3, funciona como ácido, porque é a água que tem agora maior
tendência para ceder H+.
Ver anexo
Ácidos em uma solução aquosa.
pH de uma solução. Relaºão com a concentração de iões H+.
Dissociação completa e incompleta. Força dos ácidos.
Caracterização qualitativa do equilíbrio ácido-base.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
33
Explicações para Medicina – 2017 João, 3:16
Termoquímica
A termoquímica, também chamada de termodinâmica química, é o ramo da química
que estuda o calor (energia) envolvido, seja absorvido, seja produzido, nas reações
químicas e quaisquer transformações físicas, tais como a fusão e a ebulição,
baseando-se em princípios da termodinâmica.
Entalpia
Entalpia é a quantidade de energia em uma determinada reação, podemos calcular o
calor de um sistema através da variação de entalpia (∆H).
A variação da Entalpia está na diferença entre a entalpia dos produtos e a dos
reagentes, sendo assim, o calor de uma reação corresponde ao calor liberado ou
absorvido em uma reação, e é simbolizado por ∆ H, veja como se calcula: Δ Htotal = ΔH
final – ΔH inicial
Reações térmicas
Reação exotérmica: é aquela em que há liberação de calor (energia). A energia final
dos produtos é menor que a energia inicial dos reagentes.
Reagentes → Produtos + calor liberado
[Entalpia dos produtos] < [Entalpia dos reagentes] ΔH < 0
Reação endotérmica: é aquela que absorve calor (energia). A energia final dos
produtos é maior que a energia inicial dos reagentes.
Reagentes + calor → produtos
Reagentes absorvem calor para formar os produtos mais energéticos.
2 H2 + O2 ↔ 2 H2O
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
34
Explicações para Medicina – 2017 João, 3:16
A reação que tem como produto H2O é exotérmica, pois libera calor. Já o contrário é
endotérmica, porque necessita de calor para ter seus produtos.
Reação isotérmica: não libera nem absorve energia. A energia é igual a soma dos
reagentes.
Ver anexo
Cálculos de entalpias.
Lei de Hess.
Electroquímica
Uma reação de oxidação – redução é uma reação em que ocorre transferência de
electrões.
Oxidante é a espécie química que, numa reação química, capta electrões, isto é, é
reduzida, provocando a oxidação da outra espécie. O oxidante é o aceitador de
electrões.
Redutor é a espécie química que, numa reação química, cede electrões, isto é, é
oxidada, provocando a redução da outra espécie química. O redutor é o dador de
electrões.
Exemplo 1
A semi – equação de oxidação é:
A semi – equação de redução é:
O é a espécie que dá electrões, é o redutor, electrões esses que são aceites
pela espécie , que é o oxidante, é a espécie que se reduz.
Os pares redox conjugados são e .
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
35
Explicações para Medicina – 2017 João, 3:16
As reações de redução-oxidação ou oxirredução (também conhecido como reação
redox) são as reações de transferência de electrões. Esta transferência se produz
entre um conjunto de espécies químicas, um oxidante e um redutor (uma forma
reduzida e uma forma oxidada respectivamente).
Para que exista uma reação redox, no sistema deve haver uma espécie que ceda
electrões e outra espécie que as aceite:
O Redutor é aquela espécie química que tende a ceder electrões.
O Oxidante é a espécie que tende a captar esses electrões.
O acerto das equações de oxidação-redução em meio aquoso depende do estado do
meio (ácido ou básico) e é feito da seguinte forma:
1. Escrever a equação não acertada da reacção na forma iónica.
2. Separar a equação em duas semi-reacções.
3. Acertar todos os átomos, à excepção de O e H, separadamente, em cada
semi-reacção.
4. Para reacção em meio ácido, acrescentar H2O para acertar os átomos de
oxigénio e H+ para acertar os átomos de hidrogénio. Se a reacção se der em
meio básico, usa-se H2O para acertar os átomos de hidrogénio e HO- para
acertar os de oxigénio.
5. Adicionar electrões a um dos lados de cada semi-reacção para acertar as
cargas.
6. Se necessário, igualar o número de electrões envolvidos em cada semi-
reacção, multiplicando os coeficientes estequiométricos por um valor
apropriado.
7. Somar as duas semi-reacções. Os electrões envolvidos em cada uma delas
devem-se anular no final.
Exemplo de Acerto de Equações Redox
Considerando a reação de oxidação-redução em meio ácido, acerte a equação:
SO32- + MnO4- → SO42- + Mn2+
Resolução:
1. Escrita das semi-reacções de oxidação e de redução:
Semi-reacção de redução: MnO4- → Mn2+
Semi-reacção de
SO32- → SO42-
oxidação:
2. Os elementos que alteram o seu estado de oxidação, o Mn e o S, estão certos
logo, neste passo, não há acertos a fazer às equações.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
36
Explicações para Medicina – 2017 João, 3:16
3. Acerta-se o oxigénio somando moléculas de água no lado da equação onde
houver falta de oxigénios e, tendo em conta que o meio onde a reação ocorre é
ácido, acertam-se os hidrogénios adicionando H+:
Semi-reacção de (acerto dos átomos de
MnO4- → Mn2+ + 4H2O
redução: oxigénio)
MnO4- + 8H+ → Mn2+ + (acerto dos átomos de
4H2O hidrogénio)
Semi-reacção de (acerto dos átomos de
SO32- + H2O → SO42-
oxidação: oxigénio)
(acerto dos átomos de
SO32- + H2O → SO42- + 2H+
hidrogénio)
4. Procede-se ao acerto das cargas das semi-reacções, adicionando electrões
onde houver excesso de cargas positivas:
Semi-reacção de redução: MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
Semi-reacção de
SO32- + H2O → SO42- + 2H+ + 2e-
oxidação:
5. Nesta etapa é necessário encontrar um factor multiplicativo de forma a que
ambas equações envolvam o mesmo número de electrões:
Semi-reacção de redução: (MnO4- + 8H+ + 5e- → Mn2+ + 4H2O ) × 2
Semi-reacção de
(SO32- + H2O → SO42- + 2H+ + 2e-) × 5
oxidação:
6. Por fim através da soma das duas equações obtém-se a equação global:
5SO32- + 2MnO4- + 6H+ → 5SO42- + 2Mn2+ + 3H2O
Ver anexo
Reacções redox (conceito, oxidação redução, acerto de equações redox).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
37
Explicações para Medicina – 2017 João, 3:16
Química orgânica
A isomeria
Isómeros são os compostos que possuem a mesma fórmula global, mas apresentam
propriedades distintas. A isomeria se deve a que a distribuição dos átomos e o tipo de
ligação que se estabelece determina as propriedades das moléculas e estas não
podem inferir-se de sua fórmula global; os isómeros se diferenciam em sua estrutura
ou em sua configuração, ou ambas características, é por isso que a isomeria se
classifica em estrutural ou plana e a espacial ou estereoisomeria.
Isomeria estrutural
Se deve a diferenças na estrutura dos distintos isómeros e pode ser de três tipos: de
cadeia, de posição e de função.
Isomeria de cadeia
Este tipo de isomeria estrutural se deve a disposição distinta que podem adoptar os
átomos de carbono nas cadeias carbonadas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
38
Explicações para Medicina – 2017 João, 3:16
Isomeria de posição
Esta variante de isomeria estrutural se deve a existência de compostos cuja única
diferença consiste na posição que ocupa um determinado grupo funcional na cadeia.
Isomeria de função
São isómeros de função os que possuem grupos funcionais diferentes apesar de
apresentar uma mesma fórmula química. Um exemplo o constitui o álcool etílico e o
éter metílico, ambos com C2H6O como fórmula.
Isomeria espacial
Este tipo de isomeria a apresentam aqueles compostos que se diferenciam em sua
configuração espacial. Esta isomeria compreende dois grupos principais: isomeria
geométrica e isomeria Óptica.
Isomeria geométrica
Ocorre quando em uma molécula estão presentes duplas ligações ou anéis, os átomos
involucrados nestas estruturas têm certas restrições nos giros, a rotação dos átomos
de carbono está limitada e devido a isto a posição dos grupos substituintes unidos a
eles fica fixada no espaço, a um ou outro lado do anel ou dupla ligação. Desta maneira
o buteno-2 pode existir em duas configurações geométricas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
39
Explicações para Medicina – 2017 João, 3:16
Como pode apreciar-se, a disposição dos grupos substituintes unidos aos átomos de
carbono no isómero cis se dispõe para o mesmo lado da dupla ligação e para lados
distintos no isómero trans. Ambos tipos de isómeros se podem encontrar nas
biomoléculas.
Isomeria Óptica
A isomeria Óptica se apresenta nos compostos que possuem algum centro de
assimetria e se manifesta pela capacidade que têm estes isómeros de desviar o plano
de vibração da luz polarizada, para a direita ou para a esquerda. A actividade Óptica
se determina experimentalmente por meio de um equipamento conhecido como
polarímetro.
Nomenclatura dos radicais
Hidrocarboneto Prefixo de acordo com a quantidade de carbonos. Terminação
Alcano 1-Met, 2-Et, 3-Prop, 4-But, 5-Pent, 6-Hex, 7-Hept, ano
8-Oct, 9-Non, 10-Dec, 11-Undec, 12-Dodec, 13-
Alceno Tridec, 14-Tetradec, 15-Pentadec, 16-Hexadec, eno
Alcino 17-Heptadec, 18-Octadec, 19-Nonadec, 20-Icos, ino
21-Heneicos, 22-Docos, 23-Tricos, 30-Triacont, 31-
Hentriacont, 40-Tetracont, 50-Pentacont, 60-
Hexacont, 70-Heptacont, 80-Octacont, 90-
Nonacont, 100-Hect ...
Hidrocarbonetos
Hidrocarbonetos, são compostos orgânicos constituídos apenas por átomos de
carbono e hidrogénio.
Estes compostos devido tetravalência do carbono podem formar cadeias mais ou
menos complexas que são classificadas de acordo a natureza das ligações entre
átomos de carbono.
Quando existem ligações simples dizem-se saturadas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
40
Explicações para Medicina – 2017 João, 3:16
Quando existem ligações duplas e triplas entre átomos de carbono dizem-se
insaturadas.
Classificação dos hidrocarbonetos
Podem ser alifáticos, cíclicos e aromáticos.
Alcanos
Alifáticos Saturadas Alcenos
Insaturadas Alcinos
Hidrocarbonetos Cíclicos Cicloalcanos
Saturadas
Aromáticos Insaturadas Anéis benzénicos
Pelo facto de o carbono ser tetravalente, ou seja, ter valência 4, há a tendência dele
formar quatro ligações covalentes, e as 4 unidades de valência são iguais entre si.
Os seus átomos têm a facilidade de se ligar entre si ou com outros elementos
formando estruturas curtas ou longas com as mais variadas disposições denominadas
cadeias carbonadas ou carbónicas.
Classificação das cadeias carbonadas
As cadeias carbônicas são formadas pela ligação química entre átomos de carbono e
hidrogênio (os chamados hidrocarbonetos).
Classificação
Abertas, Acíclicas ou Alifáticas.
Fechadas, Cíclicas, Alicíclicas ou Aromáticas.
Mistas - apresentam carbonos livres em extremidades e também possuem
anel.
Cadeias Abertas ou Acíclicas
Aquelas em que os átomos de carbono ligam-se entre si formando as cadeias com
extremos livres
Subdividem-se
Quanto à natureza
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
41
Explicações para Medicina – 2017 João, 3:16
1. Homogêneas: quando só tem carbonos ligados entre si, não apresenta
heteroátomo na cadeia. (Heteroátomo será qualquer átomo diferente de
carbono e hidrogênio que esteja localizado entre átomos de carbono.)
1. Heterogêneas: Cadeias têm pelo menos um átomo diferente de carbono e
hidrogênio, localizado entre átomos de carbono (pelo menos um heteroátomo).
Quanto à Disposição
1. Normais (chamada também de "reta" ou linear): os carbonos da cadeia são
primários ou secundários.
2. Ramificadas: possui carbono terciário ou quaternário na cadeia (ramificações).
Quanto à Saturação
1. Saturadas: Cadeias com ligações simples entre carbonos.
2. Insaturadas: Cadeias com ligações duplas, triplas ou ambas, entre carbonos.
Cadeia carbônica Homogênea, Insaturada e normal:
que pode ser escrita assim:
Cadeia Carbônica Homogênea, Saturada e Ramificada:
Cadeias Cíclicas ou Fechadas
São aquelas em que os átomos de carbono se ligam formando um anel (ou um círculo
fechado), ou que fazem ciclos podendo ser geométricos (quadrado, triangulo) ou não.
Divisão
1. Alicíclicas:
Podem ter qualquer número de átomos de carbono na cadeia e não constituem
um anel benzénico.
2. Aromáticas:
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
42
Explicações para Medicina – 2017 João, 3:16
Possuem uma cadeia carbônica especial chamada de Anel Benzénico ou
Núcleo Benzénico; Anel Aromático ou Núcleo Aromático, formada por seis
átomos de carbono e seis átomos de hidrogênio em uma disposição especial
de ligações simples e duplas que se alternam. O principal composto se chama
Benzeno.
1 - As Alicíclicas subdividem-se em
Quanto a natureza
1. Homocíclicas: As cadeias carbônicas cíclicas possuem somente átomos de
carbono e hidrogénio.
2. Heterocíclicas: cadeias carbônicas possuem pelo menos um heteroátomo
(qualquer átomo diferente de carbono e hidrogênio que esteja localizado entre
átomos de carbono).
Quanto a saturação
1. Saturadas: As cadeias carbônicas possuem ligações simples.
2. Insaturadas: As cadeias carbônicas possuem ligações duplas, triplas ou
ambas.
Exemplo
2 - Aromáticas
1. Mononucleares: Cadeias carbônicas que possuem apenas um anel benzénico.
2. Polinucleares: Cadeias carbônicas que possuem mais de um anel benzénico.
Que podem se subdividir em :
Núcleos Isolados: Os anéis aromáticos na cadeia carbônica estão separados
distintamente.
Núcleos Condensados: Possuem outras cadeias carbônicas germinadas ou
condensadas ao anel aromático.
Exemplos
Núcleos Isolados:
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
43
Explicações para Medicina – 2017 João, 3:16
Núcleos Condensados:
Cadeias Carbônicas Mistas
Quando apresentam diferentes tipos de cadeias carbônicas.
Núcleos
Semi-condensados
Exemplos
Cadeias Carbônicas Mistas:
Nicotina Indol
As cadeias carbonadas de acordo com a localização do átomo de carbono podem ser:
primarias, secundarias, terciarias e quaternárias.
Primárias – quando o átomo de carbono se liga apenas a um outro átomo ce
carbono para além de outros átomos de carbono.
Secundarias – quando o átomo de carbono se liga a dois outros átomos de
carbono para além de outros átomos diferentes de carbono.
Terciarias – quando o átomo de carbono se liga a três átomos de carbono.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
44
Explicações para Medicina – 2017 João, 3:16
Quaternárias – quando se liga a quatro átomos de carbono.
Alcanos ou Parafinas
São hidrocarbonetos em cujas cadeias existem apenas ligações simples de carbono e
hidrogénio. São hidrocarbonetos saturados que possuem somente simples ligações
em sua formula estrutural.
São estáveis e pouco reactivos, daí o nome de parafinas, e têm o número maior de
átomos de hidrogénio ligado ao átomo de carbono.
Não é possível introduzir mais átomos neles, daí a designação de saturados.
Podem sofrer transformações por reações de substituição. A designação ano significa
que existem ligações simples entre os átomos de carbono na cadeia.
Série homóloga dos alcanos
O representante mais simples dos alcanos é o metano (CH4).
A família dos alcanos forma uma série homóloga que corresponde a fórmula geral
seguinte: CnH2n + 2.
Em que n representa o numero de átomos de carbono e é um numero inteiro.
Exemplo: se: n = 8
2n + 2
2x8 + 2 = 18 C 8H18
Fazer a fórmula estrutural.
Exemplos de alcanos
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
45
Explicações para Medicina – 2017 João, 3:16
Nº de C Hidrocarboneto Cadeia carbônica
1 Metano CH4
2 Etano CH3CH3
3 Propano CH3 CH2CH3
4 Butano CH3 CH2 CH2CH3
5 Pentano CH3 CH2 CH2 CH2CH3
6 Hexano CH3 CH2 CH2 CH2 CH2CH3
7 Heptano CH3 CH2 CH2 CH2 CH2 CH2CH3
8 Octano CH3 CH2 CH2 CH2 CH2 CH2 CH2CH3
9 Nonano CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2CH3
10 Decano CH3 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH2 CH3
No caso de cíclicos: Ciclo + prefixo + terminação
Exemplos de regras da nomenclatura de alcanos segundo as regras da IUPAC
2 – metilheptano
2,4 – dimetilpentano
3 – etil – 2,2 – dimetiloctano
Cicloalcanos
São hidrocarbonetos cíclicos, de cadeia fechada, cujo os átomos de carbono estão
ligados entre si e mais 2 hidrogênios.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
46
Explicações para Medicina – 2017 João, 3:16
Alcenos
Os alcenos são hidrocarbonetos etilénicos, apresentam cadeia aberta e ligação dupla
entre os átomos de carbono. São hidrocarbonetos insaturados que além das ligações
simples possuem também ligações duplas, os mais importantes alcenos são o eteno e
o propeno, e a produção mundial desses compostos supera os 20 milhões de
toneladas anuais.
É importante lembrar que todo alceno que possui 2 duplas ligações em seu esqueleto
carbônico é chamado de alcadieno.
Estes hidrocarbonetos apresentam a fórmula geral CnH2n, n ≥ 2.
Exemplo:
N Fórmula molecular Fórmula estrutural
2 C2H4 H2C = CH2
3 C3H6 CH3 – CH = CH2
4 C4H8 CH3 – CH = CH – CH3
5 C5H10 CH3 – CH = CH – CH2 – CH3
Nomenclatura dos alcenos Segundo as regras de IUPAC
A nomenclatura dos alcenos é semelhante a dos alcanos, bastando substituir a
terminação ano por eno. Deve-se para os alcenos com n > 4 indicar a posição do
átomo de carbono e a numeração deve começar no carbono mais próximo da dupla
ligação. Também deve-se indicar o número dos carbonos que contêm a ramificações.
Alcinos (alquinos)
São hidrocarbonetos etilénicos. São ácidos contendo uma única ligação tripla. Por
outras palavras, são hidrocarbonetos que apresentam cadeias abertas e insaturadas.
O mais simples dos alcinos é o etino conhecido como acetileno amplamente utilizado
na síntese de anticoncepcionais, antifúngicos e como gás de combustão em
maçaricos, é um gás altamente inflamável e com odor de alho.
Série homóloga
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
47
Explicações para Medicina – 2017 João, 3:16
A formula geral dos alcinos é C nH2n-2, onde n > 2; as suas moléculas contêm 4
hidrogénios a menos que os correspondentes alcanos e dois átomos a menos que os
alcenos.
Exemplo: CnH2n-2, se n = 2:
Fórmula molecular: C2H2.
Fórmula estrutural: H – C = C –H
Se n = 3 C3H4. H – C = C – CH3.
Se n = 4 C4H6. HC = C – CH2 – CH3.
Classificação dos alcinos
Alcinos verdadeiros ou terminais
Quando possuem hidrogénios ligados ao carbono da tripla ligação, ou seja, aqueles
que possuem e tripla ligação na extremidade da cadeia.
Exemplo: R – C = CH
Alcinos falsos ou não terminais
São os que não têm a tripla ligação terminal.
Exemplo: R – C = C – R'
Nomenclatura dos alcinos
Os alcinos mais simples são os únicos que têm o nome trivial.
Exemplo:
Acetileno: H – C = C – H, alcino mais simples.
Propileno: CH3 – C = CH
Os demais alcinos nomeiam-se pela nomenclatura racional e de IUPAC.
Nomenclatura dos alcinos segundo as regras de IUPAC
Segundo a IUPAC, a nomenclatura dos alcinos é semelhante a dos alcenos, bastando
trocar a terminação eno por ino.
Exemplo:
Etino: C2H2. Propino: C3H4.
Nos alcinos mais complexos a nomenclatura de IUPAC é feita de modo semelhante a
dos alcenos. Aqui, a cadeia principal é a que contém a tripla ligação, e a numeração é
feita a partir da extremidade mais próxima à tripla ligação.
O número que indica a posição da tripla ligação é colocado sempre no fim ou no
princípio do nome.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
48
Explicações para Medicina – 2017 João, 3:16
Hidrocarbonetos aromáticos
São cíclicos e insaturados, que possuem três duplas ligações alternadas no esqueleto
carbônico, cujo representante principal e mais simples é o benzeno. Esses
hidrocarbonetos são chamados de aromáticos em virtude de possuírem um odor
pronunciável. O benzeno é um produto químico muito utilizado, mas vem sendo
substituído por outros com devido a seu potencial cancerígeno.
São aqueles que possuem um ou mais anéis benzénicos (também chamados de anéis
aromáticos, núcleos benzénicos ou ainda núcleos aromáticos).
Existem muitos compostos que possuem nas suas moléculas a cadeia carbonada do
benzeno (anel benzénico). Como os primeiros destes compostos estudados
apresentavam um aroma característico, foram chamados de compostos aromáticos.
Extraídos do alcatrão ou fabricados sinteticamente pela indústria petroquímica, eles
são muito importantes como ponto de partida para a fabricação de corantes,
inseticidas, detergentes, explosivos, combustíveis, etc.
Os hidrocarbonetos aromáticos têm em geral nomes específicos, o mais simples é o
metilbenzeno. O benzeno também é conhecido por ciclohexatrieno – 1, 3, 5; que é a
estrutura fundamental de toda família aromática.
Exemplo:
C6H6 ou Benzeno, ou Ph.
Os hidrocarbonetos aromáticos que têm mais de um anel benzénico são os chamados
polinucleares, e também têm nomes especiais.
Exemplo:
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
49
Explicações para Medicina – 2017 João, 3:16
Fórmula molecular do benzeno: C6H6.
Nomenclatura dos hidrocarbonetos aromáticos segundo as regras da IUPAC
Os seus nomes são feitos com a palavra benzeno, precedida das ramificações; a
numeração do anel deve partir da ramificação mais simples e prosseguir no sentido
em que resultam os menores números possíveis.
Exemplos:
Um sistema antigo de nomenclatura sugere que a posição 1,2(o – orto), 1,3(m- meta e
1,4(p-para) acompanhada de xileno, é usada em função da adição de 2 grupos metila
ao anel benzênico origina isômeros (compostos idênticos só diferindo na posição dos
radicais).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
50
Explicações para Medicina – 2017 João, 3:16
A nomenclatura comum a todos os aromáticos é:
Número indicativo de posição dos radicais + nome dos radicais + benzeno
Para todos os hidrocarbonetos
É importante saber que toda vez que um mesmo radical apresentar-se mais de uma
vez na cadeia ele deverá ser acompanhado de di, tri, tetra, penta...etc. com os
respectivos números indicativos de posição. Exemplo:
2,3,4-trimetil- 6,7-octadieno
Funções orgânicas ou Grupos funcionais presentes nas biomoléculas
Nas biomoléculas se encontram diversos grupos funcionais.
Grupo hidroxilo/a
Os compostos que possuem este grupo se conhecem como álcoois. Estes se
classificam em primários, secundários ou terciários em dependência do tipo de átomo
de carbono ao qual se encontram unidos. Em forma abreviada se representam como
R-OH. Se nomeiam ao adicionar o sufixo ol ao nome do hidrocarboneto
correspondente. Um exemplo é o etanol.
O grupo hidroxilo pode reagir com diferentes compostos e formar diversas agrupações
derivadas. O grupo hidroxilo se encontra em vários tipos de biomoléculas, como em
açúcares e alguns aminoácidos.
Grupo carbonilo
A função carbonilo (CO) pode existir em duas formas: aldeído se esta função se
encontra em um carbono primário, e cetona se está em um carbono secundário.
Os aldeídos se nomeiam pela adição do sufixo al ao nome do hidrocarboneto
correspondente e se se trata de uma cetona se adiciona o sufixo ona.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
51
Explicações para Medicina – 2017 João, 3:16
Os monossacarídeos e seus derivados são biomoléculas que possuem em sua
estrutura um grupo aldeído ou cetona.
Grupo carboxilo
O grupo carboxilo caracteriza os ácidos orgânicos. Sua estrutura se representa de
maneira abreviada como COOH. Sua nomenclatura se obtém pela adição do sufixo
oico ao nome do hidrocarboneto correspondente, embora frequentemente o composto
que possui este grupo conhece-se como trivial.
O grupo carboxilo está composto por um grupo carbonilo e um hidroxilo.
O grupo carboxilo se encontra nos aminoácidos e nos ácidos gordos, entre outras
moléculas e confere caracter ácido a compostos que o possuem. Intervém em
numerosas reações e na formação de diversas ligações e interações.
Grupo sulfidrilo
O grupo sulfidrilo (SH), conhecido também como mercaptán ou tiol se encontra em
varias biomoléculas como aminoácidos e vitaminas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
52
Explicações para Medicina – 2017 João, 3:16
Grupo amino
O grupo amino se encontra amplamente distribuído na natureza formando parte de
diversas biomoléculas, como nos aminoácidos, ácidos nucleicos, aminoaçúcares,
entre outras.
Em dependência do número de substituições dos H do grupo amino, se está em
presença de uma amina primária, secundária ou terciária.
Amidas
Quando o grupo OH dos ácidos carboxílicos é reenlaçado por um grupo amino se
origina uma amida.
Agrupações derivadas
Os grupos funcionais presentes nas biomoléculas são capazes de reagir entre si e
originar novas agrupações moleculares, as quais possuem complexidades maior e
apresentam características próprias.
Hemiacetales = carbonilo (aldeído ou cetona) + álcool.
Acetales = hemiacetal + OH.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
53
Explicações para Medicina – 2017 João, 3:16
Ésteres = ácido + álcool. Podem ser carboxílicos (COOH + álcool) ou fosfóricos (ácido
fosfórico + álcool).
Éter = álcool + álcool.
Tioéster = carboxilo + SH.
Amida = carboxilo + amino.
Anhídrido de ácido = ácido + ácido.
Álcoois
O álcool (do árabe al-kohul) é uma classe de compostos orgânicos que possui, na sua
estrutura, um ou mais grupos de hidroxilas ("-OH") ligados a carbonos saturados.1 É,
comumente, utilizado como combustível, esterilizante e solvente. É o componente
principal das bebidas alcoólicas.
Tipos
Álcool etílico é o tipo de álcool mais comum. Está contido nas bebidas alcoólicas, é
usado para limpeza doméstica e também é combustível para automóveis. A fórmula do
álcool etílico é CH3CH2OH.
O (metanol) ou (álcool metílico) é um álcool que não deve ser ingerido, pois é
extremamente tóxico para o fígado. A fórmula do metanol é (CH3OH).
Os dois exemplos acima são casos particulares de álcoois do tipo, (R-OH, em que R-)
é um radical alquila.
No fenol, de fórmula química é (C6H6O), o hidroxilo está ligada a um anel benzénico.
Mas na maioria dos textos, este composto não é considerado um álcool.
Álcool anidro é um álcool com até 1% de água (já que é difícil a obtenção de álcool
totalmente puro), e pode ser adicionado à gasolina para aumento da octanagem,
atuando como antidetonante, para que a gasolina possa ser comprimida no pistão do
motor carburante ao máximo e não entre em combustão antes de acionada a vela do
motor.
O álcool bornílico é obtido ligado com o hidroterpendio que corresponde a cânfora.
Classificações
Álcoois primários
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
54
Explicações para Medicina – 2017 João, 3:16
Os álcoois primários têm o grupo hidroxila ou oxidrila ligado a um carbono primário,
como por exemplo o etanol. Sua fórmula geral é:
(Na figura, "R" representa um radical hidrocarboneto qualquer)
Álcoois secundários
A fórmula geral dos álcoois secundários é:
,
Onde "R" representa um radical hidrocarboneto qualquer.2
Os álcoois secundários têm o grupo hidroxila ligado a um carbono secundário (isto é,
um átomo de carbono que está ligado a apenas dois outros átomos de carbono), como
é o caso do 2-propanol:
Álcoois terciários
Os álcoois terciários têm o grupo hidroxila ligado a um carbono terciário. Como o 2-
metil-2-propanol e o trimetilcarbinol. A fórmula geral é representada com "R",
representa um radical hidrocarboneto qualquer) 2=composição.
Nomenclatura
A Nomenclatura IUPAC dos álcoois é baseada na dos hidrocarbonetos de que
derivam: basta substituir a letra "o" do final por "ol". Se essa nomenclatura for ambígua
quanto à posição da hidroxila, o sufixo "ol" deve ser por ela precedido. Por exemplo,
propan-2-ol indica um grupo hidroxila ligado ao carbono 2 do propano. Também pode
ser escrito 2-propanol.
Em certos casos, pode ser necessário usar a nomenclatura na forma prefixal. Nesse
caso, deve-se usar o prefixo "hidróxi". Por exemplo, se tivermos um grupo hidroxila
ligado a um anel benzênico, podemos usar o nome "hidróxibenzeno" (essa substância
é usualmente conhecida como "fenol").
Em outros casos, o álcool possui outros sufixos, dependendo da quantidade de grupos
hidroxila.
-"ol": quando a cadeia possui apenas um grupo hidroxila.
Ex: Etanol (CH3-CH2-OH)
-"Diol": quando existem dois grupos hidroxila na cadeia carbônica.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
55
Explicações para Medicina – 2017 João, 3:16
Ex: Pentano-1,2-diol
-"Triol": quando a cadeia possui três grupos hidroxila.
Ex: Hexano-1,2,3-triol
Derivados halogenados
Derivados halogenados dos hidrocarbonetos (ou hidrocarbonetos halogenados) são
compostos orgânicos obtidos pela substituição de pelo menos um átomo de hidrogênio
de um hidrocarboneto por átomo de halogênio (por isso, compostos derivados), reação
essa, denominada halogenação. São também conhecidos como haletos ou
halogenetos orgânicos.
Classificação principal
Halogenetos ou haletos de alquila
Também conhecidos como haloalcanos, são compostos derivados da halogenação de
alcanos, ou seja, obtidos pela reação de substituição de pelo menos um átomo de
hidrogênio da molécula de um alcano por átomo de halogênio.
São representados pela fórmula genérica R-X, onde R é um grupo derivado de alquila
e X um halogênio.
Exemplo: clorofórmio.
Halogenetos ou haletos de arila
Também conhecidos como haletos ou halogenetos aromáticos, são compostos
derivados da halogenação de hidrocarbonetos aromáticos, ou seja, obtidos pela
reação de substituição de pelo menos um átomo de hidrogênio da molécula de um
hidrocarboneto aromático, por átomo de halogênio.
São representados pela fórmula genérica Ar-X, onde Ar é um grupo derivado de arila e
X um halogênio.
Exemplo: clorobenzeno.
Estudo Independente
Nomenclatura dos hidrocarbonetos halogenados
Nomenclatura dos aldeídos
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
56
Explicações para Medicina – 2017 João, 3:16
Os aldeídos mais simples são designados a partir dos ácidos carboxílicos
correspondentes. Assim, o composto derivado do ácido butírico é chamado de aldeído
butírico ou butiraldeído.
Segundo a nomenclatura IUPAC, o nome de um aldeído é obtido substituindo-se a
terminação "o" do hidrocarboneto correspondente por "al". Nos compostos que
apresentam ramificações, considera-se como principal a cadeia que contém o grupo
funcional, iniciando-se nela a numeração.
Exemplos:
HCHO: metanal ou formaldeído.
CH3CH2COH: propanal.
HOC-CH2-CH2-COH: butanodial (note que a numeração não é necessária, já
que a função aldeído só pode estar na extremidade da cadeia).
Nomenclatura das cetonas
A nomenclatura desses compostos é feita fundamentada na dos hidrocarbonetos,
apenas trocando o sufixo "o" por "ona". Quando houver ambiguidade na posição do
grupo carbonila, esta deve ser indicada antes do sufixo, da mesma maneira que em
outras funções orgânicas. Seguem alguns exemplos de cetonas:
Propanona (popularmente acetona): CH3-CO-CH3
Butanona: CH3-CO-CH2-CH3
pentan-2-ona: CH3-CO-CH2-CH2-CH3
pentan-3-ona: CH3-CH2-CO-CH2-CH3
hexan-2-ona: CH3-CO-(CH2)3-CH3
hexan-3-ona: CH3-CH2-CO-(CH2)2-CH3
Butanodiona (também conhecido por diacetilo): CH3-CO-CO-CH3
pentan-2,4-diona: CH3-CO-CH2-CO-CH3
Estudo independente
Representação de fórmulas estruturais
Fórmula completa
Fórmula incompleta
Fórmula de bastões
Fórmula de cunha
Fórmula de cavalete
Fórmula condensada
Fórmula tridimensional
Formula estrutural de Lewis
Ver anexo
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
57
Explicações para Medicina – 2017 João, 3:16
Os hidrocarbonetos: estrutura e nomenclatura, isómeros.
Outros compostos orgânicos (ãlcoois, aldeídos e cetonas, ácidos carboxílicos): grupo
funcional, fórmula geral e estrutura, nomenclatura, propriedades físicas e químicas.
Reacções dos compostos orgânicos: tipos de reacções e seus mecanismos.
Polímeros e biomoléculas
Bases químicas da vida
A matéria que forma os seres vivos, geralmente denominada matéria orgânica,
caracteriza-se pela presença constante de certos elementos químicos, dos quais se
destacam: carbono (C), hidrogénio (H), Oxigénio, (O), nitrogénio, (N), fósforo (P) e
enxofre (S). Estes seis elementos constituem cerca de 98% da massa corporal da
maioria dos seres vivos. Os outros 2% restantes, são de elementos químicos diversos
necessários ao funcionamento celular.
Substâncias inorgânicas
1º Sais minerais: são substâncias inorgânicas formadas por iões. Diversos tipos de
iões são necessários para o funcionamento do organismo dos seres vivos, na espécie
humana por exemplo, destacam-se os seguintes iões: cálcio (Ca), magnésio (Mg),
manganês (Mn), ferro (Fe) e zinco (Zn). Também destacam-se os iões fosfato (PO 4) e
carbonato (CaO3) que participam no mantimento do ph, bem como, o sódio (Na) e o
potássio (K) que participam na transmissão de impulsos nervosos.
2º A água: é uma substância inorgânica que corresponde cerca de 75% do peso do
corpo humano. É um excelente solvente capaz de dissolver grandes variedades de
substâncias químicas tais como: sais, gases, glícidos, aminoácidos, proteínas e ácidos
nucleicos; por isso costuma ser chamado solvente universal. A água e as substâncias
dissolvidas nela passam a constituir uma solução aquosa na qual, a água é o solvente
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
58
Explicações para Medicina – 2017 João, 3:16
e as substâncias dissolvidas os solutos. A água participa como reagente em reacções
denominadas reacções de hidrólise.
Substâncias orgânicas
1º Glícidos, hidratos de carbono, carbo-hidratos ou açúcares: são moléculas orgânicas
constituídas fundamentalmente, por átomos de carbono, hidrogénio e oxigénio. Os
glícidos constituem a principal fonte de energia para os seres vivos, e estão presentes
em diversos tipos de alimentos. O mel por exemplo contém glicose; a cana-de-açúcar
é rica em sacarose, o leite em lactose, frutos doces contêm frutose e glicose.
Os glícidos também participam na arquitetura corporal dos seres vivos; exemplo: a
celulose nos vegetais e quitina nos insetos. Outro papel importante dos glícidos é
participar na estrutura dos ácidos nucleicos; (ARN e ADN).
Classificação dos glícidos
De acordo ao tamanho:
Os glícidos costumam ser classificados de acordo com o tamanho em três grupos
(monossacarídeos, dissacarídeos e polissacarídeos).
Monossacarídeos: são os glícidos mais simples, contêm de três a sete átomos de
carbono. Assim, em função do número de carbono podem ser:
Trioses: 3 carbonos.
Tetroses: 4 carbonos.
Pentoses: 5 carbonos.
Hexoses: 6 carbonos; destacam-se a ribose e a desoxirribose
Heptoses: 7carbonos.
Dissacarídeos: são glícidos constituídos pela união de dois monossacarídeos.
Exemplo:
Sacarose = frutose + glicose
Lactose = galactose + glicose
Maltose = glicose + glicose
Polissacarídeos: são formados por centenas ou mesmo milhares de monossacáridos
interligados; exemplos:
Amido: é a principal substância de reserva de plantas e algas. Ao fazer
fotossíntese, as células destes organismos produzem o amido a partir de
substâncias inorgânicas e o armazenam. Exemplos de alimentos ricos em
amido: o trigo, o milho, a batata, a mandioca, etc.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
59
Explicações para Medicina – 2017 João, 3:16
Glicogénio: tem uma estrutura química similar a amido e desempenha, nos
animais função equivalente a do amido nas plantas (reserva energética).
Celulose: é a principal componente das paredes celulares vegetais (possui
função estrutural).
2º Lípidos: são compostos termais tais como os glícidos, isto é, estão compostos por
carbono, oxigénio, hidrogénio.
Os lípidos são caracterizados pela sua insolubilidade em água e em solventes
orgânicos. A razão dessa insolubilidade é que as moléculas dos lípidos são apolares,
por isso não têm afinidade com as moléculas polares da água.
Classificação dos lípidos
Os principais lípidos são os glicerídeos, as ceras, fosfolípidos, esteróides e
carotenóides.
Glicerídeos: são constituídos por uma molécula de álcool (o glicerol), ligada a
uma, duas ou três moléculas de ácidos gordos (neste caso chamado de
triglicerídeo). Exemplo de triglicerídeo: o óleo de palma, de cozinha, o azeite,
etc.
Ceras: são constituídas por uma molécula de álcool (diferente do glicerol),
unida a uma ou mais moléculas de ácidos gordos. Exemplo: as ceras das
folhas, das abelhas.
Esteróides: são lípidos em forma de anel. Temos como exemplo o colesterol e
diversos hormônios sexuais.
Fosfolípidos: são lípidos associados ao grupo fosfato e são os principais
componentes da membrana citoplasmática.
Carotenóides: são pigmentos de cor vermelhos ou amarela.
3º Proteínas: são componentes fundamentais de todos os seres vivos, inclusive os
vírus. As proteínas estão formadas pela união sequencial de dezenas de moléculas
denominados aminoácidos unidos por ligação peptídica. Sendo assim, uma proteína
pode ser definida como uma sequência de aminoácidos encadeados, ou seja, uma
cadeia de aminoácidos.
Classificação das proteínas
a) De acordo a sua complexidade, as proteínas podem ser: de estrutura primária,
secundária, terciária e quaternária.
b) De acordo a forma, elas podem ser: globulares e fibrosas.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
60
Explicações para Medicina – 2017 João, 3:16
C) De acordo com a função, podem ser proteínas de reserva, de defesa (anticorpos),
de transporte (hemoglobina), hormonais e estruturais (Ex: as proteínas da membrana
citoplasmática).
Enzimas
Enzimas: são proteínas com funções especiais que atuam como catalisadores
biológicos, isto é, intervêm nas reacções químicas do organismo, acelerando-as.
Características das enzimas
As enzimas caracterizam-se pela sua alta especificidade. E esta pode ser de duas
maneiras:
a) Especificidade da ação: têm sempre a mesma ação.
b) Especificidade de substrato: atuam sempre sobre o mesmo substrato, e isto se
explica pelo facto delas se encaixarem perfeitamente aos seus substratos como a
chave se encaixa na sua fechadura.
Aminoácidos
Um aminoácido é uma molécula orgânica que contém um grupo amino e um grupo
carboxilo, e uma cadeia lateral que é específica para cada aminoácido. Alguns
aminoácidos também podem conter enxofre. Os elementos-chave de um aminoácido
são carbono, hidrogênio, oxigênio e nitrogênio. São moléculas anfóteras, ou seja,
podem se comportar como ácido ou como base liberando nesta ordem H ou OH em
uma reação.
A forma mais importante dos aminoácidos, os alfa-aminoácidos, que formam as
proteínas, tem, geralmente, como estrutura um carbono central (carbono alfa) ao qual
se ligam quatro grupos: o grupo amino (NH2), grupo carboxílico (COOH), hidrogênio e
um substituinte característico de cada aminoácido.
Os aminoácidos se unem através de ligações peptídicas, formando os peptídeos e as
proteínas. Para que as células possam produzir suas proteínas, elas precisam de
aminoácidos, que podem ser obtidos a partir da alimentação ou serem fabricados pelo
próprio organismo.
Os aminoácidos podem ser classificados nutricionalmente, quanto ao radical e quanto
ao seu destino.
Classificação nutricional
Aminoácidos não-essenciais
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
61
Explicações para Medicina – 2017 João, 3:16
Aminoácidos não-essenciais ou dispensáveis são aqueles que o corpo humano pode
sintetizar.
São eles: alanina, asparagina, ácido aspártico, ácido glutâmico, serina e taurina.
Aminoácidos essenciais
Os aminoácidos essenciais são aqueles que não podem ser produzidos pelo corpo
humano. Dessa forma, são somente adquiridos pela ingestão de alimentos vegetais ou
animais. São eles: fenilalanina, isoleucina, leucina, lisina, metionina, treonina,
triptofano, histidina e valina.
Classificação quanto ao substituinte
Apolares.
Polares neutros.
Básicos.
Fórmula geral dos aminoácidos
São aqueles que apresentam fórmula geral: R - CH (NH2) – COOH na qual R é uma
cadeia orgânica.
Estrutura geral de um aminoácido.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
62
Explicações para Medicina – 2017 João, 3:16
Metabolismo celular
Metabolismo é o conjunto de transformações que as substâncias químicas sofrem no
interior dos organismos vivos. O termo "metabolismo celular" é usado em referência ao
conjunto de todas as reações químicas que ocorrem nas células. Estas reações são
responsáveis pelos processos de síntese e degradação dos nutrientes na célula e
constituem a base da vida, permitindo o crescimento e reprodução das células,
mantendo as suas estruturas e adequando respostas aos seus ambientes.
O metabolismo é normalmente dividido em dois grupos: anabolismo e catabolismo.
Reações anabólicas ou reações de síntese são reações químicas que produzem nova
matéria orgânica nos seres vivos. Sintetizam-se novos compostos (moléculas mais
complexas) a partir de moléculas simples (com consumo de energia sob a forma de
ATP).
Reações catabólicas ou reações de decomposição/degradação são reações químicas
que produzem grandes quantidades de energia (ATP) a partir da decomposição ou
degradação de moléculas mais complexas (matéria orgânica).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
63
Explicações para Medicina – 2017 João, 3:16
Quando o catabolismo supera em atividade o anabolismo, o organismo perde massa,
o que acontece em períodos de jejum ou doença; mas se o anabolismo superar o
catabolismo, o organismo cresce ou ganha massa. Se ambos os processos estão em
equilíbrio, o organismo encontra-se em equilíbrio dinâmico ou homeostasia.
O metabolismo é fundamentalmente estudado pela Bioquímica, usando muitas vezes
também técnicas ligadas à Biologia Molecular e à Genética.
Toda a energia presente nas moléculas dos seres vivos provêm primariamente da
energia solar. É por meio da fotossíntese que plantas e algas captam a energia
luminosa e a utilizam para produzir substâncias orgânicas, as quais retêm em suas
moléculas energia captada originalmente da luz solar.
A energia das moléculas orgânicas está armazenada nas ligações químicas entre
átomos presentes na molécula.
Existem três processos pelos quais as células obtêm energia para as suas funções
vitais: a respiração celular, a fermentação e a fotossíntese (só nas células vegetais).
O mecanismo básico da respiração celular e fermentação, consiste em retirar a
energia contida nas moléculas de alimento e armazenar na célula em forma de ATP
(trifosfato de adenosina). Enquanto a fotossíntese produz moléculas orgânicas a partir
de substâncias inorgânicas e em presença de luz solar.
Respiração celular
É o processo pelo qual os seres vivos produzem ATP através da oxidação (por meio
do oxigénio) de moléculas orgânicas. Nesse processo as moléculas oxidadas ou
degradadas são principalmente glícidos e lípidos, e se obtêm como produto final CO2
(dióxido de carbono), H2O (água) e energia em forma de ATP. Quimicamente
podemos representar da seguinte forma a respiração:
C6H12O6 + 6O2 6CO2 + 6 H2O + 32 ATP
A respiração celular pode ser de dois tipos, em dependência da presença ou não de
oxigénio:
Respiração aeróbia: é aquela que ocorre em presença de oxigénio, dela
obtém-se ácido pirúvico e no final do processo o balanco será de 32 ATP.
Respiração anaeróbia: é aquela que ocorre na ausência de oxigénio e obtém-
se ácido láctico ou etanol.
No processo de respiração celular ocorrem quatro etapas:
Glicólise: processo pelo qual a glicose é degradada em ácido pirúvico (em
presença de oxigénio) ou ácido láctico (sem oxigénio).
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
64
Explicações para Medicina – 2017 João, 3:16
Ciclo de Krebs: é a etapa da respiração celular em que se obtém cofactores
reduzidos (NADH, FADH e GTP) e a partir de oito reações cíclicas
consecutivas.
Cadeia de transporte de eletrões: processos de transferência de eletrões dos
cofactores reduzidos (NADH e FADH) até ao oxigénio e assim formam-se
moléculas de água.
Fosforilação oxidativa: nesta etapa dá-se a síntese da maior parte do ATP
gerado na respiração celular.
Fermentação (respiração anaeróbia)
É o processo de obtenção de energia mediante a degradação de substâncias
orgânicas do alimento. Este processo é caracterizado por ocorrer na ausência de
oxigénio.
A fermentação é utilizada por muitos fungos e bactérias que vivem em ambientes
pobres em oxigénio. As nossas células podem utilizar a fermentação se faltar oxigénio.
Na fermentação uma molécula de glicose é degradada em duas moléculas de ácido
pirúvico, liberando energia em forma de 2ATP. Deste modo diz-se que é um processo
semelhante a glicólise.
Tipos de fermentação
Existem vários tipos de fermentação, dentre os quais destacaremos as seguintes:
Fermentação láctica: nesta, o ácido pirúvico transforma-se em ácido láctico.
Este tipo de fermentação ocorre por exemplo em bactérias que fermentam o
leite e iogurtes, o sabor destes alimentos deve-se a presença do ácido láctico.
Fermentação alcoólica: o ácido pirúvico transforma-se em álcool etílico (etanol)
e CO2. Esse tipo de fermentação é realizado por fungos e leveduras. Esse
processo é usado no fabrico de bebidas alcoólicas e na produção de pão.
Fermentação acética: obtém-se ácido acético a partir do ácido pirúvico.
Fotossíntese
É o processo pelo qual os seres autotróficos, produzem substâncias orgânicas
(glícidos) a partir de substâncias inorgânicas (CO 2 e H2O) na presença de energia
solar.
A fotossíntese é realizada pelas plantas, algas e certas bactérias. E para tal participam
os seguintes compostos: reagentes: CO2 e H2O, e se obtêm como produtos:
compostos glicídicos e oxigénio O2.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
65
Explicações para Medicina – 2017 João, 3:16
Quase todo oxigénio existente na atmosfera atual da Terra é resultante da
fotossíntese.
A fotossíntese dá-se em duas etapas:
Etapa luminosa ou química: é a etapa mais curta da fotossíntese e dá-se em
presença de luz, nela ocorrem dois eventos fundamentais, a fotólise da água e
a fotofosforilação.
Etapa de escuro ou etapa puramente química: ocorre na ausência de luz, é a
etapa mais longa da fotossíntese, nela ocorre a formação de compostos
orgânicos (glucídicos), a partir de CO2.
Características da fotossíntese
Ocorre somente nos seres autotróficos, isto é, plantas, algas e algumas
bactérias.
Ocorre nos cloroplastos com a participação do pigmento clorofila.
Possui duas etapas.
Importância da fotossíntese
É através da fotossíntese que se obtém o oxigénio, este é indispensável pra os
seres vivos.
Possibilita a obtenção de substâncias orgânicas (glicose) necessárias para os
seres heterotróficos.
Equação geral da fotossíntese:
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
66
Explicações para Medicina – 2017 João, 3:16
Referências bibliográficas
1. Manuais de Química do I ciclo do ensino secundário (7ª, 8ª e 9ª Classes). Reforma
Educativa e Convencionais.
2. Manuais de Química do II ciclo do ensino secundário (10ª, 11ª e 12ª Classes). Reforma
Educativa e Convencionais.
3. Manual de Bioquímica Médica, Cardella – Hernandéz.
4. Wikipédia, a enciclopédia livre.
5. Química, volumes 1 e 2, de Ricardo Feltre.
6. Química, volume único, de João Usberco e Edgard Salvador.
Elaborado por: Juelson Manuel, Fernando Sito e Damassano Song
67
Você também pode gostar
- Modelos Atômicos e Composição da MatériaAinda não há avaliaçõesModelos Atômicos e Composição da Matéria3 páginas
- Estrutura Atômica e Elementos QuímicosAinda não há avaliaçõesEstrutura Atômica e Elementos Químicos8 páginas
- Estrutura e Classificação dos ÁtomosAinda não há avaliaçõesEstrutura e Classificação dos Átomos16 páginas
- Notação Científica e Estrutura AtômicaAinda não há avaliaçõesNotação Científica e Estrutura Atômica48 páginas
- Estrutura Atômica: Composição e PropriedadesAinda não há avaliaçõesEstrutura Atômica: Composição e Propriedades105 páginas
- Estrutura Atômica e Tipos de ElementosAinda não há avaliaçõesEstrutura Atômica e Tipos de Elementos4 páginas
- Estrutura Atômica: Conceitos FundamentaisAinda não há avaliaçõesEstrutura Atômica: Conceitos Fundamentais51 páginas
- Estrutura Atômica: Núcleo e EletrosferaAinda não há avaliaçõesEstrutura Atômica: Núcleo e Eletrosfera2 páginas
- Estrutura Atômica: Prótons, Nêutrons e ElétronsAinda não há avaliaçõesEstrutura Atômica: Prótons, Nêutrons e Elétrons62 páginas
- Aula 1 - Estrutura Atômica e Conceitos IniciaisAinda não há avaliaçõesAula 1 - Estrutura Atômica e Conceitos Iniciais21 páginas
- Núcleo Atômico e Estrutura SubatômicaAinda não há avaliaçõesNúcleo Atômico e Estrutura Subatômica30 páginas
- Química Geral - AGRO - 1°bimestre - 2018 - 1Ainda não há avaliaçõesQuímica Geral - AGRO - 1°bimestre - 2018 - 133 páginas
- Constituição do Átomo: Modelos e IsótoposAinda não há avaliaçõesConstituição do Átomo: Modelos e Isótopos29 páginas
- Elementos Químicos e Estruturas AtômicasAinda não há avaliaçõesElementos Químicos e Estruturas Atômicas36 páginas
- Fundamentos de Química e BiotecnologiaAinda não há avaliaçõesFundamentos de Química e Biotecnologia36 páginas
- Constituição dos Átomos e IsótoposAinda não há avaliaçõesConstituição dos Átomos e Isótopos16 páginas
- Estrutura Atômica e Propriedades dos ElementosAinda não há avaliaçõesEstrutura Atômica e Propriedades dos Elementos4 páginas
- Constituição Dos Átomos, Isótopos, N.º Atómico e de MassaAinda não há avaliaçõesConstituição Dos Átomos, Isótopos, N.º Atómico e de Massa16 páginas
- Conceitos Básicos de Física RadiológicaAinda não há avaliaçõesConceitos Básicos de Física Radiológica23 páginas
- Estrutura Atômica e Tabela PeriódicaAinda não há avaliaçõesEstrutura Atômica e Tabela Periódica7 páginas
- Estrutura e Propriedades dos ÁtomosAinda não há avaliaçõesEstrutura e Propriedades dos Átomos5 páginas
- Átomo - o Que É, Estrutura, Propriedades, História - Mundo EducaçãoAinda não há avaliaçõesÁtomo - o Que É, Estrutura, Propriedades, História - Mundo Educação18 páginas
- Atomística - Resumão-Com-ExercíciosAinda não há avaliaçõesAtomística - Resumão-Com-Exercícios5 páginas
- Estrutura Atômica: Princípios e PartículasAinda não há avaliaçõesEstrutura Atômica: Princípios e Partículas12 páginas
- Fundamentos de Química e Estruturas AtômicasAinda não há avaliaçõesFundamentos de Química e Estruturas Atômicas34 páginas
- Aula QBB 2 2025 Estrutura Atômica 2Ainda não há avaliaçõesAula QBB 2 2025 Estrutura Atômica 224 páginas
- Estrutura Atômica e Proteção RadiológicaAinda não há avaliaçõesEstrutura Atômica e Proteção Radiológica53 páginas
- Estrutura Atômica: Modelos e PartículasAinda não há avaliaçõesEstrutura Atômica: Modelos e Partículas8 páginas
- 2° Apostila Auxiliar de RadiologiaAinda não há avaliações2° Apostila Auxiliar de Radiologia52 páginas
- Reprodução e Nacionalismo: Conceitos ChaveAinda não há avaliaçõesReprodução e Nacionalismo: Conceitos Chave2 páginas
- Funções do Auxiliar de Limpeza EmpresarialAinda não há avaliaçõesFunções do Auxiliar de Limpeza Empresarial2 páginas
- Análise da Função de Engenheiro CivilAinda não há avaliaçõesAnálise da Função de Engenheiro Civil8 páginas
- Invenção do Microscópio e Teoria CelularAinda não há avaliaçõesInvenção do Microscópio e Teoria Celular48 páginas
- Currículo de Helena Isaias - Habilidades e ExperiênciaAinda não há avaliaçõesCurrículo de Helena Isaias - Habilidades e Experiência2 páginas
- Eritroblastose Fetal: Causas e ConsequênciasAinda não há avaliaçõesEritroblastose Fetal: Causas e Consequências9 páginas
- Questionário sobre Funções dos LeucócitosAinda não há avaliaçõesQuestionário sobre Funções dos Leucócitos18 páginas
- Currículo de João Tchicongo CachapeuAinda não há avaliaçõesCurrículo de João Tchicongo Cachapeu1 página
- Primeira Geração de Computadores (1946-1956)Ainda não há avaliaçõesPrimeira Geração de Computadores (1946-1956)3 páginas
- Avaliação de Técnicas de Enfermagem 11° AAinda não há avaliaçõesAvaliação de Técnicas de Enfermagem 11° A2 páginas
- Requerimento Anulação de MatriculaAinda não há avaliaçõesRequerimento Anulação de Matricula3 páginas
- Solicitação de Reconciliação na IgrejaAinda não há avaliaçõesSolicitação de Reconciliação na Igreja2 páginas
- Auto-biografias de Estudantes de EnfermagemAinda não há avaliaçõesAuto-biografias de Estudantes de Enfermagem3 páginas
- Preparação de Soluções Aquosas por DiluiçãoAinda não há avaliaçõesPreparação de Soluções Aquosas por Diluição5 páginas
- Aditivos na Industrialização de FrutasAinda não há avaliaçõesAditivos na Industrialização de Frutas30 páginas
- Segurança do Verniz Suvinil PremiumAinda não há avaliaçõesSegurança do Verniz Suvinil Premium17 páginas
- Equipe e Questões da Prova EsPCEx 2021Ainda não há avaliaçõesEquipe e Questões da Prova EsPCEx 202130 páginas
- Estrutura e Propriedades da Tabela PeriódicaAinda não há avaliaçõesEstrutura e Propriedades da Tabela Periódica7 páginas
- Profissionais Aprovados em Belém 2024Ainda não há avaliaçõesProfissionais Aprovados em Belém 20245 páginas
- (Gabarito Dia 2) - 5 Bernoulli 2021Ainda não há avaliações(Gabarito Dia 2) - 5 Bernoulli 202139 páginas
- Ficha de Segurança do Gasóleo SPOR2102Ainda não há avaliaçõesFicha de Segurança do Gasóleo SPOR21027 páginas
- FISPQ ADLUX 503 DF: Segurança e UsoAinda não há avaliaçõesFISPQ ADLUX 503 DF: Segurança e Uso8 páginas
- Ficha de Segurança do Coralit Ultra PretoAinda não há avaliaçõesFicha de Segurança do Coralit Ultra Preto13 páginas
- Perguntas e Respostas de Curiosidades CientíficasAinda não há avaliaçõesPerguntas e Respostas de Curiosidades Científicas29 páginas
- FISPQ: Segurança do Polímero AGP-1046Ainda não há avaliaçõesFISPQ: Segurança do Polímero AGP-10467 páginas
- Respostas Lista Fertilidade Do SoloAinda não há avaliaçõesRespostas Lista Fertilidade Do Solo4 páginas