Escolar Documentos
Profissional Documentos
Cultura Documentos
Prática - Velocidade
Enviado por
Mayla RochaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Prática - Velocidade
Enviado por
Mayla RochaDireitos autorais:
Formatos disponíveis
QB75B Prticas de Fsico-Qumica - 2015
Prof. Dr. Joo B. Floriano
Prof. Dr. Luiz Marcos L. Faria
Experimento n 10: estudo de uma reao de segunda ordem
Objetivo: Estudar a cintica da reao de saponificao do acetato de etila. Determinar a constante
de velocidade para esta reao.
Introduo:
O estudo das reaes de segunda ordem pode ser efetuado atravs do acompanhamento de uma
reao entre o acetato de etila e o hidrxido de sdio, denominada saponificao:
CH3COOC2H5 + OH- CH3COO- + C2H5OH (1)
Neste experimento, as concentraes iniciais dos dois reagentes so iguais e a reao equimolar,
isto , uma molcula do ster reage com uma hidroxila. Trata-se da ordem mais comum e, inclusive,
muito freqente nas reaes orgnicas. A expresso diferencial da lei velocidade para uma reao
deste tipo :
dx/dt = k (a-x) (b-x) (2),
onde x o abaixamento da concentrao (em mols.L-1) de acetato de etila e hidroxila quando
decorre um tempo t; a e b so as concentraes iniciais de acetato de etila e hidroxila
respectivamente e k a constante de velocidade. Considerando, como j mencionado, a = b, a forma
integrada da equao 2 :
k = 1/t [x /{a (a x)}] (3)
Pode-se acompanhar a cintica desta reao monitorando-se qualquer um dos dois reagentes ao
longo do experimento. Porm, o modo mais simples de se realizar tal tarefa seguir a diminuio
da concentrao de OH- no meio reacional, e isto pode ser conseguido tanto por uma anlise em
tempo real ou atravs do mtodo de extino. Neste experimento, utilizaremos o mtodo da
extino e a tcnica de titulao para determinar a quantidade de OH- restante em diferentes tempos.
Procedimento:
(LER TODO O PROCEDIMENTO ANTES DE INICIAR O EXPERIMENTO)
1) Colocar 250 mL de uma soluo aquosa de acetato de etila 0,02 mol.L-1 em um erlenmeyer
de 500 mL e 250 mL de uma soluo de NaOH tambm 0,02 mol.L-1 em outro erlenmeyer
de 500 mL.
2) Preparar sete erlenmeyers de 125 mL colocando em cada um deles 30 mL de HCl 0,02
mol.L-1.
QB75B Prticas de Fsico-Qumica - 2015
Prof. Dr. Joo B. Floriano
Prof. Dr. Luiz Marcos L. Faria
3) Juntar, em um dos erlenmeyers de 500 mL, os 250 ml de acetato de etila rapidamente
aos 250 mL de NaOH e iniciar a contagem do tempo. Agitar constantemente a mistura
reacional.
4) Retirar amostras de 25 mL do meio reacional com o auxlio de uma pipeta volumtrica de
escoamento rpido aos 2, 5, 10, 20, 40, 60 e 90 minutos, passando-as rapidamente para
cada um dos sete erlenmeyers contendo cido.
5) Titular cada soluo contida nos erlenmeyers de 125 mL com soluo de NaOH 0,02 mol.L1
, logo depois da reao ser parada naquela alquota. Utilize fenolfetalena como
indicador.
6) Medir a variao de temperatura do laboratrio a cada meia hora.
Orientaes para o relatrio:
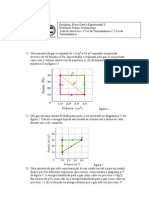
1) Calcule a constante de velocidade da reao utilizando um mtodo grfico.
2) Responda: i. Qual a unidade da constante de velocidade para uma reao de 2 ordem? ii.
Porque o mtodo utilizado pode ser classificado como um mtodo de extino da reao e
porque a operao de retirada de alquotas do meio reacional e transferncia para um
erlenmeyer contendo cido tem que ser o mais rpida possvel? iii. Cite uma forma de se
acompanhar o abaixamento na concentrao de OH- atravs de uma anlise em tempo real.
Anexo: Clculo da constante de velocidade:
Para calcular o valor da constante de velocidade por um mtodo grfico ou diretamente da equao
3, voc precisar somente calcular o valor de x para cada tempo de reao. O roteiro a seguir ajuda
neste clculo.
1) considere o nmero de mols de hidroxila gastos em uma titulao como n1;
2) considere o nmero de mols de cido inicialmente (antes da titulao) em cada erlenmeyer
de 125ml como n2;
3) Considere o nmero de mols de cido que reagiu com as hidroxilas restantes da reao de
saponificao como n3 e n2 n1 = n3;
4) Portanto, o nmero de mols de OH- que no reagiu na saponificao n3, e como esta
quantidade de mols veio de uma alquota de 25mL , o valor de x, para cada tempo, ser dado
por:
x = 0,02 mol.L-1 (n3 mols/25mL)
Referncia:
1) Rangel, R.N., Prticas de Fsico-Qumica, 2 edio, Ed. Edgard Blcher Ltda, 1997.
Entregar no dia da aula: valor da constante de velocidade!!
2
Você também pode gostar
- Artigo Kamilla Ora Pro NóbisDocumento5 páginasArtigo Kamilla Ora Pro NóbisMayla RochaAinda não há avaliações
- Somase e Cont - SeDocumento2 páginasSomase e Cont - SeMayla RochaAinda não há avaliações
- AmandaGomesAlmeida ArcoÍrisAlimentos UndisponivelDocumento46 páginasAmandaGomesAlmeida ArcoÍrisAlimentos UndisponivelMayla RochaAinda não há avaliações
- MAB ProjetoDocumento6 páginasMAB ProjetoMayla RochaAinda não há avaliações
- Resumo de Frutas-P2Documento22 páginasResumo de Frutas-P2Mayla RochaAinda não há avaliações
- Resumo (p1) - PescadoDocumento43 páginasResumo (p1) - PescadoMayla Rocha100% (1)
- CN Capt2Documento31 páginasCN Capt2clebervaleAinda não há avaliações
- Resumo (p1) - PescadoDocumento24 páginasResumo (p1) - PescadoMayla RochaAinda não há avaliações
- Lista de Exercicios 1-IC 279-2016Documento1 páginaLista de Exercicios 1-IC 279-2016Mayla RochaAinda não há avaliações
- NBR 5413 - 1992 - Iluminação de InterioresDocumento13 páginasNBR 5413 - 1992 - Iluminação de Interioressolracdias1100% (4)
- Trabalho EletrotecnicaDocumento1 páginaTrabalho EletrotecnicaMayla RochaAinda não há avaliações
- Capitulo 4 Resultantes de Um Sistema de ForcasDocumento68 páginasCapitulo 4 Resultantes de Um Sistema de ForcasMayla RochaAinda não há avaliações
- ICA5Documento6 páginasICA5Mayla RochaAinda não há avaliações
- Relatório Cinética EnzimáticaDocumento12 páginasRelatório Cinética EnzimáticaMayla RochaAinda não há avaliações
- Potenciometria de CocaDocumento7 páginasPotenciometria de CocaMayla RochaAinda não há avaliações
- 2014-I - Aula01Documento17 páginas2014-I - Aula01Mayla RochaAinda não há avaliações
- Amala e KamalaDocumento6 páginasAmala e KamalaMayla RochaAinda não há avaliações
- PROVAREMOTA2 QMC54112022SubstituiPDocumento3 páginasPROVAREMOTA2 QMC54112022SubstituiPMaria Clara Caldas DudaAinda não há avaliações
- 2º Trabalho Elemento, Substância e Mistura - GabaritoDocumento2 páginas2º Trabalho Elemento, Substância e Mistura - GabaritoSabrine Cassia de BoerAinda não há avaliações
- Fis06 Livro PropostosDocumento64 páginasFis06 Livro PropostosDanielValadãoBastosAinda não há avaliações
- Produção de Óxido de EtilenoDocumento52 páginasProdução de Óxido de Etilenofernandoibalves100% (1)
- Fisica 4690 V3Documento44 páginasFisica 4690 V3Silmara Kan100% (1)
- AULA 3 - Transporte Através Da Membrana 3 AvançadissimoDocumento22 páginasAULA 3 - Transporte Através Da Membrana 3 AvançadissimoallanfradiqueAinda não há avaliações
- Lista de Exercício 09 - Equação Da Difusão Térmica Da Condução Radial CilindroDocumento3 páginasLista de Exercício 09 - Equação Da Difusão Térmica Da Condução Radial CilindroCrislaine RigueteAinda não há avaliações
- Metais e Ligas Metálicas 12ºano - TPDocumento30 páginasMetais e Ligas Metálicas 12ºano - TPRui100% (1)
- Lista de Exercícios - Interpolação1Documento5 páginasLista de Exercícios - Interpolação1renatasbrazAinda não há avaliações
- 9 Ano - CIENCIAS 3° PeriodoDocumento3 páginas9 Ano - CIENCIAS 3° PeriodoEdson MarinhoAinda não há avaliações
- Slides Aula Analise Termica PDFDocumento103 páginasSlides Aula Analise Termica PDFIdalba SouzaAinda não há avaliações
- Determinação Do PH Do SoloDocumento16 páginasDeterminação Do PH Do SoloTalles EduardoAinda não há avaliações
- Deq503 2a Avaliacao 2013 2 Parte 2Documento1 páginaDeq503 2a Avaliacao 2013 2 Parte 2Gilson MedeirosAinda não há avaliações
- Psicometria 1 PDFDocumento16 páginasPsicometria 1 PDFAnderson PedrosoAinda não há avaliações
- Trocadores de Calor - Ebulição e CondensaçãoDocumento17 páginasTrocadores de Calor - Ebulição e CondensaçãoNazareno BragaAinda não há avaliações
- Relatorio Quimica Organica 2Documento11 páginasRelatorio Quimica Organica 2Angelique ViannyAinda não há avaliações
- Pilhas Basico INV PDFDocumento2 páginasPilhas Basico INV PDFGiovanni Cavalcante BarrosAinda não há avaliações
- Relatório 2 - Célula de StefanDocumento14 páginasRelatório 2 - Célula de StefanzboschiAinda não há avaliações
- Grupo 3 - T5Documento25 páginasGrupo 3 - T5Juliana VilhenaAinda não há avaliações
- Emissão Atômica 2023Documento60 páginasEmissão Atômica 2023Kauan TelesAinda não há avaliações
- Lista Exercícios Av1 QMDocumento7 páginasLista Exercícios Av1 QMRenata Leal MartinsAinda não há avaliações
- Emulsões PDFDocumento34 páginasEmulsões PDFRemy BlandinAinda não há avaliações
- ABNT NBR 7400 - 1990 - Produto de Aço Ou Ferro Fundido Revestido de Zinco Por Imersão A QuenteDocumento4 páginasABNT NBR 7400 - 1990 - Produto de Aço Ou Ferro Fundido Revestido de Zinco Por Imersão A Quentehelioxavier2Ainda não há avaliações
- (9º Ano) Avaliação - Substâncias e MisturasDocumento2 páginas(9º Ano) Avaliação - Substâncias e MisturasJéssica LayneAinda não há avaliações
- Lista - 1 e 2 LeiDocumento3 páginasLista - 1 e 2 LeiAdriano RabeloAinda não há avaliações
- Lista de Exercícios P SábadoDocumento4 páginasLista de Exercícios P SábadogiovahufrrjAinda não há avaliações
- Tetraedro Do Fogo Ou Triângulo Do FogoDocumento2 páginasTetraedro Do Fogo Ou Triângulo Do FogoFrancisco HenriqueAinda não há avaliações
- Termodinâmica I - CAPÍTULO 3Documento31 páginasTermodinâmica I - CAPÍTULO 3Pedro DuarteAinda não há avaliações
- Relatório 1 - Correntes de ConvecçãoDocumento9 páginasRelatório 1 - Correntes de ConvecçãoCésar Gomes de Souza0% (1)
- 1 Aula de Meteorologia - IntensivoDocumento30 páginas1 Aula de Meteorologia - IntensivoEdoardo MarkezAinda não há avaliações