Escolar Documentos
Profissional Documentos
Cultura Documentos
Problema N°1 - 1
Enviado por
Monserrat Godoy OlaveDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Problema N°1 - 1
Enviado por
Monserrat Godoy OlaveDireitos autorais:
Formatos disponíveis
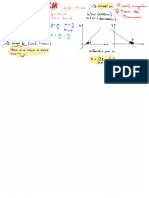
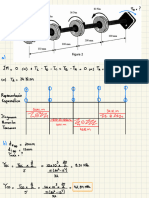
Problema n°1 :
estado 1 → Pn = 1 atm estado : se comprime se caliente → adiabático
y
Tn = 25°C
⊖, 0=0 AU AH
W ✗ Cv At
nxcpxst
-
= : =
-
n ✗ =
estado 2 → Pz = 6160 mmHg
Tz -
. 300°C
Va =
a)
Cv = 2,986 cal " = = 109 = 0,34 no ,
no / K
29 91m01
29811J
Alt
-
w -
0,34 no / ✗
a. 986 cal ✗ ( ÍÍÜ ) -
astas
( ) ) K
MOIK
AU =
-
W
-
279 , 191 cal
4,184 J 1168
W =
279,191 cal ✗ =
, 135 J
1cal
AU =
1186.135J
b)
Suponer que el
gas se
comporta como
gas ideal .
Cp = [✓ + R
Cp =
2,986 cal + =
1,987 cal =
4,973 cal
MOIK no / ✗ K
molk
AH =
nxcp ✗ At
= O, 34 no / × 4,973 cal ( 573,15 -
298
,
/ 5)
◦
K
MOI K
AH =
464,956 cal ✗ 4,184J
1cal
AH =
1945,46 J
c) Si ① = 5o KJ ¿ W ?
AU = Q -
W
1186,135J =
50 KJ ✗ 1000J -
W
1kg
W =
48813,865 J
Você também pode gostar
- MdiasDocumento15 páginasMdiasLuana FerreiraAinda não há avaliações
- Tsala 2Documento9 páginasTsala 2g207133Ainda não há avaliações
- Solucionario 2o Examen Parcial 2o Semestre 2022 Física 2Documento16 páginasSolucionario 2o Examen Parcial 2o Semestre 2022 Física 2Jose EstradaAinda não há avaliações
- FQ10) Física 1.1 - Ficha 4 (Soluções)Documento3 páginasFQ10) Física 1.1 - Ficha 4 (Soluções)franciscofmyAinda não há avaliações
- Áreas Figuras PlanasDocumento1 páginaÁreas Figuras PlanasBrenda DanieleAinda não há avaliações
- Órgãos IIDocumento15 páginasÓrgãos IIxaysu.contactsAinda não há avaliações
- Movimento Uniforme ArcanjoDocumento30 páginasMovimento Uniforme ArcanjoluaneugeniaAinda não há avaliações
- Tarea 3 de Fundamentos FísicoDocumento4 páginasTarea 3 de Fundamentos FísicoANTONIO SÁNCHEZ SALARAinda não há avaliações
- Física e QuímicaDocumento2 páginasFísica e QuímicaBé CarvalhoAinda não há avaliações
- Bloc de Notas Sin TítuloDocumento4 páginasBloc de Notas Sin TítuloSofía Escobar LondoñoAinda não há avaliações
- De La Rosa ' Caudi @@dimeclaudiDocumento5 páginasDe La Rosa ' Caudi @@dimeclaudiClaudia De La Rosa GarcésAinda não há avaliações
- Transferencia de CalorDocumento110 páginasTransferencia de CalorThaynaraBaudelaireAinda não há avaliações
- đề 2Documento6 páginasđề 2Thanh ThảoAinda não há avaliações
- Ficha7 ResoluçãoDocumento19 páginasFicha7 ResoluçãoCírculo dos LivrosAinda não há avaliações
- Aula 1 - Função AfimDocumento3 páginasAula 1 - Função AfimPoliana FreitasAinda não há avaliações
- Cont Ficha 2Documento20 páginasCont Ficha 2Bruno PintoAinda não há avaliações
- Contreras Rodriguez-Tarea06Documento4 páginasContreras Rodriguez-Tarea06Jesus ContrerasAinda não há avaliações
- Exercícios Sist Térmicos IIDocumento7 páginasExercícios Sist Térmicos IIRonald José Silva CostaAinda não há avaliações
- Exercícios 2Documento1 páginaExercícios 2Pedro Henrique Vieira RibeiroAinda não há avaliações
- Ex Aulas MFDocumento13 páginasEx Aulas MFRitaAinda não há avaliações
- P2 - Fundamentos Da EletrotécnicaDocumento4 páginasP2 - Fundamentos Da EletrotécnicaSabrina Da MaiaAinda não há avaliações
- Circuitos Eletricos - Sodiku - Lista - Ricardo - SantosDocumento22 páginasCircuitos Eletricos - Sodiku - Lista - Ricardo - SantosRicardo SantosAinda não há avaliações
- Untitled Notebook 10Documento1 páginaUntitled Notebook 10Maria MariaAinda não há avaliações
- Resolução Prova Modelo 1 2023Documento4 páginasResolução Prova Modelo 1 2023anaAinda não há avaliações
- Aula Movimento MHS Amortecido e MHS Forçado - Física IIDocumento9 páginasAula Movimento MHS Amortecido e MHS Forçado - Física IIFull Mad ChemistryAinda não há avaliações
- 1698875617569+caderno Sem TítuloDocumento2 páginas1698875617569+caderno Sem TítuloBryan WindsonAinda não há avaliações
- Cpaeam-2023 Prova - Amarela (Reaplicação) - 1-1Documento18 páginasCpaeam-2023 Prova - Amarela (Reaplicação) - 1-1IVAMAR ROCHAAinda não há avaliações
- Aula Movimento Harmônico Simples - MHS - Física IIDocumento12 páginasAula Movimento Harmônico Simples - MHS - Física IIFull Mad ChemistryAinda não há avaliações
- Trigonometria (Bizuário)Documento6 páginasTrigonometria (Bizuário)Yasmin YasminAinda não há avaliações
- Resumo Limites Indeterminações FunçõesDocumento2 páginasResumo Limites Indeterminações FunçõesMargarida MarquesAinda não há avaliações
- Termo Cap 7,8,9Documento2 páginasTermo Cap 7,8,9pedroAinda não há avaliações
- Física II (Segundo Parcial)Documento5 páginasFísica II (Segundo Parcial)basura089Ainda não há avaliações
- Calor E Massa Cap 3Documento6 páginasCalor E Massa Cap 3Robson FreitasAinda não há avaliações
- Química 2Documento1 páginaQuímica 2aline caligarisAinda não há avaliações
- QUÍMICADocumento1 páginaQUÍMICAaline caligarisAinda não há avaliações
- Exercício 4Documento3 páginasExercício 4JoãoRafaelAinda não há avaliações
- Notas ClasesDocumento3 páginasNotas ClasesAntonia Fuentes BarnacheaAinda não há avaliações
- 5.2 - Modos NormaisDocumento7 páginas5.2 - Modos NormaisCarlos augusto LeaoAinda não há avaliações
- Cap14 CS22156Documento6 páginasCap14 CS22156Carlos SosaAinda não há avaliações
- Atividade de Revisão RefrigeraçãoDocumento6 páginasAtividade de Revisão RefrigeraçãoMatheus Barbosa LeiteAinda não há avaliações
- Questõesdeestática 1Documento6 páginasQuestõesdeestática 1Silva HenriquesAinda não há avaliações
- Geee 06Documento8 páginasGeee 06André Von Frühauf HublardAinda não há avaliações
- Fisica 2 Flash CardDocumento14 páginasFisica 2 Flash CardLívia BarbieriAinda não há avaliações
- Resumo FluxoDocumento10 páginasResumo FluxoGuilherme BrustolonAinda não há avaliações
- Dúvidas Alunos PDFDocumento1 páginaDúvidas Alunos PDFAna GavetanhoAinda não há avaliações
- Parte - Pratica - PL Resistência Dos MateriasDocumento6 páginasParte - Pratica - PL Resistência Dos Materias2ndrussoAinda não há avaliações
- Control 2 PDFDocumento3 páginasControl 2 PDFgabo gtAinda não há avaliações
- Tercera LeyDocumento2 páginasTercera Leyamichellev29Ainda não há avaliações
- CálculoDocumento15 páginasCálculoAlex Petit HommeAinda não há avaliações
- Lista 5 - DeslocamentoDocumento23 páginasLista 5 - DeslocamentoKéren LimaAinda não há avaliações
- Problemas Fluidomecanica 8 - 3Documento1 páginaProblemas Fluidomecanica 8 - 3diban49680Ainda não há avaliações
- Ssa 2 - Aula 01Documento6 páginasSsa 2 - Aula 01Davi BenAinda não há avaliações
- Img 20230109 0001 0001Documento1 páginaImg 20230109 0001 0001Carmen CarmenAinda não há avaliações
- Ficha3 ResoluçãoDocumento7 páginasFicha3 ResoluçãoÂngela Sousa SousaAinda não há avaliações
- Projetos Elétricos IndustriaisDocumento1 páginaProjetos Elétricos IndustriaisNatháliaAinda não há avaliações
- Ü e Ftp.Y-D-F: T.E.I.Fi?-#1Mn H IDocumento7 páginasÜ e Ftp.Y-D-F: T.E.I.Fi?-#1Mn H I011SkatersAinda não há avaliações
- Fluidos AyudantiasDocumento2 páginasFluidos AyudantiasMaría Jose Birke EspinozaAinda não há avaliações
- Foipe: UltmDocumento1 páginaFoipe: UltmBrenda DanieleAinda não há avaliações
- Catalogo Smart Floor 2022Documento10 páginasCatalogo Smart Floor 2022Fabio DiasAinda não há avaliações
- 2º Anos Ensino Médio EjaDocumento97 páginas2º Anos Ensino Médio EjaJohn Leno SabinoAinda não há avaliações
- Apresentação Lab.1Documento23 páginasApresentação Lab.1Joel PintoAinda não há avaliações
- Relatório 11Documento8 páginasRelatório 11Ivan Barbosa PinheiroAinda não há avaliações
- Atividade 1 para o 6º Ano Enigmas 2019Documento6 páginasAtividade 1 para o 6º Ano Enigmas 2019Emanuel Rêgo de MenezesAinda não há avaliações
- Aula - 14 - Quimica Geral C - QUI003 - 1 - 2022Documento19 páginasAula - 14 - Quimica Geral C - QUI003 - 1 - 2022TiagoAinda não há avaliações
- Critérios Específicos de Correção Do Teste 1 (2018-2019)Documento5 páginasCritérios Específicos de Correção Do Teste 1 (2018-2019).Ainda não há avaliações
- Termometria - Lista 2Documento2 páginasTermometria - Lista 2charpianaAinda não há avaliações
- Dimensionamento de Calhas e CondutoresDocumento12 páginasDimensionamento de Calhas e CondutoresDiego TravassosAinda não há avaliações
- Lista 2Documento3 páginasLista 2Jefferson GomesAinda não há avaliações
- ElastómerosDocumento15 páginasElastómerosGeronimo Lobo Rocha SegurarAinda não há avaliações
- Solução Padrão de Cadmio-FispqDocumento3 páginasSolução Padrão de Cadmio-FispqpmarcelopontesAinda não há avaliações
- PLANO DE AULA - LEI DE HESS - LauraDocumento4 páginasPLANO DE AULA - LEI DE HESS - Lauraarmazenamento.alaurabozAinda não há avaliações
- Manual Series AT AXIONDocumento124 páginasManual Series AT AXIONAlan Z900Ainda não há avaliações
- 02) As Reações de Hidrogenação São Muito Utilizadas Industrialmente Quando Se DesejaDocumento4 páginas02) As Reações de Hidrogenação São Muito Utilizadas Industrialmente Quando Se Desejaandreaverandinary13Ainda não há avaliações
- Estrutura Curricular Eng - QuímicaDocumento3 páginasEstrutura Curricular Eng - QuímicaMaico FonteneleAinda não há avaliações
- Modelo Relatorio de Simulado de EmergenciaDocumento2 páginasModelo Relatorio de Simulado de EmergencianonatoAinda não há avaliações
- Prática 1 - Teor de Álcool Na GasolinaDocumento2 páginasPrática 1 - Teor de Álcool Na GasolinaNícolas SousaAinda não há avaliações
- Incerteza Homogeneidade Estabilidade 2012Documento15 páginasIncerteza Homogeneidade Estabilidade 2012Cláudia Maria RangelAinda não há avaliações
- Alcool GelDocumento22 páginasAlcool Gelultramail7209Ainda não há avaliações
- EquilibrioDocumento85 páginasEquilibrioRobson SilvaAinda não há avaliações
- ATIVIDADES Origem Da VidaDocumento2 páginasATIVIDADES Origem Da VidaAdriana ReisAinda não há avaliações
- Livro-Texto - Unidade IDocumento36 páginasLivro-Texto - Unidade IVanessa RomãoAinda não há avaliações
- Teoria PCC 2022Documento77 páginasTeoria PCC 2022Hugo Caetano CostaAinda não há avaliações
- Encceja - 2018Documento32 páginasEncceja - 2018Isabella Souza SilvaAinda não há avaliações
- Fispq IsolanteDocumento17 páginasFispq IsolanteDiêgo SouzaAinda não há avaliações
- 100 Questões Sobre RefrigeraçãoDocumento8 páginas100 Questões Sobre RefrigeraçãoVagner VVS100% (1)
- Aula 3 - Tração-1Documento13 páginasAula 3 - Tração-1Garota GeekAinda não há avaliações
- Lista de Exercícios - Titulação de ComplexaçãoDocumento1 páginaLista de Exercícios - Titulação de ComplexaçãoNathalia S. De Souza LopesAinda não há avaliações
- UnP 2018.2 MedicinaDocumento16 páginasUnP 2018.2 Medicinaleonardoolliveira100% (1)