Escolar Documentos
Profissional Documentos
Cultura Documentos
FT1-. Lig Intermoleculares
Enviado por
a32202Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
FT1-. Lig Intermoleculares
Enviado por
a32202Direitos autorais:
Formatos disponíveis
Ficha de trabalho 10º ano Física e Química A
Ligações Intermoleculares
1. As colas são produzidas de forma a ter afinidade com os materiais que devem ser colados havendo colas
apropriadas para papel, para plástico, etc.
Quando se coloca cola entre dois objetos com o propósito de os unir, as moléculas da cola interagem fortemente,
por meio de interações ________, com as moléculas de ambos os objetos.
(A) … iónicas …
(B) … covalentes …
(C) … metálicas …
(D) … intermoleculares …
Selecione a opção correta.
2. Em 1997, comemoram-se 100 anos da descoberta do eletrão. Entre outros factos
importantes, a distribuição dos eletrões numa molécula permite analisar a sua
polaridade e prever o tipo de ligações intermoleculares que pode estabelecer. Por isso
é necessário, conhecer a geometria da molécula e a polaridade das suas ligações.
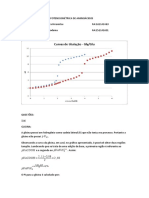
2.1 Analisando a figura o que se pode concluir sobre a polaridade das ligações?
2.2 Qual é o tipo de geometria adotada pela molécula em causa?
2.3 Tendo em conta a distribuição eletrónica classifique a molécula como polar ou apolar.
2.4 Identifique o tipo de ligações intermoleculares que existem entre moléculas desta substância e como se
estabelecem estas interações.
3. O gás natural, maioritariamente constituído por metano, é usado para produzir hidrogénio, um dos reagentes
utilizados na síntese do amoníaco. Nas moléculas de amoníaco (NH3) e nas moléculas de metano (CH4) estabelecem-
se, respetivamente, ligações intermoleculares do tipo …
(A) ligações de hidrogénio e forças de dispersão de London.
(B) Ligações de hidrogénio e dipolo permanente-dipolo induzido.
(C) dipolo permanente-dipolo permanente
(D) dipolo permanente – dipolo permanente e dipolo permanente – dipolo induzido.
Selecione a opção correta.
4. O tetraclorometano (CCl4) é um haloalcano derivado do metano (CH4) em que os átomos de hidrogénio foram
substituídos por átomos de cloro. Enquanto o tetraclorometano é líquido, à temperatura ambiente, o metano é
gasoso o que sugere que as ligações intermoleculares são mais intensas no tetraclorometano. Encontre uma
justificação para esse facto.
5. Considere os hidretos pelos elementos do segundo período da Tabela Periódica e as respetivas geometrias
indicadas:
BeH2 (linear) NH3 (piramidal trigonal)
BH3 (triangular plana) H2O (angular)
CH4 (tetraédrica) HF (linear)
Quais destas substâncias são mais solúveis em benzeno (C6H6), uma molécula apolar?
(A) Amoníaco, água e fluoreto de hidrogénio
(B) Tri-hidreto de boro, metano e amoníaco
(C) Hidreto de berílio, tri-hidreto de boro e amoníaco
(D) Hidreto de berílio, tri-hidreto de boro e metano
6. Os ácidos gordos, de fórmula geral RCOOH, podem ser saturados ou insaturados dependendo se a sua longa
cadeia de hidrocarboneto representada por R possui ou não ligações múltiplas. Verifica-se experimentalmente que
essas moléculas podem ser simultaneamente solúveis em água e em benzeno (uma molécula apolar). Como é que se
pode justificar este facto?
7. A miscibilidade das substâncias depende da natureza e consequentemente do tipo de ligações intermoleculares
que é posssível estabelecer.
Considere as seguintes moléculas representadas pelos respetivos modelos.
Água ( H2O) Amoníaco (NH3) Metano (CH4)
7.1 Classifique as moléculas representadas quanto à sua polaridade.
7.2 Identifique o tipo de ligação intermolecular que prevalece entre as moléculas de:
7.2.1 H2O 7.2.2 NH3 7.2.3 CH4
7.3 Explique o facto do amoníaco ser mais solúvel em água do que o metano.
8. Conclua que os álcoois são miscíveis entre si, justificando com base no tipo de ligações intermoleculares que entre
eles se estabelecem.
Você também pode gostar
- 02 - Teste - Avaliacao - q10 - d2 - sd1 Ligações QuimicaDocumento5 páginas02 - Teste - Avaliacao - q10 - d2 - sd1 Ligações QuimicaElsa Viana BaptistaAinda não há avaliações
- Ligação Quimica e CorreçãoDocumento6 páginasLigação Quimica e CorreçãodropadatiponeymarAinda não há avaliações
- Teste Q2.1 N.º 2 - V1 10-4Documento4 páginasTeste Q2.1 N.º 2 - V1 10-4BiaAinda não há avaliações
- Lista de Exercicios 01 - 9 AnoDocumento4 páginasLista de Exercicios 01 - 9 AnoLarissa BarbosaAinda não há avaliações
- Teste Q2.1 N.º 1 - V1 10-3Documento4 páginasTeste Q2.1 N.º 1 - V1 10-3BiaAinda não há avaliações
- 10Q - FF4 - Ligação QuímicaDocumento10 páginas10Q - FF4 - Ligação QuímicaAvmiguelAinda não há avaliações
- Exercícios - Moléculas e Propriedades - Ligações e GeometriaDocumento14 páginasExercícios - Moléculas e Propriedades - Ligações e GeometriaAndrea LastorinaAinda não há avaliações
- 10FQA Ficha Formativa Q2.1 - N.º 1Documento4 páginas10FQA Ficha Formativa Q2.1 - N.º 1Tiago SousaAinda não há avaliações
- Simulado Sobre Interações Atômicas Geometria Molecular Polaridade Da Ligação e Da Molécula Forças Intermoleculares e Número de Oxidação. Concurso Professor de QuímicaDocumento4 páginasSimulado Sobre Interações Atômicas Geometria Molecular Polaridade Da Ligação e Da Molécula Forças Intermoleculares e Número de Oxidação. Concurso Professor de QuímicaAnonymous aPzoIa4Ainda não há avaliações
- Fichas 10, 11 e 12 - Ligação QuímicaDocumento10 páginasFichas 10, 11 e 12 - Ligação QuímicasoledbystrangeAinda não há avaliações
- Ligações Intermoleculares - Jogo de Partículas 10º CDocumento3 páginasLigações Intermoleculares - Jogo de Partículas 10º CAna Raquel PintoAinda não há avaliações
- Geometria e Polaridade MolecularDocumento10 páginasGeometria e Polaridade MolecularFerdinando De CarliAinda não há avaliações
- Teste Q2.1 N.º 2 - V1 10-4 CorrDocumento5 páginasTeste Q2.1 N.º 2 - V1 10-4 CorrBia100% (1)
- Ficha de Trabalho 5 - Ligação QuímicaDocumento14 páginasFicha de Trabalho 5 - Ligação QuímicaVasco HenriquesAinda não há avaliações
- Teste 8Documento4 páginasTeste 8andreia5nazar5Ainda não há avaliações
- Ficha Formativa 6-10ºano - Ligação QuímicaDocumento11 páginasFicha Formativa 6-10ºano - Ligação QuímicaviviAinda não há avaliações
- 02 Teste 1 Ligacao Quimica EnunciadoDocumento5 páginas02 Teste 1 Ligacao Quimica Enunciadomariana barbeiroAinda não há avaliações
- 1° Revisão 3° Ano AlternativoDocumento6 páginas1° Revisão 3° Ano Alternativopaulo renato ribeiro santos RenatoAinda não há avaliações
- Exercicíos Gerais QUIMICA GERALDocumento13 páginasExercicíos Gerais QUIMICA GERALWylace AndradeAinda não há avaliações
- qr10 02 Teste Aval 9 sd4 EnunciadoDocumento5 páginasqr10 02 Teste Aval 9 sd4 EnunciadoMariaAinda não há avaliações
- Ligações Químicas, Forças Intermoleculares e Geometria MolecularDocumento4 páginasLigações Químicas, Forças Intermoleculares e Geometria MolecularRayane MariaAinda não há avaliações
- Estudo Dirigido 3 - Ligaes Qumicas e Propriedades CompostosDocumento3 páginasEstudo Dirigido 3 - Ligaes Qumicas e Propriedades CompostosMaria Luiza FachinettoAinda não há avaliações
- 4 FQ 10 Ano Ligacao QuimicaDocumento3 páginas4 FQ 10 Ano Ligacao QuimicajferAinda não há avaliações
- qr10 02 Teste Aval 9 sd4 EnunciadoDocumento5 páginasqr10 02 Teste Aval 9 sd4 EnunciadoDonzília AlvesAinda não há avaliações
- 10 FF 16 Ligacoes Intermoleculares Correcao 2023 24Documento3 páginas10 FF 16 Ligacoes Intermoleculares Correcao 2023 24Iara LançaAinda não há avaliações
- Ficha Ligacao QuimicaDocumento8 páginasFicha Ligacao QuimicaSusana Maria Cunha Teixeira100% (1)
- QUIMICA, Primeira ListaDocumento3 páginasQUIMICA, Primeira ListaJúlia PioAinda não há avaliações
- Geometria Molecular 2023 - Química PMT VPDocumento7 páginasGeometria Molecular 2023 - Química PMT VPCamillaCarvalho100% (1)
- Ligações Químicas 2 Resumo e Exercícios - GabaritoDocumento5 páginasLigações Químicas 2 Resumo e Exercícios - GabaritoMonteiroAinda não há avaliações
- Aula 11 - Exercícios Ligações Químicas e Tabela Periódica (Sem Gabarito) - 30-05Documento2 páginasAula 11 - Exercícios Ligações Químicas e Tabela Periódica (Sem Gabarito) - 30-05Ana Paula Rodrigues100% (1)
- Aula15 Quimica1 ExercíciosDocumento4 páginasAula15 Quimica1 ExercíciosSayori CosmeticosAinda não há avaliações
- 5 - Lista de ExercíciosDocumento6 páginas5 - Lista de ExercíciosjessicatoquiAinda não há avaliações
- Ligações Químicas ExercíciosDocumento2 páginasLigações Químicas ExercíciosRafael Ramos Castellari100% (1)
- Ligações QuímicasDocumento20 páginasLigações QuímicasRobaoufgAinda não há avaliações
- Teste Q2.1 N.º 1 - V1 10-3 CorrDocumento5 páginasTeste Q2.1 N.º 1 - V1 10-3 CorrBia100% (2)
- Atividade - Ligações Polaridade e Forças Intermoleculares PDFDocumento2 páginasAtividade - Ligações Polaridade e Forças Intermoleculares PDFBirina DamasioAinda não há avaliações
- 30-Geometria, Polaridade e InteraçõesDocumento4 páginas30-Geometria, Polaridade e Interaçõesnv77vnmAinda não há avaliações
- Domínio 2Documento4 páginasDomínio 2Marília PachecoAinda não há avaliações
- FF3.4 - 2.1.3 - CCDocumento4 páginasFF3.4 - 2.1.3 - CCiolaAinda não há avaliações
- Exercícios de Revisão para A Prova Bimestral Dissertativa Do 2o BimestreDocumento3 páginasExercícios de Revisão para A Prova Bimestral Dissertativa Do 2o BimestremauoscuroAinda não há avaliações
- Geometria, Polaridade e Interações Intermoleculares - 1Documento10 páginasGeometria, Polaridade e Interações Intermoleculares - 1versianelarisAinda não há avaliações
- APOSTILA (Isomeria)Documento16 páginasAPOSTILA (Isomeria)Jonas SantosAinda não há avaliações
- Q10. A3 - Ficha Treino N.º 1 - Ligação QuimicaDocumento3 páginasQ10. A3 - Ficha Treino N.º 1 - Ligação QuimicaMiguel AntonioAinda não há avaliações
- Ligacao CovalenteDocumento12 páginasLigacao CovalenterodrigomenegazgoularAinda não há avaliações
- Alfa - Módulo 14Documento11 páginasAlfa - Módulo 14Juliano Abreu PrattiAinda não há avaliações
- Ligações QuímicasDocumento2 páginasLigações QuímicasCaroline MartinsAinda não há avaliações
- Avaliação de Recuperação 8 SerieDocumento4 páginasAvaliação de Recuperação 8 SerieMarcos Henrique QuerinAinda não há avaliações
- Lista de Exercicios - Geometria Molec e PolaridadeDocumento8 páginasLista de Exercicios - Geometria Molec e PolaridadeJulio AndradeAinda não há avaliações
- Lista de QuimicaDocumento1 páginaLista de QuimicaNuniaAinda não há avaliações
- Exercicios Capitulo 2Documento30 páginasExercicios Capitulo 2EricksonAinda não há avaliações
- FT 7 RespostasDocumento5 páginasFT 7 RespostasptpbzpwtqdAinda não há avaliações
- Exercicios Ligacao Quimica 1Documento5 páginasExercicios Ligacao Quimica 1Yara TavaresAinda não há avaliações
- Assncrona 2. 11 03 23Documento3 páginasAssncrona 2. 11 03 23tyago silvaAinda não há avaliações
- Avaliação RespondidaDocumento4 páginasAvaliação Respondidanatalia LinsAinda não há avaliações
- Ficha IV Ligações QuímicasDocumento5 páginasFicha IV Ligações QuímicasNarcisa Alexandra FilipeAinda não há avaliações
- Quimica Ligacoes Quimicas ExerciciosDocumento11 páginasQuimica Ligacoes Quimicas ExerciciosVinicius Belmuds VasconcelosAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Potenciometria: aspectos teóricos e práticosNo EverandPotenciometria: aspectos teóricos e práticosAinda não há avaliações
- 1Documento1 página1Evelyn Alves Nunes SimonettiAinda não há avaliações
- Química Do SilícioDocumento13 páginasQuímica Do SilícioThales Ariston100% (1)
- Bioquimica 1Documento2 páginasBioquimica 1Felipe HiroAinda não há avaliações
- Relatório - 1Documento14 páginasRelatório - 1lucas ronieryAinda não há avaliações
- Transformação Dos MetaisDocumento118 páginasTransformação Dos MetaisVanderson Soares de Araujo100% (1)
- Variações CronobiológicasDocumento26 páginasVariações CronobiológicasLyslie Maron RibeiroAinda não há avaliações
- Lista de Exercicios 5 - Lic. QuimicaDocumento3 páginasLista de Exercicios 5 - Lic. QuimicaAbebeAinda não há avaliações
- AULA - ALIMENTAÇAO ANIMAL - SLIDEpptxDocumento24 páginasAULA - ALIMENTAÇAO ANIMAL - SLIDEpptxLourenço ChiteteAinda não há avaliações
- Aula - 16 - Quimica Geral C - QUI003 - 1 - 2022Documento42 páginasAula - 16 - Quimica Geral C - QUI003 - 1 - 2022TiagoAinda não há avaliações
- Bloco DataçãoDocumento22 páginasBloco DataçãoJorge HonzAinda não há avaliações
- A-5 - Bombas de CalorDocumento51 páginasA-5 - Bombas de CalorYan Felipe CavalcanteAinda não há avaliações
- Quais Os Conceitos Importantes NR-20Documento4 páginasQuais Os Conceitos Importantes NR-20vivaldoms144Ainda não há avaliações
- Apostila Inspeção de MotoresDocumento58 páginasApostila Inspeção de MotoresLucas Silva100% (1)
- Natalia Lyrio DissertacaoDocumento65 páginasNatalia Lyrio DissertacaoMarcos GarcezAinda não há avaliações
- Discutir As Diferenças Entre Os Tipos Possíveis de Chamas Produzidas Num Bico de Gás Considerando As Proporções Relativas Dos Gase1Documento2 páginasDiscutir As Diferenças Entre Os Tipos Possíveis de Chamas Produzidas Num Bico de Gás Considerando As Proporções Relativas Dos Gase1karine_sperling50% (2)
- It30 Fogos de Artifício e PirotecniaDocumento19 páginasIt30 Fogos de Artifício e PirotecniaKézia NatalyAinda não há avaliações
- Quimica Relatorio ExperiementalDocumento9 páginasQuimica Relatorio ExperiementalFernando Silva MonteiroAinda não há avaliações
- Tabela Recomendacao CaminhaoDocumento1 páginaTabela Recomendacao CaminhaoMarília MeneguzzoAinda não há avaliações
- Quimica Ambiental 3anoDocumento6 páginasQuimica Ambiental 3anoJay PaulinhaAinda não há avaliações
- Manual IncendiosDocumento49 páginasManual IncendiosJoana MadailAinda não há avaliações
- Tratamento Termico SuperficiaisDocumento96 páginasTratamento Termico SuperficiaisGustavoSilva100% (1)
- Pureza e RendimentoDocumento1 páginaPureza e RendimentoEdilson JuniorAinda não há avaliações
- NBR 14461Documento16 páginasNBR 14461Eduardo MatosAinda não há avaliações
- LIVRO Concreto Armado Vol. 1Documento135 páginasLIVRO Concreto Armado Vol. 1Kimberley HollandAinda não há avaliações
- Cinetica QuimicaDocumento54 páginasCinetica QuimicaVioleta ValèryAinda não há avaliações
- Cinética Química - IntroduçãoDocumento34 páginasCinética Química - IntroduçãoEdson Miranda MarquesAinda não há avaliações
- Catalogo Epi Mrs TerceirizadasDocumento36 páginasCatalogo Epi Mrs TerceirizadasIgor Vernetti AzambujaAinda não há avaliações
- Preparo de Água CloradaDocumento2 páginasPreparo de Água CloradaJoemar Mendes Rego100% (1)
- Estudo Dirigido 01 ToxicologiaDocumento3 páginasEstudo Dirigido 01 ToxicologiaJullyara UlhAinda não há avaliações
- Sercon Reverse Osmosis PDFDocumento7 páginasSercon Reverse Osmosis PDFFelipe0% (1)