Escolar Documentos
Profissional Documentos
Cultura Documentos
FERIAS AULA 2 - CINÉTICA - Velocidade de Reação
Enviado por
Sara MartinsTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
FERIAS AULA 2 - CINÉTICA - Velocidade de Reação
Enviado por
Sara MartinsDireitos autorais:
Formatos disponíveis
QUÍMICA
CIRO TEIXEIRA
Velocidade de Reação
Cinética
01- (Covest) Óxidos de nitrogênio, NOx, são d) N2, H2 e NH3
substâncias de interesse ambiental, pois são e) H2, NH3 e N2
responsáveis pela destruição de ozônio na
atmosfera, e, portanto, suas reações são 03- A revelação de uma imagem fotográfica em
amplamente estudadas. Num dado experimento, um filme é um processo controlado pela cinética
em um recipiente fechado, a concentração de química da redução do halogeneto de prata por
NO2 em função do tempo apresentou o seguinte um revelador. A tabela abaixo mostra o tempo de
comportamento: revelação de um determinado filme, usando um
revelador D-76.
nº de mols do tempo de revelação
revelador (min)
24 6
22 7
21 8
20 9
18 10
A velocidade média (vm) de revelação, no
intervalo de tempo de 6 min a 10 min, é:
a) - 1,5 mols de revelador / min.
O papel do NO2 neste sistema reacional
b) 2,62 mols deé: revelador / min.
a) reagente. c) 1,5 mols de revelador / min.
b) intermediário. d) - 1,33 mols de revelador / min.
c) produto. e) 0,7 mol de revelador / min.
d) catalisador.
e) inerte 04- (FMIt-MG) Numa reação completa de
combustão, foi consumido, em 5 minutos, 0,25
02- (Covest) No início do século XX, a mol de metano, que foi transformado em CO 2 +
expectativa da Primeira Guerra Mundial gerou H2O. A velocidade da reação será:
uma grande necessidade de compostos a) 0,8 mol/min
nitrogenados. Haber foi o pioneiro na produção de b) 0,4 mol/min
amônia, a partir do nitrogênio do ar. Se a amônia c) 0,05 mol/min
for colocada num recipiente fechado, sua d) 0,6 mol/min
decomposição ocorre de acordo com a seguinte e) 0,3 mol/min
equação química não balanceada:
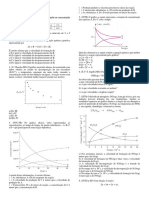
NH3(g) N2(g) + H2(g). 05- (UVA-CE) Em determinada experiência, a
As variações das concentrações com o reação de formação da água está ocorrendo com
tempo estão ilustradas na figura abaixo: o consumo de 4 mols de oxigênio por minuto.
Consequentemente, a velocidade de consumo de
hidrogênio é de:
a) 2 mol/min
b) 4 mol/min
c) 8 mol/min
d) 12 mol/min
e) 24 mol/min
06- (Pucmg) Considere a seguinte reação
química:
N2(g) + 2 O2(g) → 2 NO2(g), em que a velocidade
da reação obedece à equação:
V = K [N2] [O2]2
Triplicando a concentração moL/L de gás
A partir da análise da figura acima, nitrogênio e duplicando a concentração moL/L de
podemos afirmar que as curvas A, B e C gás oxigênio e mantendo as demais condições
representam a variação temporal das constantes, nota-se que a velocidade da reação:
concentrações dos seguintes componentes da a) permanece constante.
reação, respectivamente: b) triplica.
a) H2, N2 e NH3 c) aumenta seis vezes.
b) NH3, H2 e N2 d) aumenta nove vezes.
c) NH3, N2 e H2 e) aumenta doze vezes.
QUÍMICA
CIRO TEIXEIRA
Velocidade de Reação
Cinética
composto. Sendo assim, os dados da tabela
07- (URCA – CE) A obtenção da amônia (NH 3) abaixo mostram uma situação hipotética da
ocorre a partir de hidrogênio (H2) e nitrogênio obtenção do composto "C", a partir dos reagentes
(N2). A lei de velocidade para essa reação é V = k A e "B".
· [H2]3 · [N2].
Quando a concentração de hidrogênio é
duplicada e a concentração de nitrogênio é
triplicada, mantendo-se constante a temperatura,
é correto afirmar que:
a) a velocidade final não é alterada.
b) a velocidade final é 24 vezes a velocidade A partir dos dados da tabela acima, é correto
inicial. afirmar que a reação: A + B → C, é de:
c) a velocidade final é 6 vezes a velocidade a) 2.ª ordem em relação a “A” e de ordem zero
inicial. em
d) a velocidade final é 18 vezes a velocidade relação a “B”
inicial. b) 1.ª ordem em relação a “A” e de ordem zero
e) a velocidade final é 54 vezes a velocidade em
inicial relação a “B”
c) 2.ª ordem em relação a “B” e de ordem zero em
08- (PUC-SP) A reação de oxirredução que relação a “A”
ocorre d) 1.ª ordem em relação a “B” e de ordem zero
entre os íons brometo, Br1–, e bromato, BrO3−, em em
meio ácido, formando o bromo, Br2, é relação
representada
pela equação: 10- (Fuvest) Em solução aquosa ocorre a
transformação:
Um estudo cinético dessa reação em função das
concentrações dos reagentes foi efetuado, e os Em quatro experimentos, mediu-se o tempo
dados obtidos estão listados na tabela a seguir. decorrido para a formação de mesma
concentração de I2, tendo-se na mistura de
reação as seguintes concentrações iniciais de
reagentes:
Considerando as observações experimentais, Esses dados indicam que a velocidade da reação
pode-se concluir que a lei de taxa de considerada depende apenas da concentração
desenvolvimento da de:
reação é a) H2O2 e I-.
a) Td = k ∙ [BrO31–] ∙ [Br1–] ∙ [H1+] b) H2O2 e H+.
b) Td = k ∙ [BrO31–] ∙ [Br1–]5 ∙ [H1+]6 c) H2O2.
c) Td = k ∙ [BrO31–]2 ∙ [Br1–]6 ∙ [H1+]4 d) H+.
d) Td = k ∙ [BrO31–] ∙ [Br1–]3 ∙ [H1+]2 e) I-.
e) Td = k ∙ [BrO31–] ∙ [Br1–] ∙ [H1+]2
09- (UEPA) De um modo geral, a ordem de uma
reação é importante para prever a dependência
de sua velocidade em relação aos seus
reagentes, o que pode influenciar ou até mesmo
inviabilizar a obtenção de um determinado
Você também pode gostar
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Est Dirigido Cineticaqui-1Documento6 páginasEst Dirigido Cineticaqui-1Zoé AraújoAinda não há avaliações
- Cinética química: fatores que influenciam a velocidade das reaçõesDocumento6 páginasCinética química: fatores que influenciam a velocidade das reaçõesDébora SaraAinda não há avaliações
- Velocidade de reações químicasDocumento10 páginasVelocidade de reações químicasAlana SantosAinda não há avaliações
- Química 2 Ano - Iii Unid - Cinética QuímicaDocumento41 páginasQuímica 2 Ano - Iii Unid - Cinética QuímicaJuca GordoAinda não há avaliações
- 2º Ano - Exercício Avaliativo - Cinética QuimicaDocumento2 páginas2º Ano - Exercício Avaliativo - Cinética Quimicahelenafrancoamorimfox2Ainda não há avaliações
- Cinética .PPTX 0b38f14e5e474e08828c9b - PFLMKDRDocumento40 páginasCinética .PPTX 0b38f14e5e474e08828c9b - PFLMKDRGilvanilza OLIVEIRAAinda não há avaliações
- Velocidade de reações químicasDocumento29 páginasVelocidade de reações químicasnatale_carvalhoAinda não há avaliações
- Velocidade de reações químicasDocumento26 páginasVelocidade de reações químicasJhonatas GouveiaAinda não há avaliações
- Lista de Exercícios de Cinética QuímicaDocumento2 páginasLista de Exercícios de Cinética QuímicarebecafurbyscarneiropaulaAinda não há avaliações
- Exercícios Cinética Com RespostaDocumento29 páginasExercícios Cinética Com Respostagreicifrauches57% (7)
- Cinética Química IDocumento50 páginasCinética Química IArthur ViníciusAinda não há avaliações
- Cinética e equilíbrio químico: decomposição de peróxido de hidrogênio e equilíbrio químico do Hb e CODocumento2 páginasCinética e equilíbrio químico: decomposição de peróxido de hidrogênio e equilíbrio químico do Hb e CORonaltAinda não há avaliações
- Equilíbrio QuímicoDocumento31 páginasEquilíbrio QuímicoJulioAinda não há avaliações
- Questões de cinética química e velocidade de reaçãoDocumento3 páginasQuestões de cinética química e velocidade de reaçãopedroaugusto1313Ainda não há avaliações
- Exercício de CinéticaDocumento7 páginasExercício de CinéticaIsaque MouraAinda não há avaliações
- Lista de Exercicios Cinetica Quimica EQM061Documento13 páginasLista de Exercicios Cinetica Quimica EQM061Mariana DomicianoAinda não há avaliações
- Lista de exercícios de cinética químicaDocumento4 páginasLista de exercícios de cinética químicasebottendorfAinda não há avaliações
- Velocidade média de reações químicasDocumento2 páginasVelocidade média de reações químicasRtyu IuytAinda não há avaliações
- Lista de Exercícios Cinética QuímicaDocumento6 páginasLista de Exercícios Cinética QuímicagabezmirandaAinda não há avaliações
- Lista de exercícios de química com reações químicasDocumento2 páginasLista de exercícios de química com reações químicasAna Maria DinizAinda não há avaliações
- Exercicios de Fisico-QuimicaDocumento2 páginasExercicios de Fisico-QuimicaFellipe LimaAinda não há avaliações
- q3 - Aula 21 A 22 - Cinét Ica Quimica I AulaDocumento2 páginasq3 - Aula 21 A 22 - Cinét Ica Quimica I AulaAnanda MuxAinda não há avaliações
- Alfa - Módulo 37Documento23 páginasAlfa - Módulo 37Jackson Rodrigo Sousa PintoAinda não há avaliações
- Velocidade Das Reações - ÍtaloDocumento8 páginasVelocidade Das Reações - ÍtaloItalo PiresAinda não há avaliações
- Lista 1.cinética QuímicaDocumento6 páginasLista 1.cinética Químicagiovannaluiza1323Ainda não há avaliações
- Lista Exercícios CinéticaB - 23Documento8 páginasLista Exercícios CinéticaB - 23isamatias01Ainda não há avaliações
- Cinética químicaDocumento6 páginasCinética químicaRanked PlayerAinda não há avaliações
- Cinética Química: Fatores e ExpressõesDocumento4 páginasCinética Química: Fatores e ExpressõesLourdilene BritoAinda não há avaliações
- Reação química: cinética e fatores que influenciam a velocidadeDocumento10 páginasReação química: cinética e fatores que influenciam a velocidadeErick Teckio100% (1)
- Cine TicaDocumento37 páginasCine TicaLala AssisAinda não há avaliações
- Nome: - Nº - Turma - DataDocumento3 páginasNome: - Nº - Turma - DataGiovana CoutoAinda não há avaliações
- Zabibe QuimicaDocumento6 páginasZabibe QuimicaMarmun Chivanguire ChivanguireAinda não há avaliações
- Fun Cao Quadratic A 2012Documento2 páginasFun Cao Quadratic A 2012MÁRIO LIMAAinda não há avaliações
- Introdução à Química ExperimentalDocumento2 páginasIntrodução à Química ExperimentalmamaemtolokoAinda não há avaliações
- CNPJDocumento5 páginasCNPJDavi AraújoAinda não há avaliações
- Cinetica ExercDocumento3 páginasCinetica ExercCamila BarreirosAinda não há avaliações
- Cinética Química - Velocidade Média de Uma Reação QuímicaDocumento12 páginasCinética Química - Velocidade Média de Uma Reação QuímicaKim LinaAinda não há avaliações
- Cinetica Quimica If ExercDocumento5 páginasCinetica Quimica If ExercRaquel Andreola ValenteAinda não há avaliações
- 7 Lista QGE2001 CineticaDocumento5 páginas7 Lista QGE2001 CineticaWashington RamosAinda não há avaliações
- Lista Cinética 2023 - 2TDocumento2 páginasLista Cinética 2023 - 2TRafael playeraleAinda não há avaliações
- Cinética QuímicaDocumento6 páginasCinética QuímicaSirlei Gonçalves PoffoAinda não há avaliações
- Cinetica-Quimica EXERCICIOSDocumento2 páginasCinetica-Quimica EXERCICIOScarlostucupiAinda não há avaliações
- Lista Cinética QuímicaDocumento6 páginasLista Cinética QuímicavfmgarciaAinda não há avaliações
- Cinética Química: Velocidade de ReaçõesDocumento4 páginasCinética Química: Velocidade de ReaçõesOFito FernandesAinda não há avaliações
- Cinética Química - Exercicios 08-10-2022Documento8 páginasCinética Química - Exercicios 08-10-2022FELIPE SILVAAinda não há avaliações
- LISTA_DE_EXERCCIOS_Tpico_7_e_8Documento4 páginasLISTA_DE_EXERCCIOS_Tpico_7_e_8a.mendesAinda não há avaliações
- Cinética Química - Lista de ExercíciosDocumento6 páginasCinética Química - Lista de ExercíciosRamonquimicoAinda não há avaliações
- Cinética Química - ExercíciosDocumento6 páginasCinética Química - ExercíciosRafael AldreemAinda não há avaliações
- Cine TicaDocumento37 páginasCine TicaWingston WalterAinda não há avaliações
- 21Documento5 páginas21gabezmirandaAinda não há avaliações
- Lista de apoio química trimestralDocumento5 páginasLista de apoio química trimestralThaayna BarroosAinda não há avaliações
- Exercícios de Cinética Química Prof. Flokinho: 2 3 2 (G) 3 (G) 3 (G) 2 (G)Documento2 páginasExercícios de Cinética Química Prof. Flokinho: 2 3 2 (G) 3 (G) 3 (G) 2 (G)Sara LunaAinda não há avaliações
- Cinética QuimicaDocumento26 páginasCinética QuimicaTais Kaspary SchmittAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Tratamento de Lodos de Estações de Tratamento de ÁguaNo EverandTratamento de Lodos de Estações de Tratamento de ÁguaAinda não há avaliações
- Desenvolvendo Um Datalogger E Armazenando No Arquivo Formato Csv Para Medir Concentração De H2 Com PicNo EverandDesenvolvendo Um Datalogger E Armazenando No Arquivo Formato Csv Para Medir Concentração De H2 Com PicAinda não há avaliações
- Texto 2 - ResuminhoDocumento2 páginasTexto 2 - ResuminhoSilva AdriannyAinda não há avaliações
- Química Geral Análise Imediata (Processos de Separação de Misturas)Documento1 páginaQuímica Geral Análise Imediata (Processos de Separação de Misturas)Quimica PasseiAinda não há avaliações
- Cálculo da pressão em tubulação de abastecimento de águaDocumento9 páginasCálculo da pressão em tubulação de abastecimento de águaFísica com o BrunoAinda não há avaliações
- FOSFATIZAÇÃODocumento16 páginasFOSFATIZAÇÃOReginaldo JulioAinda não há avaliações
- Tabela Periódica dos Elementos QuímicosDocumento2 páginasTabela Periódica dos Elementos QuímicosWendell SilvaAinda não há avaliações
- Vestibular 2023 Medicina UnimesDocumento38 páginasVestibular 2023 Medicina UnimesMikael VitalAinda não há avaliações
- Lista de Exercícios - ÁcidosDocumento9 páginasLista de Exercícios - ÁcidosMarinaaaAinda não há avaliações
- Placa Mantex PPDocumento4 páginasPlaca Mantex PPAndre CardosoAinda não há avaliações
- Deterioração de Óleos Vegetais Expostos A Diferentes Condições de ArmazenamentoDocumento7 páginasDeterioração de Óleos Vegetais Expostos A Diferentes Condições de ArmazenamentoTaís GuimarãesAinda não há avaliações
- TD Geral de Química Geral PDFDocumento10 páginasTD Geral de Química Geral PDFJuliana SousaAinda não há avaliações
- Centrifuga Q214M - Q222TMDocumento23 páginasCentrifuga Q214M - Q222TMGordin BrAinda não há avaliações
- Quadros 2.1 e 2.2Documento3 páginasQuadros 2.1 e 2.2Daniel FonsecaAinda não há avaliações
- Sistema ATP-CP e glicólise anaeróbia no metabolismo muscularDocumento14 páginasSistema ATP-CP e glicólise anaeróbia no metabolismo muscularRicardo FurtadoAinda não há avaliações
- Lista 1 Quimica Orgânica Fisica UNESP 2017Documento3 páginasLista 1 Quimica Orgânica Fisica UNESP 2017Natali JubramAinda não há avaliações
- 2 Atividade de QUÍMICA 2024 05.03.2024Documento2 páginas2 Atividade de QUÍMICA 2024 05.03.2024allanacarvalhosilvaAinda não há avaliações
- Modulo 3 FisicaDocumento85 páginasModulo 3 Fisicagerson Million Nyambi100% (2)
- Lista de Produtos ControladosDocumento41 páginasLista de Produtos ControladosIsmael PereiraAinda não há avaliações
- Processos polimerização polímeros fluoradosDocumento16 páginasProcessos polimerização polímeros fluoradosEmmerickAinda não há avaliações
- Desingraxante Biodegradável PHDocumento5 páginasDesingraxante Biodegradável PHtairizekrolow96Ainda não há avaliações
- TEC - 2021 Energia TrabalhoDocumento14 páginasTEC - 2021 Energia TrabalhoRicardo FísicaAinda não há avaliações
- Óptica - Refração em dióptros planosDocumento17 páginasÓptica - Refração em dióptros planosEmerson SantosAinda não há avaliações
- Síntese de cumarinas via condensação de PechmannDocumento1 páginaSíntese de cumarinas via condensação de PechmannChristianne PeraliAinda não há avaliações
- Catalogo Smart Floor 2022Documento10 páginasCatalogo Smart Floor 2022Fabio DiasAinda não há avaliações
- Superfícies e Interfaces: Conceitos GeraisDocumento6 páginasSuperfícies e Interfaces: Conceitos Geraisbiaengquimica100% (1)
- Modelo PGR - Planilha de RiscoDocumento14 páginasModelo PGR - Planilha de RiscoEdson FigueiredoAinda não há avaliações
- Pressões Anormais e SegurançaDocumento25 páginasPressões Anormais e Segurançamanokleber6948Ainda não há avaliações
- FISPQ DTDM Acelerador de VulcanizaçãoDocumento7 páginasFISPQ DTDM Acelerador de Vulcanizaçãoqualidade promasqAinda não há avaliações
- AULA 6 - Dimensionamento de Ligacoes Soldadas.Documento8 páginasAULA 6 - Dimensionamento de Ligacoes Soldadas.Angelo NhamuaAinda não há avaliações
- Resilit EPN: argamassa para assentamento de cerâmicas anticorrosivasDocumento2 páginasResilit EPN: argamassa para assentamento de cerâmicas anticorrosivasVictor Luis de OliveiraAinda não há avaliações
- Química Geral II - Atividades ExperimentaisDocumento46 páginasQuímica Geral II - Atividades ExperimentaisTaciana GuarnieriAinda não há avaliações