100% acharam este documento útil (2 votos)
179 visualizações3 páginasLista de Exercícios de Modelos Atômicos
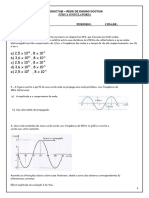
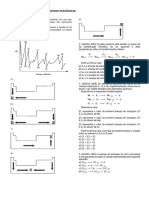
O documento apresenta uma lista de questões sobre modelos atômicos propostos por diferentes cientistas ao longo da história. As questões abordam os modelos de Dalton, Thomson, Rutherford e Bohr, descrevendo as principais características e diferenças entre eles.
Enviado por
Marcelo SilvaDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato PDF, TXT ou leia on-line no Scribd
100% acharam este documento útil (2 votos)
179 visualizações3 páginasLista de Exercícios de Modelos Atômicos
O documento apresenta uma lista de questões sobre modelos atômicos propostos por diferentes cientistas ao longo da história. As questões abordam os modelos de Dalton, Thomson, Rutherford e Bohr, descrevendo as principais características e diferenças entre eles.
Enviado por
Marcelo SilvaDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato PDF, TXT ou leia on-line no Scribd