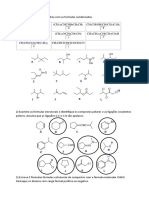
Escolar Documentos
Profissional Documentos
Cultura Documentos
Quimica Cap9
Enviado por
pedroteixeirasales01Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Quimica Cap9
Enviado por
pedroteixeirasales01Direitos autorais:
Formatos disponíveis
QUÍMICA
Resoluções
b) Ácido nítrico (HNO3)
Capítulo 9
Ligações químicas II
Uma ligação covalente coordenada.
ATIVIDADES PARA SALA c) Ácido sulfúrico (H2SO4)
01 B
Gás carbônico (CO2): Duas ligações covalentes coordenadas.
d) Ácido fosfórico (H3PO4)
(Quatro ligações covalentes normais)
Dióxido de enxofre (SO2):
(Duas ligações covalentes normais e uma covalente Uma ligação covalente coordenada.
coordenada (dativa))
e) Ácido perclórico (HCO4)
Água (H2O):
(Duas ligações covalentes normais)
Três ligações covalentes coordenadas.
Metano (CH4):
04 a) I. Na fórmula do Na2SO4, estão presentes os íons Na+
e SO2−
4 , o que caracteriza o composto como iônico.
II. Na fórmula do KCN, estão presentes os íons K+ e
NC–, o que caracteriza o composto como iônico.
(Quatro ligações covalentes normais) III. No composto N2O5, são estabelecidas ligações
covalentes entre os não metais nitrogênio (N) e
02 C oxigênio (O), o que justifica a classificação do com-
posto como molecular.
A região indicada corresponde a elementos metálicos que
são bons condutores de eletricidade. São substâncias sóli- b) I.
das, não reagem com sódio e formam cátions quando rea-
gem com não metais.
03 E
Para escrever a fórmula estrutural plana dos oxiácidos inor-
gânicos, lembre-se de que o hidrogênio se liga ao oxigê-
nio, e este ao átomo central do elemento químico que dá II.
nome ao ácido.
a) Ácido carbônico (H2CO3)
III.
Não apresenta nenhuma ligação covalente coordenada.
1a série – Ensino Médio – Livro 3 1
QUÍMICA
05 a) Fórmula iônica: K3PO4
Fórmula estrutural:
B é uma substância molecular, pois apresenta baixas
temperaturas de fusão e de ebulição.
C é um metal, pois, em qualquer fase de agregação,
conduz corrente elétrica.
D é um composto iônico, pois, quando na fase sólida,
não conduz corrente elétrica.
b) Fórmula iônica: CaCO3
Fórmula estrutural: 04 C
a) (F)
HNO3: H2CO3:
c) Fórmula iônica: NH4CO4
Fórmula estrutural:
H b) (F)
O O
O3: O2:
H N H C
O O
H
c) (V)
H3O+: CO2− :
ATIVIDADES PROPOSTAS
01 D
Na molécula de H2SO4, há 4 ligações covalentes normais e
2 ligações covalentes coordenadas. d) (F)
O H2O2: HCN:
H O S O H
O
e) (F)
02 A
HBrO: CO:
Sabe-se que a ligação iônica ocorre entre átomo de elemento
metálico e átomo de elemento não metálico. A ligação cova-
lente ocorre entre átomos de elementos não metálicos e
átomos de hidrogênio, entre átomos de hidrogênio e entre 05 A
átomos de elementos não metálicos. Já a ligação metálica
Em I, X pode ser N ou P.
ocorre entre átomos de elementos metálicos.
Dessa forma, as ligações entre os átomos dos elementos HNO3:
metálicos Ca e Na com os átomos dos elementos não
metálicos O e C, respectivamente nos compostos CaO e
NaC, são iônicas. Entre o átomo do elemento não metá-
lico N com o átomo de H, há ligação covalente polar, visto HPO3:
que o nitrogênio é mais eletronegativo que o hidrogênio.
Já entre os átomos do elemento C no C2, há ligação
covalente apolar, visto que não há diferença de eletrone-
gatividade entre eles. No chumbo (Pb(s)), a ligação é metá- Em II, X pode ser somente C.
lica, já que ocorre entre átomos do elemento metálico Pb.
H2CO3:
03 E
Após análise da tabela, conclui-se que:
A é um composto iônico, pois, quando na fase líquida,
é condutor de corrente elétrica. Em III, X pode ser S ou Se.
2 1a série – Ensino Médio – Livro 3
QUÍMICA
H2SO4:
H2SeO4: 10 a) KIO3:
b) Na2SO4:
Em IV, X pode ser somente o P.
H3PO4:
c) MgCO3:
06 E
O fato de ser um arranjo de íons metálicos distribuídos
em uma nuvem eletrônica formada por elétrons semilivres
dotados de um certo movimento justifica a propriedade
que os metais possuem de conduzir corrente elétrica e
calor, tanto na fase sólida como na fase líquida.
07 A
S1: Para ser bom condutor elétrico no estado sólido, o
composto deve ser metálico.
S2: Por não conduzir eletricidade no estado sólido nem no
líquido, o composto deve ser covalente.
S3: Não conduz eletricidade no estado sólido, mas, quando
fundido, seus íons ficam livres, conduzindo corrente elétrica;
logo, é iônico.
08 a)
b)
c)
09 H3PO4:
H3O+:
PO3−
4 :
1a série – Ensino Médio – Livro 3 3
Você também pode gostar
- Exercícios Ligações QuímicasDocumento3 páginasExercícios Ligações QuímicasNathalya BeatrizAinda não há avaliações
- Ligações QuímicasDocumento3 páginasLigações QuímicasBruna StawinskiAinda não há avaliações
- Projeto Med Ligações QuimicasDocumento12 páginasProjeto Med Ligações Quimicassofia brasileiroAinda não há avaliações
- P01070903 - 9 Avaliação de Química 9º Ano 3º BimestreDocumento2 páginasP01070903 - 9 Avaliação de Química 9º Ano 3º BimestreVanessa BorgesAinda não há avaliações
- Lista de Exercícios - Geometria e Forças IntermolecularesDocumento7 páginasLista de Exercícios - Geometria e Forças Intermolecularesalexchacal67% (3)
- Ligação QuímicaDocumento2 páginasLigação Químicaalexchacal100% (2)
- POLARIDADEDocumento16 páginasPOLARIDADEDangley CoserAinda não há avaliações
- FF3.4 - 2.1.3 - CCDocumento4 páginasFF3.4 - 2.1.3 - CCiolaAinda não há avaliações
- Lista de Exercícios QuímicaDocumento18 páginasLista de Exercícios QuímicaRalac MajavAinda não há avaliações
- Revisão Química 2Documento6 páginasRevisão Química 2pixkaraAinda não há avaliações
- A - Bases e Sais - Exercícios AprofundadosDocumento6 páginasA - Bases e Sais - Exercícios AprofundadoslfsytpAinda não há avaliações
- Lista 11 - Polaridade Das Moléculas e Forças IntermolecularesDocumento2 páginasLista 11 - Polaridade Das Moléculas e Forças IntermolecularesVinícius Oliveira da Silva PintoAinda não há avaliações
- Química polaridade e interaçõesDocumento3 páginasQuímica polaridade e interaçõesJúlia PioAinda não há avaliações
- Forças intermoleculares determinam propriedades de substânciasDocumento2 páginasForças intermoleculares determinam propriedades de substânciasJunior MottaAinda não há avaliações
- Atividade Complementar 2 - 1º Ano - 3 EtapaDocumento3 páginasAtividade Complementar 2 - 1º Ano - 3 EtapaWard LauarAinda não há avaliações
- Alfa - Módulo 23Documento8 páginasAlfa - Módulo 23PedroAinda não há avaliações
- 11 20polaridade 20de 20mol C3 A9culasDocumento5 páginas11 20polaridade 20de 20mol C3 A9culasTatiana Ronsani MartinsAinda não há avaliações
- 06-03 - Ligações Químicas - Ligação CovalenteDocumento12 páginas06-03 - Ligações Químicas - Ligação CovalenteThais DantasAinda não há avaliações
- Ligações Químicas ExercíciosDocumento2 páginasLigações Químicas ExercíciosRafael Ramos Castellari100% (1)
- Ressonância, Carga Formal e Ligação QuímicaDocumento4 páginasRessonância, Carga Formal e Ligação QuímicaNicole FariasAinda não há avaliações
- Lista Ligaçoes 1Documento1 páginaLista Ligaçoes 1rubens.costaAinda não há avaliações
- Ligação Química e Natureza de CompostosDocumento3 páginasLigação Química e Natureza de CompostosJean Neves dos Santos SerraAinda não há avaliações
- 3AV2 QUIM 1EM ANA TipoADocumento2 páginas3AV2 QUIM 1EM ANA TipoAAna Célia FerreiraAinda não há avaliações
- Lista de exercícios sobre polaridade molecular e forças intermolecularesDocumento3 páginasLista de exercícios sobre polaridade molecular e forças intermolecularesAna Célia FerreiraAinda não há avaliações
- Exercícios extras de estrutura químicaDocumento4 páginasExercícios extras de estrutura químicajlopesscridbAinda não há avaliações
- Ligacoes QuimicasDocumento5 páginasLigacoes QuimicasJamirJamirJamirAinda não há avaliações
- QuimicaDocumento12 páginasQuimicaHellyan WilkerAinda não há avaliações
- Quimica 1 Exercicios Anamnese 5Documento6 páginasQuimica 1 Exercicios Anamnese 5Prof GabrielaAinda não há avaliações
- Ligações Químicas: Tipos de Ligações em CompostosDocumento6 páginasLigações Químicas: Tipos de Ligações em Compostoslorenzo flores dalla corteAinda não há avaliações
- (2022.03.24) Ligação Covalente Parte 3Documento1 página(2022.03.24) Ligação Covalente Parte 3LahimAinda não há avaliações
- Ficha de treino FQ10 - Ligações intermolecularesDocumento3 páginasFicha de treino FQ10 - Ligações intermolecularesMiguel AntonioAinda não há avaliações
- Pro Aulas14e15 - Estudos Dos Acidos-2Documento3 páginasPro Aulas14e15 - Estudos Dos Acidos-2isabelsm174Ainda não há avaliações
- Alista 06 - Geometria e Polaridade Das Moelculas - Inmteracoes IntermolecularesDocumento6 páginasAlista 06 - Geometria e Polaridade Das Moelculas - Inmteracoes IntermolecularesHeitorAinda não há avaliações
- Lista ComplementarDocumento2 páginasLista ComplementarVagner EbreAinda não há avaliações
- Propriedades periódicas e ligação químicaDocumento5 páginasPropriedades periódicas e ligação químicaCursinho AcepuspAinda não há avaliações
- Química - Pré-Vestibular Impacto - Geometria MolecularDocumento2 páginasQuímica - Pré-Vestibular Impacto - Geometria MolecularQuímica Qui100% (5)
- Química Orgânica FundamentosDocumento54 páginasQuímica Orgânica Fundamentos10a06100% (1)
- 3 Lista de Exerccios - Ligao QumicaDocumento2 páginas3 Lista de Exerccios - Ligao QumicaGeorginerio M. SampaioAinda não há avaliações
- Lista Exercicios LigaçõesDocumento2 páginasLista Exercicios LigaçõesEric garciaAinda não há avaliações
- Aula 3Documento9 páginasAula 3JULINNAAinda não há avaliações
- Prova Química ITA 1989Documento10 páginasProva Química ITA 1989jbmccavalcantiAinda não há avaliações
- Aula 11 - Exercícios Ligações Químicas e Tabela Periódica (Sem Gabarito) - 30-05Documento2 páginasAula 11 - Exercícios Ligações Químicas e Tabela Periódica (Sem Gabarito) - 30-05Ana Paula Rodrigues100% (1)
- Lista 2Documento2 páginasLista 2Marcilio Santos SilvaAinda não há avaliações
- Ligações QuímicasDocumento2 páginasLigações QuímicasEduardo KonradAinda não há avaliações
- SESI 032 Catumbi Avaliação dissertativa QuímicaDocumento4 páginasSESI 032 Catumbi Avaliação dissertativa Químicanatalia LinsAinda não há avaliações
- Revisão de propriedades de compostos químicosDocumento2 páginasRevisão de propriedades de compostos químicosbernardo bastosAinda não há avaliações
- Ligações Químicas ExercíciosDocumento23 páginasLigações Químicas ExercíciosVinicius Pantoja100% (2)
- Ligação química e estrutura molecularDocumento16 páginasLigação química e estrutura molecularJustina VieiraAinda não há avaliações
- Ligações químicas, Forças intermoleculares e Geometria molecularDocumento4 páginasLigações químicas, Forças intermoleculares e Geometria molecularRayane MariaAinda não há avaliações
- LISTA DE EXERCI769CIOS To769pico 2Documento3 páginasLISTA DE EXERCI769CIOS To769pico 2Davi Marçal RibeiroAinda não há avaliações
- Geometria MolecularDocumento4 páginasGeometria MolecularemyllekAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Aços Inoxidáveis - Corrosão E Métodos Para DetecçãoNo EverandAços Inoxidáveis - Corrosão E Métodos Para DetecçãoAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Lorraine Heath Presente de DespedidaDocumento419 páginasLorraine Heath Presente de DespedidaSHIRLEY100% (1)
- Primeiros Socorros Básico ProvaDocumento5 páginasPrimeiros Socorros Básico ProvaDcastro Soares80% (5)
- Contabilidade Gerencial, Slides - Rosana (CEFIS)Documento85 páginasContabilidade Gerencial, Slides - Rosana (CEFIS)tjesuscAinda não há avaliações
- Unicesumar - Atividade 04 - GODocumento4 páginasUnicesumar - Atividade 04 - GOGabrielAinda não há avaliações
- Equipamentos para corte e recolha de forragensDocumento26 páginasEquipamentos para corte e recolha de forragensAndré QuirinoAinda não há avaliações
- Carta para resolver dor de perda de amizadeDocumento4 páginasCarta para resolver dor de perda de amizadeJoão Emílio Damaceno dos SantosAinda não há avaliações
- EMH FREIO A DISCO MANUAL MANUTENÇÃO FDE COM ALAVANCA Rev SensorDocumento29 páginasEMH FREIO A DISCO MANUAL MANUTENÇÃO FDE COM ALAVANCA Rev SensorArnaldo Mazzei100% (3)
- O significado cultural do lenço de cabeça afro-americanoDocumento22 páginasO significado cultural do lenço de cabeça afro-americanoLuciana GorgonhaAinda não há avaliações
- ChatGPT É Um Grande Plagiador Do Trabalho e Criatividade HumanosDocumento2 páginasChatGPT É Um Grande Plagiador Do Trabalho e Criatividade Humanoseu.brunonettoAinda não há avaliações
- Boletos NF 5891 - Lubricela Lubrificantes LtdaDocumento6 páginasBoletos NF 5891 - Lubricela Lubrificantes Ltdayascela2023Ainda não há avaliações
- Relatório de EstágioDocumento48 páginasRelatório de EstágioSergio Luis Brockveld Jr.Ainda não há avaliações
- 52 Aula 3 Série Filosofia Kant e o Juízo de Gosto IIDocumento23 páginas52 Aula 3 Série Filosofia Kant e o Juízo de Gosto IINathan CamiloAinda não há avaliações
- (Aluno) Av. Form Mat 2anoDocumento11 páginas(Aluno) Av. Form Mat 2anoFernanda Lima de Pinho Reis ReisAinda não há avaliações
- 6ºano Slides Aula 03Documento12 páginas6ºano Slides Aula 03MICHIELI OLIVEIRA RIBEIROAinda não há avaliações
- Tema Da Redação Do Enem 2023 É 'Desafios para o eDocumento1 páginaTema Da Redação Do Enem 2023 É 'Desafios para o evictoria.seabra26Ainda não há avaliações
- Normas para apresentação de ficheiros digitais em processos urbanísticosDocumento18 páginasNormas para apresentação de ficheiros digitais em processos urbanísticosPicaPauAmareloAinda não há avaliações
- Doc3 - ISO 9001 - Comunicação Interna PDFDocumento3 páginasDoc3 - ISO 9001 - Comunicação Interna PDFzeliaornelasAinda não há avaliações
- A Importancia Da Apicultura No BrasilDocumento6 páginasA Importancia Da Apicultura No BrasilGustavo DelgadoAinda não há avaliações
- Exercícios Funções SintáticasDocumento5 páginasExercícios Funções Sintáticasmariaduxa100% (1)
- Radiestesia - Reiki - e - Radiestesia - ApostilaDocumento368 páginasRadiestesia - Reiki - e - Radiestesia - ApostilaANDRÔMEDA.Ainda não há avaliações
- VampiroDocumento79 páginasVampiroLuiz Henrique Matias MarcondesAinda não há avaliações
- Jô Soares - Apresentador Perdoou Taxista Que Matou Sua MãeDocumento7 páginasJô Soares - Apresentador Perdoou Taxista Que Matou Sua MãetezsfsadfAinda não há avaliações
- Deficiência Mental e Fonoaudiologia - Passei DiretoDocumento8 páginasDeficiência Mental e Fonoaudiologia - Passei DiretoAlexsandraRibeiroAinda não há avaliações
- A Grande Fuga - Sylvio PereiraDocumento75 páginasA Grande Fuga - Sylvio Pereirahumb_santosAinda não há avaliações
- Teste de HistóriaDocumento8 páginasTeste de HistóriaFernando Jorge TeixeiraAinda não há avaliações
- Aula 09.replicação Do DNADocumento42 páginasAula 09.replicação Do DNArmdsAinda não há avaliações
- PALATORRAFIADocumento10 páginasPALATORRAFIAAndréia NunesAinda não há avaliações
- Heterósidos cardíacos: estrutura, classificação e atividadeDocumento30 páginasHeterósidos cardíacos: estrutura, classificação e atividadeIsabela Honorato100% (1)
- ROTEIRODocumento4 páginasROTEIROJeferson BrazAinda não há avaliações
- Como Baixar o Programa PDF em Meu ComputadorDocumento2 páginasComo Baixar o Programa PDF em Meu ComputadorGregAinda não há avaliações