Escolar Documentos
Profissional Documentos
Cultura Documentos
SOLUÇÕES
Enviado por
Juliane Froncheti de MouraDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
SOLUÇÕES
Enviado por
Juliane Froncheti de MouraDireitos autorais:
Formatos disponíveis
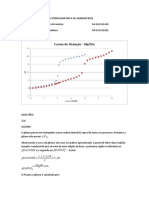
______________________________________________________________Qumica Geral e Experimental I SOLUES Tipos de Solues As solues podem ser classificadas quanto ao seu estado fsico: slido,
lquido ou gasoso. Tipos de Solues Gs Gs dissolvido em gua Lquido dissolvido em gs Slido dissolvido em gs Lquido Gs dissolvido em lquido Lquido dissolvido em lquido Slido dissolvido em lquido Slido Gs dissolvido em slido Lquido dissolvido em slido Slido dissolvido em slido Exemplos Oxignio dissolvido em nitrognio Clorofrmio dissolvido em nitrognio (vaporizado) Gelo seco dissolvido em nitrognio (sublimado) Dixido de carbono dissolvido em gua Etanol (lcool de cereais) dissolvido em gua Acar dissolvido em gua Hidrognio dissolvido em paldio Mercrio dissolvido em ouro Cobre dissolvido em nquel
Solues Gasosas Todos os gases misturam-se uniformemente um com o outro em qualquer proporo. As molculas esto distantes umas das outras e encontram-se em movimento rpido, colidindo frequentemente entre si e com as paredes dos recipientes. A nica diferena entre uma soluo gasosa e um gs puro que em uma soluo as molculas no so todas iguais. Exemplo: ar Solues Lquidas As partculas encontram-se dispostas prximas umas das outras, ainda apresentando certa ordem. Diferente de um lquido puro, uma soluo lquida composta de diferentes partculas. Solues Slidas Dois tipos de solues slidas so frequentes. A soluo slida substituinte exibe uma estrutura cristalina que tem regularidade estrutural, mas na qual a estrutura foi feita ao acaso. Exemplo: formao de NaCl. No segundo tipo de soluo slida, soluo slida intersticial, tomos diferentes, ons ou molculas ocupam vrtices e fissuras, no retculo hospedeiro. Exemplo: austenita, no qual tomos de carbono ocupam fissuras em um arranjo de tomos de ferro. Unidades de concentrao Em muitas solues um componente esta em excesso em relao aos outros. Este componente chamado solvente, e os outros componentes so chamados solutos. Exemplo1: uma soluo preparada com 1 g de sal de cozinha e 1 g de acar em 100 g de gua. A composio de uma soluo descrita quantitativamente as concentraes de seus componentes. As unidades de concentraes normalmente usadas incluem frao molar, percentagem molar, molaridade, percentagem em massa e normalidade. Frao Molar A frao molar, X,de um componente em uma soluo a razo de mols daquele componente pelo nmero de mols de todos os componentes. Sendo n o nmero de mols e designando os vrios componentes como A, B, C...podemos escrever: PAG 506 Exemplo 2: Se 28,6 g de sacarose (acar de cana, C 12H22O11) forem dissolvidos em 101,4 g de gua, qual a frao molar de sacarose na soluo? Percentagem molar Uma unidade de concentrao relativa a frao molar a percentagem molar, ou seja, o nmero de mols de um componente expresso como percentagem do nmero total de mols presentes: PAG 507 Exemplo 3: Qual a porcentagem molar da sacarose na soluo descrita no exemplo anterior?
Molaridade Molaridade ou concentrao molar o nmero de mols do soluto dissolvido por litro de soluo. Se nA representa o nmero de mols do soluto A, e V o volume da soluo em litros, ento: Molaridade de A = nA Vsoluo,L Uma soluo que contem 1,67 mol de soluto em um volume de 1,00 L considerada como uma soluo 1,67 M (escreve-se 1,67 mol/L). Exemplo 4: 10,0 g de acido ascrbico (vitamina C, H 2C6H6O6) so dissolvidos em gua suficiente para preparar 125 mL de soluo. Qual e a concentrao molar deste componente na soluo? PAG 508 Exemplo 5: Calcule a molaridade da sacarose do exemplo 2 citado na frao molar. A densidade da soluo 109 g/mL. Molalidade o nmero de mols de soluto dissolvido por quilograma de solvente. Assim, a molalidade do soluto A em soluo : Molalidade de A = nA Massa solvente,Kg Uma soluo contendo 3 mol de soluto por quilograma de solvente diz-se 3 molal, escreve-se 3m. Exemplo 6: Qual a molalidade da sacarose na soluo do exemplo 2? Porcentagem em massa Ou tambm conhecida como massa percentual, a quantidade de um componente de uma soluo expressa como uma porcentagem da massa total: % em massa de A = massa A Massa A + massa B + massa C... Exemplo 7: Qual a porcentagem em massa da sacarose na soluo do exemplo 2? Exerccios
1) Se 4,50 g de amnia, NH3, forem dissolvidos em 3,30 x 102 g de gua, qual ser a frao molar de amnia na soluo resultante? 2) Qual ser a porcentagem molar da amnia na soluo resultante na questo anterior? 3) 3,30 g de etanol, C2H5OH, so dissolvidos em gua suficiente para preparar um volume total de 0,150 L. Qual a molaridade do etanol? 4) 10,6 g de cloreto de amnio esto dissolvidos em 152,4 g de gua. Se a densidade da soluo 1,02 g/mL, qual a concentrao molar de NH4Cl? 5) Qual a molalidade da amnia em uma soluo preparada pela adio de 4,50 g de NH 3 em 3,3 x 102 g de H2O? 6) 4,50 g de amnia so dissolvidos em 3,30 x 102 g de gua. Qual a porcentagem do NH3 em massa?
7) Calcule a molaridade do soluto em cada uma das seguintes solues: a) 2,00 g de NaCl dissolvidos em 1,00 L de soluo b) 4,00 g de H2SO4 dissolvidos em 4,00 L de soluo c) 8,00 g de NaOH dissolvidos em 55,0 mL de soluo 8) Calcule a molalidade do soluto em cada uma das seguintes solues: a) 3,00 g de metanol, CH3OH, dissolvidos em 1,00 kg de gua b) 3,00 g de metanol, CH3OH, dissolvidos em 1,00 kg de tetracloreto de carbono, CCl 4 c) 14,00 g de benzeno C6H6 dissolvidos em 25,0 g de CCl4 9) Calcule a frao molar do benzeno, C6H6, em cada uma das seguintes solues: a) 6,00 g de C6H6 + 6,00 g de CCl4 b) 6,00 g de C6H6 + 6,00 g de CCl4 + 6,00 g de CS2.
Você também pode gostar
- Potenciometria - Aula PráticaDocumento1 páginaPotenciometria - Aula PráticaJuliane Froncheti de MouraAinda não há avaliações
- 2 - Termodinâmica Dassoluções Não-Eletrolíticas - Soluções IdeaisDocumento3 páginas2 - Termodinâmica Dassoluções Não-Eletrolíticas - Soluções IdeaisJuliane Froncheti de MouraAinda não há avaliações
- Determinação de Cr+6Documento12 páginasDeterminação de Cr+6Juliane Froncheti de MouraAinda não há avaliações
- Espectroscopia de Absorção Molecular UV-vísDocumento65 páginasEspectroscopia de Absorção Molecular UV-vísJuliane Froncheti de Moura100% (1)
- Gases Ideais - Aula 2Documento3 páginasGases Ideais - Aula 2Juliane Froncheti de MouraAinda não há avaliações
- Aula 5 - Espectoscopia de Absorção Atômica - Forno de GrafiteDocumento11 páginasAula 5 - Espectoscopia de Absorção Atômica - Forno de GrafiteJuliane Froncheti de MouraAinda não há avaliações
- 2 - Lista de Exercícios Soluções IdeaisDocumento1 página2 - Lista de Exercícios Soluções IdeaisJuliane Froncheti de MouraAinda não há avaliações
- GasesDocumento2 páginasGasesJuliane Froncheti de MouraAinda não há avaliações
- Aula Experimental - CorrosãoDocumento2 páginasAula Experimental - CorrosãoJuliane Froncheti de MouraAinda não há avaliações
- Lista de Exercícios - Aula I - GasesDocumento1 páginaLista de Exercícios - Aula I - GasesJuliane Froncheti de MouraAinda não há avaliações
- Pilhas ExercíciosDocumento2 páginasPilhas ExercíciosJuliane Froncheti de Moura0% (1)
- Físico-Química I - Aula IDocumento3 páginasFísico-Química I - Aula IJuliane Froncheti de MouraAinda não há avaliações
- Físico-Química I - Terceira Lei Da TermodinamicaDocumento3 páginasFísico-Química I - Terceira Lei Da TermodinamicaJuliane Froncheti de MouraAinda não há avaliações
- Propriedades ColigativasDocumento3 páginasPropriedades ColigativasJuliane Froncheti de MouraAinda não há avaliações
- Difusão - Físico Quimica IIIDocumento3 páginasDifusão - Físico Quimica IIIJuliane Froncheti de MouraAinda não há avaliações
- Gases Toxicos em Espaço ConfinadoDocumento94 páginasGases Toxicos em Espaço ConfinadosarajackAinda não há avaliações
- Relatório 1 - FinalDocumento20 páginasRelatório 1 - FinalValéria CavaniaAinda não há avaliações
- Bioquimica 1Documento2 páginasBioquimica 1Felipe HiroAinda não há avaliações
- Ensino Técnico Integrado 2019-1 (Prova) - 2Documento11 páginasEnsino Técnico Integrado 2019-1 (Prova) - 2RhamomGomes0% (1)
- Apostila Física IDocumento21 páginasApostila Física Ilviviane986Ainda não há avaliações
- LIVRO IEC Corrosão em Instalações Metálicas Enterradas Ou SubmersasDocumento211 páginasLIVRO IEC Corrosão em Instalações Metálicas Enterradas Ou Submersasvitoripolo75% (4)
- Capítulo 12 - Nitrogênio e FósforoDocumento18 páginasCapítulo 12 - Nitrogênio e FósforoThiago SilvaAinda não há avaliações
- Uc2 - Aula 7 - ArgiloterapiaDocumento27 páginasUc2 - Aula 7 - ArgiloterapiaJeova SamuelAinda não há avaliações
- Lista de Exercicios 5 - Lic. QuimicaDocumento3 páginasLista de Exercicios 5 - Lic. QuimicaAbebeAinda não há avaliações
- Equiaxiais Tipo de FerritaDocumento177 páginasEquiaxiais Tipo de FerritaWaltemir JuniorAinda não há avaliações
- PGR Lisibloss Alimentos 2024 2025Documento29 páginasPGR Lisibloss Alimentos 2024 2025cpassessoriaemsegurancaAinda não há avaliações
- Tudo Se Transforma - Reações Químicas Os Primórdios: O Início Da QuímicaDocumento16 páginasTudo Se Transforma - Reações Químicas Os Primórdios: O Início Da Químicafrancisco gomes100% (1)
- Quimica Relatorio ExperiementalDocumento9 páginasQuimica Relatorio ExperiementalFernando Silva MonteiroAinda não há avaliações
- Cinetica QuimicaDocumento54 páginasCinetica QuimicaVioleta ValèryAinda não há avaliações
- AULA - ALIMENTAÇAO ANIMAL - SLIDEpptxDocumento24 páginasAULA - ALIMENTAÇAO ANIMAL - SLIDEpptxLourenço ChiteteAinda não há avaliações
- NBR 5586 - Tubos de Aco-Carbono e de Acos-Liga Ferritico e Austenitico Com Ou Sem Costura - RequiDocumento17 páginasNBR 5586 - Tubos de Aco-Carbono e de Acos-Liga Ferritico e Austenitico Com Ou Sem Costura - RequiDenis Yasmin AlineAinda não há avaliações
- Aula - 16 - Quimica Geral C - QUI003 - 1 - 2022Documento42 páginasAula - 16 - Quimica Geral C - QUI003 - 1 - 2022TiagoAinda não há avaliações
- SonasolDocumento11 páginasSonasolBriMariaAinda não há avaliações
- Pureza e RendimentoDocumento1 páginaPureza e RendimentoEdilson JuniorAinda não há avaliações
- Quais Os Conceitos Importantes NR-20Documento4 páginasQuais Os Conceitos Importantes NR-20vivaldoms144Ainda não há avaliações
- Catalogo de OrinesDocumento51 páginasCatalogo de OrinesAlexisAlejandroSandovalFlores0% (1)
- Plano de Aula - QuimicaDocumento2 páginasPlano de Aula - QuimicaThomasKauamAinda não há avaliações
- 0a051a5eb42a6707c6de25afc83ebbb9Documento290 páginas0a051a5eb42a6707c6de25afc83ebbb9Wandyy GonçalvesAinda não há avaliações
- Cinética Química - IntroduçãoDocumento34 páginasCinética Química - IntroduçãoEdson Miranda MarquesAinda não há avaliações
- Patologia em Madeira.Documento23 páginasPatologia em Madeira.Piter JhonatanAinda não há avaliações
- Natalia Lyrio DissertacaoDocumento65 páginasNatalia Lyrio DissertacaoMarcos GarcezAinda não há avaliações
- Linha de Produtos Kingspan Isoeste 9Documento36 páginasLinha de Produtos Kingspan Isoeste 9Eduardo OliveiraAinda não há avaliações
- Discutir As Diferenças Entre Os Tipos Possíveis de Chamas Produzidas Num Bico de Gás Considerando As Proporções Relativas Dos Gase1Documento2 páginasDiscutir As Diferenças Entre Os Tipos Possíveis de Chamas Produzidas Num Bico de Gás Considerando As Proporções Relativas Dos Gase1karine_sperling50% (2)
- Estudo Dirigido 01 ToxicologiaDocumento3 páginasEstudo Dirigido 01 ToxicologiaJullyara UlhAinda não há avaliações
- LIVRO Concreto Armado Vol. 1Documento135 páginasLIVRO Concreto Armado Vol. 1Kimberley HollandAinda não há avaliações