Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista de Exercícios
Enviado por
Renato Souza0 notas0% acharam este documento útil (0 voto)
44 visualizações3 páginasTítulo original
1. Lista de Exercícios
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
44 visualizações3 páginasLista de Exercícios
Enviado por
Renato SouzaDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Lista de exerccios 1.
(Modelo atmico e Periodicidade qumica)
Qumica Geral
Responsvel: Prof. Dra. Mnica Alencar
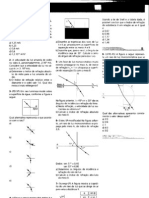
1. Em 1911, Rutherford e colaboradores realizaram o experimento mostrado
na figura abaixo:
Sabendo que as partculas so carregadas positivamente e de acordo com o
contexto e as informaes apresentadas na figura,
a) comente como as observaes colhidas no experimento contriburam para Rutherford
propor o seu modelo atmico.
b) comente a falha do modelo de Rutherford, segundo a fsica clssica, e como Bohr
aprimorou esse modelo.
2. Descreva o modelo do tomo de Bohr. Como ele difere do modelo planetrio baseado na
fsica clssica?
3. A prata (massa atmica = 107,87) ocorre na natureza como uma mistura de
51,84%
107
Ag e o resto
109
Ag. Se a massa isotrpica de
107
Ag de 106,91, qual a
massa de
109
Ag?
4. Explique:
a) Dualidade Onda Partcula;
b) Princpio da Excluso da Pauli;
5. Qual a diferena entre rbita e orbital?
6. O que voc entende por forma de um orbital?
7. O que densidade de probabilidade?
8. Porque o nmero quntico n no pode assumir o valor de zero?
9. Desenhe os orbtais do tipo s, p e d indicando suas orientaes nas coordenadas
x, y e z.
10. Porque no primeiro perodo da tabela s existe dois elementos, no segundo e no
terceiro existem oito elementos, enquanto que no quarto perodo existem
dezoito elementos?
11. Porque a ordem crescente de energia dos subnveis, quando os mesmos se
encontram vazios, diferente daquela observada quando os mesmos se
encontram preenchidos? Explique.
12. Faa a distribuio eletrnica dos tomos com os seguintes nmeros atmicos:
a)Z=46
b)Z=32
c)Z=38
d)Z=35
e)Z=79
f)Z=61
g)Z=42
13. De que se trata a carga nuclear efetiva e o efeito blindagem dos tomos?
Explique esses dois conceitos.
14. Em termos de raio atmico, diga como o raio se comporta quando avaliamos os
elementos de nmeros atmicos Z=13, Z=14, Z=15, Z=16, Z=17 e Z=18.
15. Em termos de raio atmico, diga como o raio se comporta quando avaliamos os
elementos de nmeros atmicos Z=9, Z=17, Z=, Z=35, Z=53, Z=85
16. Qual das opes abaixo apresenta a comparao errada relativa aos raios de
tomos e de ons? Explique a verdade ou o erro de cada uma das sentenas.
a) raio do Na
+
< raio do Na
b) raio do Na
+
< raio do F
-
c) raio do Mg
2+
< raio do O
2-
d) raio do F
-
< raio do O
2-
e) raio do F
-
< raio do Mg
2+
17. Em termos de eletronegatividade, compare e EXPLIQUE os seguintes
elementos:
a) Li( Z=3)e F(Z=9)
b) Sr(Z=38) e S(Z=16)
c) F(Z=9) e At(Z=85)
d) Ra (Z=88) e O (Z=8)
e)Al(Z=13) e Cl(Z=17)
18. Em termos de energia de ionizao, compare e EXPLIQUE os seguintes
elementos:
a) Li(Z=3)e F(Z=9)
b) Sr(Z=38) e S(Z=16)
c) F(Z=9) e At(Z=85)
d)Ra(Z=88) e O(Z=8)
e)Al(Z=13) e Cl(Z=17)
19. Explique como se comporta as 1, 2 e 3 energia de ionizao dos seguintes
elementos:
a) Al (Z=13)
b) Na (Z=11)
c) F (Z=9)
20. Compare a 1 energia de ionizao do potssio e do bromo.
21. Compare a afinidade eletrnica do potssio e do bromo
Você também pode gostar
- Aula 01 - Administracao Do Relacionamento Com o Cliente - Parte 04Documento63 páginasAula 01 - Administracao Do Relacionamento Com o Cliente - Parte 04Renato SouzaAinda não há avaliações
- Estudo Dirigido para A P2Documento2 páginasEstudo Dirigido para A P2Renato SouzaAinda não há avaliações
- Lei de HookeDocumento4 páginasLei de HookeRenato SouzaAinda não há avaliações
- Aula 01 - Gestão de Suprimentos - Arquivo CompletoDocumento30 páginasAula 01 - Gestão de Suprimentos - Arquivo CompletoRenato SouzaAinda não há avaliações
- Exercícios Sobre Segmentação de MercadoDocumento1 páginaExercícios Sobre Segmentação de MercadoRenato SouzaAinda não há avaliações
- Aula 01 - Administracao Do Relacionamento Com o Cliente - Parte 02Documento39 páginasAula 01 - Administracao Do Relacionamento Com o Cliente - Parte 02Renato SouzaAinda não há avaliações
- Matriz de Provas - Docx - PROVA 8 ANO - 2º Bimestre de 2020 - FinalDocumento6 páginasMatriz de Provas - Docx - PROVA 8 ANO - 2º Bimestre de 2020 - FinalRenato SouzaAinda não há avaliações
- Roteiro de Estudos para o SimuladoDocumento15 páginasRoteiro de Estudos para o SimuladoRenato SouzaAinda não há avaliações
- Matemática DescomplicadaDocumento6 páginasMatemática DescomplicadaRenato SouzaAinda não há avaliações
- Ciclo de KrebsDocumento2 páginasCiclo de KrebsRenato SouzaAinda não há avaliações
- Noções de EstatisticaDocumento101 páginasNoções de EstatisticaRenato SouzaAinda não há avaliações
- Plano de Aula 2020 - 9º Anos - Primeiras Semanas de MarçoDocumento5 páginasPlano de Aula 2020 - 9º Anos - Primeiras Semanas de MarçoRenato SouzaAinda não há avaliações
- Colégio Positivo de Gurupi Professor (A) : Lucimeire Periodicidade Do Plano: DISCIPLINA: História TURMAS: 92.01Documento5 páginasColégio Positivo de Gurupi Professor (A) : Lucimeire Periodicidade Do Plano: DISCIPLINA: História TURMAS: 92.01Renato SouzaAinda não há avaliações
- 8 Lista 4 (Radiciacao)Documento2 páginas8 Lista 4 (Radiciacao)Renato SouzaAinda não há avaliações
- 20 Exercicios 7@ 2tri 2011Documento1 página20 Exercicios 7@ 2tri 2011Renato SouzaAinda não há avaliações
- Colégio Positivo de GurupiDocumento5 páginasColégio Positivo de GurupiRenato SouzaAinda não há avaliações
- Avaliação Diagnostica de Matemática - Docx - 7º AnosDocumento3 páginasAvaliação Diagnostica de Matemática - Docx - 7º AnosRenato Souza100% (1)
- Atividade 2Documento5 páginasAtividade 2Renato SouzaAinda não há avaliações
- A ReligiãoDocumento2 páginasA ReligiãoRenato SouzaAinda não há avaliações
- Soraya Dar EghmaDocumento325 páginasSoraya Dar EghmarksouthAinda não há avaliações
- Eletrotécnica - P3-G1 - EMC - 2008-1Documento2 páginasEletrotécnica - P3-G1 - EMC - 2008-1AllanAinda não há avaliações
- Optic ADocumento6 páginasOptic ApaulaorobertaoAinda não há avaliações
- Questões Sobre Escala CartográficaDocumento6 páginasQuestões Sobre Escala CartográficaGETULIO VICENTE VIEIRA MENEZESAinda não há avaliações
- Matemática Anos IniciaisDocumento37 páginasMatemática Anos IniciaisMaria Helena Souza100% (1)
- Lista 2 GPEDocumento9 páginasLista 2 GPEHallex OwenAinda não há avaliações
- Nivelamento - Eletricidade BásicaDocumento52 páginasNivelamento - Eletricidade BásicaNayara MercesAinda não há avaliações
- Dilatação TérmicaDocumento10 páginasDilatação TérmicaCarol MouraAinda não há avaliações
- Dimensionamento de HelicesDocumento13 páginasDimensionamento de HelicesKamilla Friás100% (1)
- Fichas Tecnicas OriginalDocumento204 páginasFichas Tecnicas OriginalgrassiengenhariaAinda não há avaliações
- 2 Lista de Exercícios de Química Do 3o Ano (2013)Documento6 páginas2 Lista de Exercícios de Química Do 3o Ano (2013)Valério LondeAinda não há avaliações
- Aula 02 - Estrutura Do Átomo e Isoátomos PDFDocumento9 páginasAula 02 - Estrutura Do Átomo e Isoátomos PDFitnerAinda não há avaliações
- 6º Caderno de Matemátca - 7º AnoDocumento12 páginas6º Caderno de Matemátca - 7º AnoJacky Riquielme100% (1)
- Componentes Do Tubo de Raios X - Fisica Da RadiologiaDocumento16 páginasComponentes Do Tubo de Raios X - Fisica Da RadiologiajacksongalvaoAinda não há avaliações
- 03 - Operadores Relacionais, Lógicos e Condicionais PDFDocumento19 páginas03 - Operadores Relacionais, Lógicos e Condicionais PDFLarissa PrutkiAinda não há avaliações
- Sova Fácil SF 300Documento36 páginasSova Fácil SF 300Daiane FerreiraAinda não há avaliações
- Prova 7 º Ano Matematica Sme RJDocumento16 páginasProva 7 º Ano Matematica Sme RJVanessa GomesAinda não há avaliações
- Bioquímica EngAmb T2 Grupo 05 Prova 02Documento4 páginasBioquímica EngAmb T2 Grupo 05 Prova 02Lucas SantosAinda não há avaliações
- Atividade de Recuperação Paralela 3 AnoDocumento1 páginaAtividade de Recuperação Paralela 3 AnofelupealmeidqAinda não há avaliações
- Aula 11Documento63 páginasAula 11Gustavo DominicesAinda não há avaliações
- Estruturas Metálicas - Dimensionamento À Tração: Disciplina: Projeto de Instalações Hidráulicas Prof. Msc. Igor LimaDocumento69 páginasEstruturas Metálicas - Dimensionamento À Tração: Disciplina: Projeto de Instalações Hidráulicas Prof. Msc. Igor LimaALAN DOURADO DE CASTROAinda não há avaliações
- De Stijl ManifestoDocumento2 páginasDe Stijl ManifestoRogeri O LiveiraAinda não há avaliações
- FichasDocumento1 páginaFichasCatarina FernandesAinda não há avaliações
- Brousseau G. SlidesDocumento67 páginasBrousseau G. SlidesE_RCARVALHO100% (1)
- Manual Do Usuário Do PETRADocumento67 páginasManual Do Usuário Do PETRAMagno RégisAinda não há avaliações
- Teste - MecânicaDocumento6 páginasTeste - MecânicaLuciana SilvaAinda não há avaliações
- UntitledDocumento37 páginasUntitledAnna Gabriele Marques de OliveiraAinda não há avaliações
- Proxmox Ceph PT BRDocumento6 páginasProxmox Ceph PT BRHalbe Bruno de AraújoAinda não há avaliações
- Notas para Um CGE in MZDocumento10 páginasNotas para Um CGE in MZCassio RolimAinda não há avaliações
- Ebook Scrum ArretadoDocumento76 páginasEbook Scrum ArretadoRaimundo MoreiraAinda não há avaliações