Escolar Documentos
Profissional Documentos
Cultura Documentos
Aula Sobre Soluções
Enviado por
claudiosldfTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Aula Sobre Soluções
Enviado por
claudiosldfDireitos autorais:
Formatos disponíveis
CURSO PAULO FREIRE Universidade Federal do Cear
Fsico-Qumica Laudenor Amorim Solues - 01
SOLUES
C = m1/V b) Concentrao em quantidade de matria (Cn) Cientificamente, mais usual esta concentrao, que relaciona a quantidade de soluto (mol) com o volume da soluo, geralmente em litros. Sua unidade mol/L: Cn = n1/V Existe uma frmula que relaciona concentrao comum com concentrao em quantidade de matria. Veja: Cn = n1/V e n1 = m1/M1 Logo: Cn = m1/M1.V Como C = m1/V, temos: Cn = C/M1 ou C = Cn . M1 Podemos usar essa frmula para transformar concentrao em quantidade de matria em concentrao comum, ou vice-versa. c) Ttulo (T) Pode relacionar a massa de soluto com a massa da soluo ou o volume do soluto com o volume da soluo. T = m1/m e T = V1/V O ttulo em massa no tem unidade, pois uma diviso de dois valores de massa (massa do soluto pela massa da soluo), e as unidades se cancelam. Como a massa e o volume de soluto nunca podero ser maiores que os da prpria soluo, o valor do ttulo nunca ser maior que 1. Multiplicando o ttulo por 100, teremos a porcentagem em massa ou em volume de soluto na soluo (P): P = 100 . T d) Densidade da soluo (d) Relaciona a massa e o volume da soluo: d = m/V Geralmente, as unidades usadas so g/mL ou g/cm3. Cuidado para no confundir densidade com concentrao comum, pois as duas relacionam massa com volume. Lembre-se de que na concentrao comum se relaciona a massa de soluto com o volume da soluo e, na densidade, a massa de soluo com o volume da soluo.
Definio Soluo qualquer mistura homognea. A gua que bebemos, os refrigerantes, os combustveis (lcool hidratado, gasolina), diversos produtos de limpeza (como sabonetes lquidos) so exemplos de solues. Tipos de solues: soluo lquida (ex.: refrigerantes), soluo slida (ex.: bronze = cobre + estanho) e soluo gasosa (ex.: ar atmosfrico). Componentes de uma soluo Os componentes de uma soluo so chamados soluto e solvente: - Soluto a substncia dissolvida no solvente. Em geral, est em menor quantidade na soluo. - Solvente a substncia que dissolve o soluto. Classificao das solues De acordo com a quantidade de soluto dissolvido, podemos classificar as solues: - Solues saturadas contm uma quantidade de soluto dissolvido igual sua solubilidade naquela temperatura, isto , excesso de soluto, em relao ao valor do coeficiente de solubilidade (Cs), no se dissolve, e constituir o corpo de fundo. - Solues insaturadas contm uma quantidade de soluto dissolvido menor que a sua solubilidade naquela temperatura. - Solues supersaturadas (instveis) contm uma quantidade de soluto dissolvido maior que a sua solubilidade naquela temperatura. Unidades de concentrao Podemos estabelecer diferentes relaes entre a quantidade de soluto, de solvente e de soluo. Tais relaes so denominadas genericamente concentraes. Usaremos o ndice 1 para indicar soluto e o ndice 2 para indicar solvente. As informaes da soluo no tm ndice. a) Concentrao comum (C) Tambm chamada concentrao em g/L (grama por litro), relaciona a massa do soluto em gramas com o volume da soluo em litros.
Curso Paulo Freire Rua General Sampaio 1731 - Centro Tel.: 3366-7588
Curso Paulo Freire Qumica Laudenor Amorim
As diversas formas de expressar a concentrao podem ser relacionadas: C = 1000.d.T Exerccios 1. (ITA-2002) Considere os apresentados a seguir: I. Creme de leite. II. Maionese comercial. III. leo de soja. IV. Gasolina. V. Poliestireno expandido. Destes, so classificados como coloidais: A) apenas I e II. B) apenas I, II e III. C) apenas II e V. D) apenas I, II e V. E) apenas III e IV. sistemas
3. (UFRN-1997) Uma soluo a 5% em massa de hipoclorito de sdio (NaOCl) em gua chamada comercialmente de gua sanitria. Considerando-se a densidade da soluo igual a 1,0g/mL, a massa (em gramas) de NaOCl necessria para preparar 1L de gua sanitria : a) 0,5 b) 5,0 c) 95,0 d) 55,0 e) 50,0 4. (PUCRS/1-2002) O cido sulfrico concentrado um lquido incolor, oleoso, muito corrosivo, oxidante e desidratante. No almoxarifado de um laboratrio, h disponvel o cido sulfrico concentrado de densidade 1,8g/cm3, contendo 90% de H2SO4 em massa. A massa de cido sulfrico presente em 100 mL deste cido concentrado : A) 1,62 B) 32,4 C) 162 D) 324 E) 1620 5. (UFF-1998) Um excesso de ferro metlico tratado com 50,0 mL de HCl 6,00 M. De acordo com a equao Fe + 2H+ Fe2+ + H2 e considerando que no h variao de volume, conclui-se que a [Fe2+] na soluo resultante : A) 0,15 M B) 0,30 M C) 3,00 M D) 1,50 M E) 30,0M 6. (UFU) Solues aquosas de HCl e de CH3COOH, ambas em concentrao 0,1 mol/L, apresentam [H+] livre iguais a 0,1 e 1,34 x l0-3 mol/L, respectivamente. Para a neutralizao completa de 10 mL das solues de HCl e de CH3COOH com soluo de NaOH 0,05 mol/L, sero gastos, respectivamente: A) 20 mL e 0,268 mL. B) 20mL e 20mL. C) 10mL e 1,07mL. D) 5 mL e 0,268 mL.
sistemas
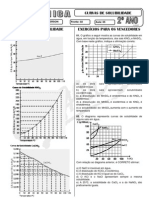
2. (UFMG-2001) Seis solues aquosas de nitrato de sdio, NaNO3 , numeradas de I a VI, foram preparadas, em diferentes temperaturas, dissolvendo-se diferentes massas de NaNO3 em 100 g de gua. Em alguns casos, o NaNO3 no se dissolveu completamente. Este grfico representa a curva de solubilidade de NaNO3, em funo da temperatura, e seis pontos, que correspondem aos sistemas preparados:
A partir da anlise desse grfico, CORRETO afirmar que os dois sistemas em que h precipitado so: A) I e II. B) I e III. C) IV e V D) V e VI.
Curso Paulo Freire Rua General Sampaio 1731 - Centro Tel.: 3252-3083
Você também pode gostar
- Ministério Da Saúde - Lista de Medicamentos Do SUSDocumento15 páginasMinistério Da Saúde - Lista de Medicamentos Do SUSclaudiosldfAinda não há avaliações
- Manual de Biosegurança - SPDocumento120 páginasManual de Biosegurança - SPAlexandre Antunes MateusAinda não há avaliações
- Justiça absolve frentista acusado de furto com cartão roubadoDocumento16 páginasJustiça absolve frentista acusado de furto com cartão roubadoclaudiosldfAinda não há avaliações
- Fatos Históricos BoliviaDocumento1 páginaFatos Históricos BoliviaclaudiosldfAinda não há avaliações
- Ministério Da Saúde - Consulta Pública #16, de 31 de Março de 2010Documento10 páginasMinistério Da Saúde - Consulta Pública #16, de 31 de Março de 2010claudiosldfAinda não há avaliações
- TJSC FGV 2015 Analista - Assistente Social PROVA - Tipo - 1Documento20 páginasTJSC FGV 2015 Analista - Assistente Social PROVA - Tipo - 1claudiosldfAinda não há avaliações
- Tokyo Ghoul emDocumento12 páginasTokyo Ghoul emclaudiosldf0% (2)
- Decreto #6.523, de 31 de Julho de 2008.Documento5 páginasDecreto #6.523, de 31 de Julho de 2008.claudiosldfAinda não há avaliações
- Itbi - Cartilha Maio 2013Documento18 páginasItbi - Cartilha Maio 2013claudiosldfAinda não há avaliações
- Efeito Entropia - Jornada Nas EstrelasDocumento253 páginasEfeito Entropia - Jornada Nas Estrelasdea_vianaAinda não há avaliações
- Prova-01-Tipo-001 (TRF 5 - FCC 2012 - Analista Jud - Area Jud)Documento14 páginasProva-01-Tipo-001 (TRF 5 - FCC 2012 - Analista Jud - Area Jud)claudiosldfAinda não há avaliações
- TJPA VUNESP 2014 Analista Judiciário - Administração PROVADocumento16 páginasTJPA VUNESP 2014 Analista Judiciário - Administração PROVAclaudiosldfAinda não há avaliações
- Prova - 01 - Tipo - 001 (TRF 3º - FCC2014 - Analista Jud)Documento13 páginasProva - 01 - Tipo - 001 (TRF 3º - FCC2014 - Analista Jud)claudiosldfAinda não há avaliações
- Lic FisicaDocumento2 páginasLic FisicaclaudiosldfAinda não há avaliações
- Prova 3 Oficial de Produ o IDocumento7 páginasProva 3 Oficial de Produ o IclaudiosldfAinda não há avaliações
- Levitron - Feira de Ciências ..Documento3 páginasLevitron - Feira de Ciências ..claudiosldfAinda não há avaliações
- GeometriaenemDocumento44 páginasGeometriaenemCarla PuppimAinda não há avaliações
- TJBA FGV 2015 Analista Jud - Administração Reaplicada Gab - Preliminar PDFDocumento8 páginasTJBA FGV 2015 Analista Jud - Administração Reaplicada Gab - Preliminar PDFclaudiosldfAinda não há avaliações
- Apostila Quantitativa PDFDocumento78 páginasApostila Quantitativa PDFNatalia Genuncio HaenelAinda não há avaliações
- Os 613 Mitzvot: A lista completa dos mandamentos judaicosDocumento23 páginasOs 613 Mitzvot: A lista completa dos mandamentos judaicosclaudiosldf67% (3)
- Apostila de AtualidadesDocumento174 páginasApostila de Atualidadeslu_previdenciaAinda não há avaliações
- AFO 00 Erick PDFDocumento30 páginasAFO 00 Erick PDFAndré DutraAinda não há avaliações
- Phonetics and PhonologyDocumento6 páginasPhonetics and PhonologyLua BilhalvaAinda não há avaliações
- O Intestino Na Insuficiência Cardíaca: Aspectos Funcionais, Imunológicos e TerapêuticosDocumento7 páginasO Intestino Na Insuficiência Cardíaca: Aspectos Funcionais, Imunológicos e TerapêuticosclaudiosldfAinda não há avaliações
- Toque de Mestre - FCC - Intelecção de TextoDocumento3 páginasToque de Mestre - FCC - Intelecção de TextoclaudiosldfAinda não há avaliações
- QFL 2309 – Reatividade de Compostos OrgânicosDocumento10 páginasQFL 2309 – Reatividade de Compostos OrgânicosClaudinei Martins100% (1)
- Método Flauta TransversalDocumento43 páginasMétodo Flauta TransversalAugusto José Querino0% (1)
- 1 - Diagramas TTTDocumento35 páginas1 - Diagramas TTTclaudiosldfAinda não há avaliações
- Microscopia Eletrônica de Varredura (MEV) : Fundamento Da TécnicaDocumento1 páginaMicroscopia Eletrônica de Varredura (MEV) : Fundamento Da TécnicaclaudiosldfAinda não há avaliações
- Ensaios de precipitação e solubilidadeDocumento3 páginasEnsaios de precipitação e solubilidadeAndreia FalcãoAinda não há avaliações
- Preparo e diluição de soluçõesDocumento11 páginasPreparo e diluição de soluçõesLana Costa100% (1)
- Fisico Química 7º AnoDocumento4 páginasFisico Química 7º AnoAna Rita Valente Valente100% (1)
- QUiMICA TECNOLoGICA SOLUcoESDocumento7 páginasQUiMICA TECNOLoGICA SOLUcoESHugo PerrettAinda não há avaliações
- Exercícios de concentração molar e fração molarDocumento1 páginaExercícios de concentração molar e fração molarJéssica LealAinda não há avaliações
- Cristalização fracionada de dicromato de potássioDocumento6 páginasCristalização fracionada de dicromato de potássioAlessandro MartinsAinda não há avaliações
- Química - Pré-Vestibular Impacto - Solubilidade - CurvasDocumento2 páginasQuímica - Pré-Vestibular Impacto - Solubilidade - CurvasQuímica Qui100% (5)
- Preparação de Soluções PDFDocumento12 páginasPreparação de Soluções PDFCarla CarneiroAinda não há avaliações
- Curvasde SolubilidadeDocumento2 páginasCurvasde SolubilidadeMarcos AurelioAinda não há avaliações
- Solubilidade de sais: conceitos e curvas de solubilidadeDocumento12 páginasSolubilidade de sais: conceitos e curvas de solubilidadeCarolynne MourãoAinda não há avaliações
- Propriedade QuímicasDocumento13 páginasPropriedade QuímicasEder Cezano GonçalvesAinda não há avaliações
- 04 Filtragem HidráulicaDocumento9 páginas04 Filtragem HidráulicaJosé A.CAinda não há avaliações
- Relatorio 3Documento9 páginasRelatorio 3Kelvin JordanAinda não há avaliações
- 16 SolubilidadeDocumento6 páginas16 SolubilidadeEverton FisicoAinda não há avaliações
- Equilíbrio de Solubilidade e PrecipitaçãoDocumento21 páginasEquilíbrio de Solubilidade e PrecipitaçãoJoel SamuelAinda não há avaliações
- Formas Farmacêuticas Líquidas - Soluções ExploradasDocumento22 páginasFormas Farmacêuticas Líquidas - Soluções ExploradasExpedito Junior50% (2)
- Solubilidade de saisDocumento4 páginasSolubilidade de saisEng Renato De Marchi Vieira Dos SantosAinda não há avaliações
- Lista 1 QG 1-19Documento6 páginasLista 1 QG 1-19schottbpAinda não há avaliações
- Lista de SólidosDocumento5 páginasLista de SólidosNick LimaAinda não há avaliações
- Soluções QuímicasDocumento4 páginasSoluções QuímicasLarissa DalapícolaAinda não há avaliações
- Solubilidade de saisDocumento4 páginasSolubilidade de saisCleber SerafinAinda não há avaliações
- SoluçãoDocumento5 páginasSoluçãoBráulio BrazAinda não há avaliações
- Química - Pré-Vestibular Impacto - SolubilidadeDocumento2 páginasQuímica - Pré-Vestibular Impacto - SolubilidadeQuímica Qui80% (5)
- Módulo 2 - TESTE (ENUNCIADO)Documento5 páginasMódulo 2 - TESTE (ENUNCIADO)José Leote PaixãoAinda não há avaliações
- 5 Lista de Exercícios QA IIDocumento2 páginas5 Lista de Exercícios QA IIliviasavignonAinda não há avaliações
- Lista Exercícios Fases MisturasDocumento2 páginasLista Exercícios Fases MisturasBruno Felipe BothAinda não há avaliações
- Extração Sólido-Líquido: Processos e EquipamentosDocumento30 páginasExtração Sólido-Líquido: Processos e EquipamentosFernanda PeixotoAinda não há avaliações
- Curva de SolubilidadeDocumento5 páginasCurva de Solubilidadealexchacal100% (2)
- Ficha de Trabalho - Composição de SoluçõesDocumento5 páginasFicha de Trabalho - Composição de Soluçõessusana vieira0% (1)