Escolar Documentos
Profissional Documentos
Cultura Documentos
01 Thomas 2 ANOF2 Aula 04 Solubilidade
Enviado por
thata_vilarinhoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
01 Thomas 2 ANOF2 Aula 04 Solubilidade
Enviado por
thata_vilarinhoDireitos autorais:
Formatos disponíveis
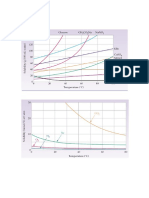
SOLUBILIDADE
Prof: THOMAS JEFFERSON Frente: 02 Aula: 04
AL290307
COEFICIENTE DE SOLUBILIDADE EXERCÍCIOS PARA OS VENCEDORES
É a quantidade máxima, em grama, de soluto
que se dissolve numa quantidade fixa de solvente a uma 01. Seis soluções aquosas de nitrato de sódio, NaNO3,
dada temperatura. numeradas de I a VI, foram preparadas, em diferentes
temperaturas, dissolvendo-se diferentes massas de
Exemplo: o coeficiente de solubilidade do KNO3 em água é NaNO3 em 100g de água. Em alguns casos, o NaNO3 não
31,6 g de KNO3 para 100 g de H2O a 20 ºC. se dissolveu completamente.
Este gráfico representa a curva de solubilidade de
Solução saturada: é aquela que não consegue NaNO3, em função da temperatura, e seis pontos, que
mais dissolver soluto, dada uma temperatura fixa, ou seja, correspondem aos sistemas preparados:
atingiu o coeficiente de solubilidade.
Solução insaturada: é aquela que ainda
consegue mais dissolver soluto, dada uma tempera-tura
fixa, ou seja, ainda não atingiu o coeficiente de
solubilidade.
Solução supersaturada: é aquela que
ultrapassou o coeficiente de solubilidade, são instáveis.
Curvas de solubilidade: são gráficos que indicam como o
coeficiente de solubilidade varia com a temperatura.
A partir da análise desse gráfico, é CORRETO afirmar que
os dois sistemas em que há precipitado são
a) I e II.
b) I e III.
c) IV e V.
d) V e VI.
02. O processo Solvay de obtenção do Na2CO3, matéria-
prima importante na fabricação do vidro, envolve os
reagentes CO2, NH3 e solução saturada de NaCl. Na
solução final encontram-se os íons NH+4(aq), Na+(aq), Cl-(aq) e
HCO-3(aq)
CURVAS DE SOLUBILIDADE
Normalmente a solubilidade de uma substância
varia com a temperatura. O gráfico que representa a
solubilidade de uma substância em função da
temperatura, é denominado de curva de solubilidade.
Existem três tipos de curvas:
- Curvas Ascendentes: representam as substâncias cujo
coeficiente de solubilidade aumenta com a temperatura.
São substâncias que se dissolvem com a absorção de
calor, isto é, a dissolução é endotérmica.
- Curvas Descendentes: representam as substâncias cujo Analisando, no gráfico apresentado, as curvas de
coeficiente de solubilidade diminui com o aumento de solubilidade em função da temperatura, é correto afirmar
temperatura. São substâncias que se dissolvem com que:
liberação de calor, isto é, a dissolução é exotérmica.
a) são dissoluções endotérmicas
Obs: a solubilidade de gases diminui com o aumento de b) são dissoluções endotérmicas
temperatura. A solubilidade de sólidos, geralmente, c) são dissoluções endotérmicas e exotérmicas
aumenta com o aumento de temperatura. d) somente a do NaCl é endotérmica
e) somente a do Na2CO3 é endotérmica
Fale conosco www.portalimpacto.com.br
Ao analisar o gráfico acima, percebe-se que: IV - a solubilidade de B mantém-se constante com o
aumento da temperatura.
V - a quantidade de B que satura a solução à temperatura
de 80°C é igual a 150g.
Somente são corretas:
a) I, II e III.
b) II, III e V.
c) I, III e V.
d) II, IV e V.
e) I, II e IV.
06. A curva de solubilidade de um dado sal é apresentada
a) a solubilidade do KCl é maior que a do KBr. a seguir. Considerando a solubilidade deste sal a 30°C,
b) à medida que a temperatura aumenta a solubilidade qual seria a quantidade máxima (aproximada) de soluto
diminui. cristalizada quando a temperatura da solução saturada (e
c) a solubilidade do KBr é maior que a do KCl. em agitação) fosse diminuída para 20°C?
d) quanto menor a temperatura, maior a solubilidade.
e) o KCl apresenta solubilização exotérmica.
04. A curva de solubilidade de um sal hipotético é:
a) 10 g b) 15 g c) 20 g d) 30 g
Se a 20°C misturarmos 20g desse sal com 100g de água,
07. A tabela a seguir fornece as solubilidades do KCl e do
quando for atingido o equilíbrio, podemos afirmar que:
Li2CO3 a várias temperaturas.
a) 5 g do sal estarão em solução.
b) 15 g do sal será corpo de fundo (precipitado).
c) o sal não será solubilizado.
d) todo o sal estará em solução.
e) 5 g do sal será corpo de fundo (precipitado).
05. A partir do diagrama a seguir, que relaciona a
solubilidade de dois sais A e B com a temperatura são
feitas as afirmações:
Assinale a alternativa falsa:
a) a dissolução do KCl em água é endotérmica
b) o aquecimento diminui a solubilidade do Li2CO3 em
água
c) a massa de KCl capaz de saturar 50g de água, a 40°C,
é 20g
d) a 10°C, a solubilidade do KCl é menor do que a do
Li2CO3
e) a 10°C, a solubilidade do KCl é maior do que a do
Li2CO3
I - existe uma única temperatura na qual a solubilidade de
A é igual à de B.
II - a 20°C, a solubilidade de A é menor que a de B.
III - a 100°C, a solubilidade de B é maior que a de A.
Fale conosco www.portalimpacto.com.br
Você também pode gostar
- Apostila de Experimentos de QuímicaDocumento58 páginasApostila de Experimentos de QuímicaWandersonSonzym100% (3)
- Sabao Sabonete e CIADocumento204 páginasSabao Sabonete e CIAkakacavalcante100% (3)
- Aula 02 - ProteínasDocumento49 páginasAula 02 - ProteínasCarla SobralAinda não há avaliações
- Manual Laboratorio Quimica Analitica QualitativaDocumento80 páginasManual Laboratorio Quimica Analitica QualitativaBruna Coutinho SouzaAinda não há avaliações
- Manual Hidroponia BrasilDocumento34 páginasManual Hidroponia BrasilMatheus100% (1)
- Soluções (Curvas de Solubilidade)Documento38 páginasSoluções (Curvas de Solubilidade)GleisonAinda não há avaliações
- Cbae4ae1 Db5c 4fc9 8184 5115d78789b8 Fisico QuimicaDocumento79 páginasCbae4ae1 Db5c 4fc9 8184 5115d78789b8 Fisico QuimicaNina Bob Brown100% (1)
- Operações FarmaceuticasDocumento51 páginasOperações FarmaceuticasRenata FernandesAinda não há avaliações
- Exercicios de Coeficiente de Solubilidade PDFDocumento4 páginasExercicios de Coeficiente de Solubilidade PDFLeandro Mendes HappatschAinda não há avaliações
- Lista de Exercícios - SolubilidadeDocumento3 páginasLista de Exercícios - Solubilidadealexchacal100% (2)
- NBR 13807 - AlumínioDocumento3 páginasNBR 13807 - AlumíniokarenparoniAinda não há avaliações
- Coeficiente de SolubilidadeDocumento38 páginasCoeficiente de SolubilidadeMarguiené BragaAinda não há avaliações
- Exercicios Solubilidade IIDocumento6 páginasExercicios Solubilidade IIDauson CuigicjenhiAinda não há avaliações
- Apostila Experimental de Quantitativa PDFDocumento76 páginasApostila Experimental de Quantitativa PDFRomero BuenoAinda não há avaliações
- Curvasde SolubilidadeDocumento2 páginasCurvasde SolubilidadeMarcos AurelioAinda não há avaliações
- 16 SolubilidadeDocumento7 páginas16 SolubilidadeFRANKE MERO TESTEAinda não há avaliações
- Química - Pré-Vestibular Impacto - Solubilidade - CurvasDocumento2 páginasQuímica - Pré-Vestibular Impacto - Solubilidade - CurvasQuímica Qui100% (5)
- 16 SolubilidadeDocumento6 páginas16 SolubilidadeEverton FisicoAinda não há avaliações
- DispersõeDocumento5 páginasDispersõeHelton ClistenesAinda não há avaliações
- Solucoes PDFDocumento15 páginasSolucoes PDFThiago Magno Tavares Machado100% (1)
- Lista de Exercicios 12 - Revisao para A 2 Avaliacao - Hidrolise Salina e Solubilidade - 3 Bimestre 2013 - 3 SeriesDocumento2 páginasLista de Exercicios 12 - Revisao para A 2 Avaliacao - Hidrolise Salina e Solubilidade - 3 Bimestre 2013 - 3 SeriesJosimar Lima FerreiraAinda não há avaliações
- 36 20solubilidade 20 - 20conceitos 20e 20curvas PDFDocumento12 páginas36 20solubilidade 20 - 20conceitos 20e 20curvas PDFCarolynne MourãoAinda não há avaliações
- Coeficiente de SolubilidadeDocumento5 páginasCoeficiente de SolubilidadeRubia MariathAinda não há avaliações
- Ficha Ex.11-Curvas Solubilidade PDFDocumento4 páginasFicha Ex.11-Curvas Solubilidade PDFIsabel FreitasAinda não há avaliações
- Coeficiente de Solub.Documento8 páginasCoeficiente de Solub.Rafael MottaAinda não há avaliações
- Quimica 2 Ano 2 ParteDocumento19 páginasQuimica 2 Ano 2 ParteJoão PauloAinda não há avaliações
- 12 - Soluções Curvas de SolubilidadeDocumento4 páginas12 - Soluções Curvas de SolubilidadeRodrigo MetteAinda não há avaliações
- Exercicios de SolubilidadeDocumento7 páginasExercicios de SolubilidadeDenis DinizAinda não há avaliações
- Estudo Das Solucoes Coeficiente de SolubilidadeDocumento13 páginasEstudo Das Solucoes Coeficiente de SolubilidadeGildo Silva100% (1)
- 1a Lista de Exercicios de Fisico Quimica !Documento2 páginas1a Lista de Exercicios de Fisico Quimica !Bruna RomeroAinda não há avaliações
- SolubilidadeDocumento38 páginasSolubilidadeLXM10% (1)
- Atividade 1 FQ2ADocumento3 páginasAtividade 1 FQ2AAlfredo Sahade VespaAinda não há avaliações
- Alex 04 - Soluções - Coeficiente de SolubilidadeDocumento2 páginasAlex 04 - Soluções - Coeficiente de Solubilidaderomezioh7716Ainda não há avaliações
- Química - Pré-Vestibular Impacto - SolubilidadeDocumento2 páginasQuímica - Pré-Vestibular Impacto - SolubilidadeQuímica Qui80% (5)
- Apostila QUIMICA Com GabaritoDocumento39 páginasApostila QUIMICA Com Gabaritobio1988Ainda não há avaliações
- Diagrama de FaseDocumento2 páginasDiagrama de FaseJair HonoratoAinda não há avaliações
- Química Lista de ExercíciosDocumento4 páginasQuímica Lista de Exercícioshtq87rbdjgAinda não há avaliações
- Atividade 2 FQ2ADocumento4 páginasAtividade 2 FQ2AAlfredo Sahade VespaAinda não há avaliações
- OlucoesDocumento22 páginasOlucoesRebecaAinda não há avaliações
- Graficos Solubilidade 2 Ano 2Documento1 páginaGraficos Solubilidade 2 Ano 2lopesqui1766Ainda não há avaliações
- E class2023brasilanexosk41nOjfrMNt1jcYtDxYb4nuWCk7FoDREgbDyz82J PDFDocumento2 páginasE class2023brasilanexosk41nOjfrMNt1jcYtDxYb4nuWCk7FoDREgbDyz82J PDFLarissa Bitencourt TheodoroffAinda não há avaliações
- Química: 3 Lista de ResoluçãoDocumento5 páginasQuímica: 3 Lista de ResoluçãoJader Pereira de AraujoAinda não há avaliações
- 20080325103157Documento6 páginas20080325103157Renan Barcelos MendesAinda não há avaliações
- Lista de Exerc DensidadeDocumento6 páginasLista de Exerc DensidadeRtyu IuytAinda não há avaliações
- Estudo Dirigido Das SoluçõesDocumento5 páginasEstudo Dirigido Das SoluçõesKyuraKingAinda não há avaliações
- 31-Soluções e SolubilidadeDocumento4 páginas31-Soluções e Solubilidadenv77vnm100% (2)
- Bloco 2 Aula 2 Curvas de SolubilidadeDocumento2 páginasBloco 2 Aula 2 Curvas de SolubilidadeMax NunesAinda não há avaliações
- Lista Propriedades ColigativasDocumento4 páginasLista Propriedades ColigativasAdriele SchaurichAinda não há avaliações
- Gab - gb22 Lrp3b.qui 2emaeb 3bimDocumento3 páginasGab - gb22 Lrp3b.qui 2emaeb 3bimabidabugaAinda não há avaliações
- SOLUCOESDocumento15 páginasSOLUCOESRaquel Reis Duarte PinheiroAinda não há avaliações
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Documento5 páginasA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10Ainda não há avaliações
- Lista de Exercícios de Química 3 AnoDocumento3 páginasLista de Exercícios de Química 3 AnoAlex CardozoAinda não há avaliações
- PDF - Lista 41 - Propriedades ColigativasDocumento4 páginasPDF - Lista 41 - Propriedades ColigativasLucas AmorimjsAinda não há avaliações
- LE - Dispersão e SolubilidadeDocumento3 páginasLE - Dispersão e SolubilidadeMatheus PetryAinda não há avaliações
- Química - 2° Ano - PReus.Documento4 páginasQuímica - 2° Ano - PReus.Kauã CostaAinda não há avaliações
- Ita Quimica 1973Documento7 páginasIta Quimica 1973Diego VidalAinda não há avaliações
- Soluções 321 QuestõesDocumento83 páginasSoluções 321 QuestõesThiago Alonso Rodrigues da Hora67% (3)
- Miniteste: Grupo IDocumento3 páginasMiniteste: Grupo IJoao MAchadoAinda não há avaliações
- Coeficiente de Solubilidadeaula 12 04 12blogDocumento7 páginasCoeficiente de Solubilidadeaula 12 04 12blogThania ArrudaAinda não há avaliações
- Quím 2o EM P1 1o BimDocumento4 páginasQuím 2o EM P1 1o Bimalambique51100% (1)
- Lista de SolubilidadeDocumento2 páginasLista de SolubilidadeRtyu IuytAinda não há avaliações
- Exercicios de SolubilidadeDocumento6 páginasExercicios de Solubilidadesua mae de 4Ainda não há avaliações
- 378870-Módulo 01 - Soluções 1 PDFDocumento8 páginas378870-Módulo 01 - Soluções 1 PDFÍtalo SantosAinda não há avaliações
- Fisicoquimica II ApostilaDocumento36 páginasFisicoquimica II ApostilaMario SantanaAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Aflon Tubos e Conexoes RevestidosDocumento25 páginasAflon Tubos e Conexoes RevestidosEwerton Alves MarianoAinda não há avaliações
- Refratometria - Relatório IDocumento10 páginasRefratometria - Relatório IPablo BorgesAinda não há avaliações
- Reatividade de Ametais, Deslocamento Entre Ametais e Propriedades Dos HalogêniosDocumento7 páginasReatividade de Ametais, Deslocamento Entre Ametais e Propriedades Dos HalogêniosMayara MoreiraAinda não há avaliações
- Relatorio de Bioquimica - Determinação de Ácido Ascórbico em Produtos Alimentícios .Documento15 páginasRelatorio de Bioquimica - Determinação de Ácido Ascórbico em Produtos Alimentícios .AndréBastosAinda não há avaliações
- Cateteres Periféricos Novas Recomendações Da ANVISADocumento11 páginasCateteres Periféricos Novas Recomendações Da ANVISAPatricia LunaAinda não há avaliações
- DF Quimica Ita 5eaaff0091461Documento18 páginasDF Quimica Ita 5eaaff0091461SARAHAinda não há avaliações
- Experimentos Didáticos de CristalizaçãoDocumento14 páginasExperimentos Didáticos de CristalizaçãoDavid BrunoAinda não há avaliações
- Lista Exerc - Cios - Cap 14 e 15Documento3 páginasLista Exerc - Cios - Cap 14 e 15Nathalia SiqueiraAinda não há avaliações
- Metodos de Extração de LipideosDocumento6 páginasMetodos de Extração de LipideosManuela M. Lins50% (2)
- Determinação de Ferro OrtofenantrolinaDocumento3 páginasDeterminação de Ferro OrtofenantrolinaEduardo RodriguesAinda não há avaliações
- 791 Artigo 8388 1 10 20190809Documento8 páginas791 Artigo 8388 1 10 20190809Araujo CristianeAinda não há avaliações
- Manual PHmetro de Bancada - IcelDocumento19 páginasManual PHmetro de Bancada - IcelPauloAinda não há avaliações
- Exercicios SOLUCOES1Documento8 páginasExercicios SOLUCOES1Michelle LimaAinda não há avaliações
- Automação de Um Sistema de Hidroponia NFT para Produção de AlfacesDocumento11 páginasAutomação de Um Sistema de Hidroponia NFT para Produção de AlfacesMichel Rodrigo100% (1)
- Manual - Gelopar GGFP 1300 PDFDocumento8 páginasManual - Gelopar GGFP 1300 PDFClaiton NodariAinda não há avaliações
- NBR 13802 (Abr 1997) - Água - Determinação de Selênio Pelo Método Colorimétrico Da DiaminobenzidinaDocumento3 páginasNBR 13802 (Abr 1997) - Água - Determinação de Selênio Pelo Método Colorimétrico Da DiaminobenzidinaYuri Bahia de VasconcelosAinda não há avaliações
- Obqne 1999Documento4 páginasObqne 1999Nicole OliveiraAinda não há avaliações
- Questoes Globalizantes QuimicaDocumento24 páginasQuestoes Globalizantes QuimicaAlexandra OliveiraAinda não há avaliações
- Química - Técnicas de PurificaçãoDocumento50 páginasQuímica - Técnicas de PurificaçãoPaulo ConteAinda não há avaliações
- Fertirrigação Na Cultura Do MamoeiroDocumento19 páginasFertirrigação Na Cultura Do MamoeirochagasidiarnAinda não há avaliações
- Ficha-Exercicio 3 SolubilidadeDocumento2 páginasFicha-Exercicio 3 SolubilidadeDuarteAinda não há avaliações
- Apostila de Química 122Documento52 páginasApostila de Química 122Pedro AugustoAinda não há avaliações