Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista de Exercícios sobre Modelos Atômicos
Enviado por
Tony MaiaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Lista de Exercícios sobre Modelos Atômicos
Enviado por
Tony MaiaDireitos autorais:
Formatos disponíveis
Lista de Exercícios 6 – Modelos Atômicos
1) Considere os fótons emitidos por uma lâmpada ultravioleta e por uma emissora de TV. Para
cada um deles, qual das grandezas abaixo é maior: a) Comprimento de onda, b) energia e c)
momentum.
2) Qual luz colorida provém de uma transição de maior energia, luz vermelha ou azul?
3) Como o modelo de Rutherford explica o retro espalhamento de partículas alfa direcionadas
contra uma folha de ouro?
4) Na época da realização do experimento de Rutherford com a folha de ouro, os cientistas
sabiam que haviam elétrons negativamente carregados no interior do átomo, mas não sabiam
onde residiam as cargas positivas. Que informação o experimento de Rutherford forneceu a
este respeito?
5) O urânio é 238 vezes mais massivo do que o hidrogênio. Por que, então, o diâmetro do átomo
de urânio não é 238 vezes maior do que o do átomo de hidrogênio?
6) Por que a física clássica prediz que o átomo, segundo o modelo planetário, deveria se
colapsar?
7) Se um átomo de hidrogênio obedecesse à mecânica clássica, ao invés da mecânica quântica,
ele emitiria um espectro contínuo ou um espectro de linhas? Explique.
8) Por que as linhas espectrais são frequentemente consideradas como “impressões digitais
atômicas”?
9) Como o modelo ondulatório, com elétrons orbitando o núcleo, explica os valores discretos
para a energia, ao invés de valores arbitrários para a mesma?
10) Por que os átomos que possuem o mesmo número de camadas eletrônicas decrescem em
tamanho com o crescimento do número atômico?
11) Por que não existe uma órbita estável em um átomo cuja circunferência é igual a 2,5
comprimentos de onda de de Broglie?
12) Uma partícula pode sofrer difração? Pode exibir interferência?
13) Se o mundo atômico possui tantas incertezas e está sujeito a leis probabilísticas, como
podemos medir com precisão coisas como a intensidade da luz, a corrente elétrica e a
temperatura?
14) Quando apenas alguns poucos fótons são observados, a física clássica falha. Quando são
observados muitos, a física clássica é válida. Qual desses dois fatos é consistente com o
princípio de correspondência?
15) Quanto mais alta for a energia de um nível ocupado por um elétron num átomo de hidrogênio,
maior será o átomo. O tamanho do átomo é proporcional a 𝑛 2, onde 𝑛 = 1 se refere ao estado
mais baixo, ou estado “fundamental”, 𝑛 = 2 se refere ao segundo, 𝑛 = 3 ao terceiro, e assim
por diante. Se o diâmetro do átomo for igual a 1 × 10−10 m em seu estado de mais baixa
energia, qual será seu diâmetro correspondente ao estado de número 50? Quantos átomos
não-excitados poderiam caber dentro deste átomo gigante?
16) Podemos definir o “zero” da energia de um átomo de hidrogênio como sendo a energia do
estado mais baixo, ou estado “fundamental”. As energias correspondentes aos sucessivos
estados excitados acima do estado fundamental são proporcionais a 100 − 100/𝑛2, para os
números quânticos 𝑛 = 1, 2, 3, etc. Portanto, desta maneira a energia de um nível 𝑛 = 2 é
100 100
dada por 100 − 4 = 75,0, para 𝑛 = 3, 100 − 9 = 88,9 e assim por diante. a) Esboce um
diagrama, aproximadamente em escala, que inclua o estado fundamental e os quatro estados
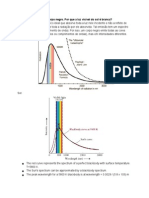
excitados mais baixos. b) A linha vermelha mais proeminente do espectro do hidrogênio é
produzida pela transição eletrônica do estado 3 para o estado 2. A transição de 4 para 3
produz uma linha espectral correspondente a uma frequência mais alta ou mais baixa? c) E
quanto à transição de 2 para 1?
Você também pode gostar
- Química Geral I - Teoria Atômica de DaltonDocumento14 páginasQuímica Geral I - Teoria Atômica de DaltonSimony OliveiraAinda não há avaliações
- CST em Radiologia: raios X, efeito fotoelétrico e modelos atômicosDocumento7 páginasCST em Radiologia: raios X, efeito fotoelétrico e modelos atômicosCelso Queiroz100% (1)
- Massa Atômica Massa Molecular e Massa Molar 1 Prof Rui MedeirosDocumento3 páginasMassa Atômica Massa Molecular e Massa Molar 1 Prof Rui MedeiroslivisAinda não há avaliações
- EDS e WDSDocumento45 páginasEDS e WDSaltieri1Ainda não há avaliações
- Estudo Dirigido I Eng AmbDocumento3 páginasEstudo Dirigido I Eng AmbMilton FerreiraAinda não há avaliações
- 9º Ano - Atividade - Átomos - Elementos Químicos - Tabela Periódica - FCLDocumento1 página9º Ano - Atividade - Átomos - Elementos Químicos - Tabela Periódica - FCLNatanaelAinda não há avaliações
- Atomistica - Exercicios GabaritadosDocumento34 páginasAtomistica - Exercicios Gabaritadosnergal569% (13)
- UFSE Química I - Lista de ExercíciosDocumento2 páginasUFSE Química I - Lista de Exercíciosari0007Ainda não há avaliações
- Questoes QuimicaDocumento16 páginasQuestoes QuimicaFernando WatzmanAinda não há avaliações
- QUIMICADocumento11 páginasQUIMICAThiago TavaresAinda não há avaliações
- 1a Lista de Exercícios CFQDocumento2 páginas1a Lista de Exercícios CFQNathany CamillyAinda não há avaliações
- Lista - Teoria AtômicaDocumento7 páginasLista - Teoria Atômicagiovana alvesAinda não há avaliações
- Química Geral I - Aula 14 - Décima Quarta Lista de Exercícios - GabaritoDocumento10 páginasQuímica Geral I - Aula 14 - Décima Quarta Lista de Exercícios - GabaritoJ O E LAinda não há avaliações
- Exercícios1 Quimica para FarmaciaDocumento3 páginasExercícios1 Quimica para FarmaciakaleliagAinda não há avaliações
- LISTA 02-Arquitetura AtômicaDocumento7 páginasLISTA 02-Arquitetura AtômicaMarcsAinda não há avaliações
- Lista 2 - Teoria Atômica Quimica GeralDocumento3 páginasLista 2 - Teoria Atômica Quimica GeralGláucia GuimaraesAinda não há avaliações
- lista - teoria atômicaDocumento3 páginaslista - teoria atômicapaulatejanomuitomesmo2Ainda não há avaliações
- Modelos atômicos históricosDocumento7 páginasModelos atômicos históricosJoão Neto0% (1)
- Estrutura AtômicaDocumento4 páginasEstrutura AtômicaJoelma AbreuAinda não há avaliações
- LISTA 4 Com RespostaDocumento5 páginasLISTA 4 Com RespostadoutoronaldAinda não há avaliações
- Lista de Exercícios de Estrutura AtômicaDocumento2 páginasLista de Exercícios de Estrutura AtômicaGabriela FernandesAinda não há avaliações
- Exercícios de Química BásicaDocumento6 páginasExercícios de Química BásicaEmmanue neloAinda não há avaliações
- Átomos excitados: emissão de luz e transições eletrônicasDocumento42 páginasÁtomos excitados: emissão de luz e transições eletrônicasSergio Gasques Rodrigues0% (1)
- 5a_lista_22-11-23Documento5 páginas5a_lista_22-11-23roberio bezerraAinda não há avaliações
- Química Geral 1 - Estrutura AtômicaDocumento6 páginasQuímica Geral 1 - Estrutura AtômicaFrederico HipólitoAinda não há avaliações
- Lista de Exercícios Quimica Geral (Superior)Documento9 páginasLista de Exercícios Quimica Geral (Superior)Ian Pereira100% (1)
- Modelo atômico de Bohr e quantização da energiaDocumento26 páginasModelo atômico de Bohr e quantização da energiaSem futuro animeAinda não há avaliações
- IAM Lista 01 Respostas PDFDocumento30 páginasIAM Lista 01 Respostas PDFgilliardAinda não há avaliações
- Folha de LinhasDocumento6 páginasFolha de LinhasBruna LoyanneAinda não há avaliações
- Exercícios 1Documento3 páginasExercícios 1Claiver CoelhoAinda não há avaliações
- Lista de Exercícios de Espectroscopia AtômicaDocumento2 páginasLista de Exercícios de Espectroscopia AtômicaMattia Silva ValsangiacomoAinda não há avaliações
- 1a Lista de Exercícios QUI125 PDFDocumento3 páginas1a Lista de Exercícios QUI125 PDFLucas SfredoAinda não há avaliações
- Lista Exercício2Documento3 páginasLista Exercício2Larissa CamargoAinda não há avaliações
- 2a Lista de Exerc Cios de F Sica Moderna 1 - 2Documento3 páginas2a Lista de Exerc Cios de F Sica Moderna 1 - 2Giuliano RidolfiAinda não há avaliações
- Física Quântica - Espectros e Modelos AtômicosDocumento7 páginasFísica Quântica - Espectros e Modelos AtômicosAndre Luiz CostaAinda não há avaliações
- Fundamentos QuímicaDocumento2 páginasFundamentos QuímicaTatiane Takeshita0% (1)
- Modelos Atômicos RevisãoDocumento5 páginasModelos Atômicos RevisãoMatheus dos Santos SousaAinda não há avaliações
- Modelos atômicos de Dalton, Thomson, Rutherford e BohrDocumento2 páginasModelos atômicos de Dalton, Thomson, Rutherford e BohrCatharina PariceAinda não há avaliações
- Modelo atômico: pontuação e requisitosDocumento9 páginasModelo atômico: pontuação e requisitosMarcos OliveiraAinda não há avaliações
- Exercicio - EstruturaEletronica - 1 Ufmg123Documento2 páginasExercicio - EstruturaEletronica - 1 Ufmg123Yann sampaioAinda não há avaliações
- AP1 - Lista 01 - Modelos Atômicos e Distribuição EletrônicaDocumento6 páginasAP1 - Lista 01 - Modelos Atômicos e Distribuição EletrônicaHiago MatosAinda não há avaliações
- Transformaçoes - Lista de Exerccios 1Documento4 páginasTransformaçoes - Lista de Exerccios 1John SaucerAinda não há avaliações
- O modelo atômico de Rutherford e a descoberta do núcleo atômicoDocumento4 páginasO modelo atômico de Rutherford e a descoberta do núcleo atômicofabianammbarbosaAinda não há avaliações
- Partículas subatômicas, modelos atômicos e suas evidências experimentaisDocumento5 páginasPartículas subatômicas, modelos atômicos e suas evidências experimentaisWelson Ferreira CavalcantiAinda não há avaliações
- Química Geral - FFULDocumento60 páginasQuímica Geral - FFULJoana Catarina AndradeAinda não há avaliações
- Corpo negro, efeito fotoelétrico e quantização da energiaDocumento8 páginasCorpo negro, efeito fotoelétrico e quantização da energiaroger_meloAinda não há avaliações
- Atividade Química Geral - Parte IDocumento2 páginasAtividade Química Geral - Parte IElizael De Jesus GonçalvesAinda não há avaliações
- Lista de Exercícios 01A (Com Respostas)Documento8 páginasLista de Exercícios 01A (Com Respostas)Bruna AssisAinda não há avaliações
- Lista de Exercícios Física QuânticaDocumento2 páginasLista de Exercícios Física QuânticaFelipe GohAinda não há avaliações
- Lista 1Documento2 páginasLista 1Beatriz NascimentoAinda não há avaliações
- Questao Atdq Lista 06Documento17 páginasQuestao Atdq Lista 06Emanuelle Vincenzi CamattiAinda não há avaliações
- Quantica Lista5Documento2 páginasQuantica Lista5Ana Luiza ValleAinda não há avaliações
- 1 Lista Ic 614 - InorganicaDocumento3 páginas1 Lista Ic 614 - InorganicaFelipe Lins SantosAinda não há avaliações
- Exercício de Modelos AtômicosDocumento4 páginasExercício de Modelos AtômicosDenis Damiana De Castro OliveiraAinda não há avaliações
- Modelos AtômicosDocumento4 páginasModelos AtômicosCarlos EduardoAinda não há avaliações
- Exercicios para Portfolio Aula 5 2016 2Documento4 páginasExercicios para Portfolio Aula 5 2016 2Tiago MeloAinda não há avaliações
- ExercíciosDocumento3 páginasExercíciosleohsokulskiAinda não há avaliações
- microbiologia -2024[1083]Documento10 páginasmicrobiologia -2024[1083]Tony MaiaAinda não há avaliações
- Análise dos delírios de René Guénon em O Rei do MundoDocumento36 páginasAnálise dos delírios de René Guénon em O Rei do MundoMarlonAinda não há avaliações
- René Guénon e A Islamização Do OcidenteDocumento16 páginasRené Guénon e A Islamização Do OcidenteTony MaiaAinda não há avaliações
- Geociencias,+17210 FINAL+FINALDocumento13 páginasGeociencias,+17210 FINAL+FINALTony MaiaAinda não há avaliações
- A mentalidade de seita por trás do imaginário olavistaDocumento22 páginasA mentalidade de seita por trás do imaginário olavistaTony MaiaAinda não há avaliações
- Bruno RonchiDocumento22 páginasBruno RonchiTony MaiaAinda não há avaliações
- Aula2 GrandezasUnidadesDocumento23 páginasAula2 GrandezasUnidadesTony MaiaAinda não há avaliações
- Medidas estatísticas em Física GeralDocumento45 páginasMedidas estatísticas em Física GeralTony MaiaAinda não há avaliações
- Delineamento ParametrizacaoDocumento16 páginasDelineamento ParametrizacaoTony MaiaAinda não há avaliações
- A Origem de Todas As Coisas Uma Questão para A Ciencia e Religião Marcelo Gleiser e Hans KungDocumento42 páginasA Origem de Todas As Coisas Uma Questão para A Ciencia e Religião Marcelo Gleiser e Hans KungTony MaiaAinda não há avaliações
- SLIDE-Formação Da Imagem RadiográficaDocumento18 páginasSLIDE-Formação Da Imagem RadiográficaCharles Silva .Ainda não há avaliações
- 1 - Modelos AtômicosDocumento1 página1 - Modelos AtômicosClash RoyaleAinda não há avaliações
- Exercícios de Polaridade e Geometria MolecularDocumento5 páginasExercícios de Polaridade e Geometria MolecularMatheus HenriqueAinda não há avaliações
- ResumoDocumento4 páginasResumoLucas MeloAinda não há avaliações
- Ângulo de refração mede densidade bactériasDocumento1 páginaÂngulo de refração mede densidade bactériasAlan JoséAinda não há avaliações
- Espelhos esféricosDocumento1 páginaEspelhos esféricosTailor Raniere WaiandtAinda não há avaliações
- Aula15 Quimica1 ExercíciosDocumento4 páginasAula15 Quimica1 ExercíciosSayori CosmeticosAinda não há avaliações
- Uso do laser em oftalmologia: tratamentos para glaucoma, catarata, retinopatia diabética e maisDocumento16 páginasUso do laser em oftalmologia: tratamentos para glaucoma, catarata, retinopatia diabética e maisVanessa NoronhaAinda não há avaliações
- Aula 5 - Ligações Químicas Parte IIDocumento60 páginasAula 5 - Ligações Químicas Parte IIGustavo Carvalho SilvaAinda não há avaliações
- Microscopia óptica na inspeção de circuitos integradosDocumento29 páginasMicroscopia óptica na inspeção de circuitos integradosWaldinéia Soares SoaresAinda não há avaliações
- Regra do Octeto e Ligações QuímicasDocumento13 páginasRegra do Octeto e Ligações QuímicasGuilherme DiaconiucAinda não há avaliações
- Ótica IIDocumento6 páginasÓtica IIaldenyfisicanewtonAinda não há avaliações
- Radiação gama na inspeção industrialDocumento26 páginasRadiação gama na inspeção industrialThayssa CabralAinda não há avaliações
- Microscopia - Resolução e Ampliação de MicroscópiosDocumento2 páginasMicroscopia - Resolução e Ampliação de MicroscópiosMariana CostaAinda não há avaliações
- Física Insrumentos ÓpticosDocumento4 páginasFísica Insrumentos ÓpticosBianca N C BasilioAinda não há avaliações
- Aula 1 - EletrônicaDocumento16 páginasAula 1 - EletrônicaPatricia VerteloAinda não há avaliações
- Difração de Raios X em Liga de AlumínioDocumento8 páginasDifração de Raios X em Liga de AlumínioAntónio TeixeiraAinda não há avaliações
- Óptica ENEMDocumento10 páginasÓptica ENEMno fucks ever givenAinda não há avaliações
- A Lei de Gauss, Relação Entre o Objeto, Lente e A ImagemDocumento4 páginasA Lei de Gauss, Relação Entre o Objeto, Lente e A ImagemMatheus Sousa100% (1)
- Química Geral: Átomos, Moléculas e ÍonsDocumento62 páginasQuímica Geral: Átomos, Moléculas e ÍonsmayaramagdaAinda não há avaliações
- Quimica EstudarDocumento8 páginasQuimica EstudarHerbert Souza100% (1)
- Bizuário - Química IDocumento5 páginasBizuário - Química IArlindo do Nascimento Campos FilhoAinda não há avaliações
- Configurações Eletrônicas e Números QuânticosDocumento3 páginasConfigurações Eletrônicas e Números QuânticosHelder DuraoAinda não há avaliações
- Ótica geométrica: Revisão de física sobre imagens formadas por espelhosDocumento6 páginasÓtica geométrica: Revisão de física sobre imagens formadas por espelhosMagnoAinda não há avaliações
- Ficha de Trabalho Nº1 - FQ 8º Ano (Explicação e Representação de Reações Químicas)Documento2 páginasFicha de Trabalho Nº1 - FQ 8º Ano (Explicação e Representação de Reações Químicas)Lourenço SousaAinda não há avaliações
- Teste Q2.1 N.º 1 - V1 10-3Documento4 páginasTeste Q2.1 N.º 1 - V1 10-3BiaAinda não há avaliações
- Ligacoes IntermolecularesDocumento20 páginasLigacoes IntermolecularesMatildeAinda não há avaliações






























































![microbiologia -2024[1083]](https://imgv2-1-f.scribdassets.com/img/document/719800852/149x198/72566a7873/1712181958?v=1)



































