Escolar Documentos
Profissional Documentos
Cultura Documentos
Questão 1
Enviado por
Bruna de Souza MatosDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Questão 1
Enviado por
Bruna de Souza MatosDireitos autorais:
Formatos disponíveis
Discentes Responsáveis - Grupo 05:
Amanda Soares França (12534335)
Gabrielle Oliveira Vasconcelos (12534082)
Pedro Rodrigues Rocha (12689050)
Questão 1
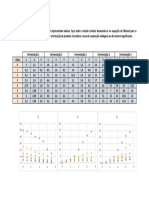
De acordo com os dados obtidos a partir da titulação potenciométrica do ácido
ascórbico (AA) com uma solução de NaOH 0,101 mol/L, foi possível plotar os
gráficos da titulação padrão e o gráfico da primeira derivada para determinação do
ponto de equivalência da reação de neutralização.
Os valores obtidos em forma de tabela e os gráficos foram apresentados a
seguir, sendo a linha destacada na tabela aquela que representa o ponto de
equivalência em ambos as representações gráficas:
Titulação Normal 1ª derivada
Volume NaOH (mL) Potencial (mV) V/mL ΔpH/ΔV
2 120,6 2,5 -4,6
3 116 3,5 -5,4
4 110,6 4,5 -5,6
5 105 5,5 -6,3
6 98,7 6,5 -6
7 92,7 7,5 -7,3
8 85,4 8,5 -7,6
9 77,8 9,5 -7,7
10 70,1 10,25 -8,6
10,5 65,8 10,75 -9,6
11 61 11,25 -8,4
11,5 56,8 11,75 -9,8
12 51,9 12,25 -11,6
12,5 46,1 12,75 -10,4
13 40,9 13,25 -10,8
13,5 35,5 13,75 -14,4
14 28,3 14,25 -16
14,5 20,3 14,75 -23
15 8,8 15,25 -31
15,5 -6,7 15,75 -63,6
16 -38,5 16,5 -108,9
17 -147,4 17,5 -55,1
18 -202,5 18,5 -24
19 -226,5 19,5 -11,1
20 -237,6
i) Gráfico da titulação do ácido ascórbico (AA)
ii) Gráfico da primeira derivada
iii) Quantidade de ácido ascórbico (AA) na pastilha original
A partir da determinação do ponto de equivalência da reação de neutralização,
foi possível obter a massa de ácido ascórbico presente em 20 mL da solução
utilizada na titulação. Então, com esse valor, calculou-se a quantidade de ácido
ascórbico presente em 100 mL da solução na qual a pastilha de 1g foi dissolvida.
Ponto de equivalência: 𝑉𝑁𝑎𝑂𝐻 = 16, 0 𝑚𝐿 [𝑁𝑎𝑂𝐻] = 0, 101 𝑚𝑜𝑙/𝐿
Dados AA: 𝑀𝑀 = 176, 12 𝑔 𝑉𝑎𝑙í𝑞𝑢𝑜𝑡𝑎 = 20, 0 𝑚𝐿 𝑉𝑠𝑜𝑙𝑢çã𝑜 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 = 100, 0 𝑚𝐿
−
− 0,101 𝑚𝑜𝑙 𝑂𝐻 1 𝑚𝑜𝑙 𝐴𝐴 176,12 𝑔 𝐴𝐴
? 𝑔 𝐴𝐴 20, 0 𝑚𝐿 ⇒ 16, 0 𝑚𝐿 𝑂𝐻 × 1𝐿
× − × 1 𝑚𝑜𝑙 𝐴𝐴
= 0, 285 𝑔
1 𝑚𝑜𝑙 𝑂𝐻
0,285 𝑔 𝐴𝐴
? 𝑔 𝐴𝐴 100, 0 𝑚𝐿 ⇒ 100, 0 𝑚𝐿 × 20,0 𝑚𝐿
= 1, 425 𝑔 𝑑𝑒 𝐴𝐴
Portanto, com base nos cálculos acima, encontrou-se que havia 1,425 g de
ácido ascórbico (AA) na pastilha de 1g. Essa massa obtida é maior do que a
esperada, mas deve-se levar em consideração que na pastilha não há apenas o
ácido ascórbico que reagiu com o hidróxido de sódio.
Segundo a bula da pastilha, um dos excipientes utilizados é o ácido cítrico, por
conta de também ser uma espécie ácida, o mesmo reagiu com a base utilizada,
assim como o ácido ascórbico. Logo, a massa determinada de ácido na pastilha não
diz respeito apenas ao ácido ascórbico, mas também ao ácido cítrico.
Você também pode gostar
- TABELA - Rosca - de - Movimentacao Trapezoidal ISODocumento2 páginasTABELA - Rosca - de - Movimentacao Trapezoidal ISOAndré Guimarães86% (22)
- Atividade 2 - ResoluçãoDocumento3 páginasAtividade 2 - ResoluçãoViolet ZoeAinda não há avaliações
- Tabela de Rosca MétricaDocumento1 páginaTabela de Rosca Métricabruzzijr50% (6)
- 6 - Diagramas de Fases em Materiais CerâmicosDocumento69 páginas6 - Diagramas de Fases em Materiais CerâmicosAlexandreAinda não há avaliações
- Relatório 4 - Sìntese e Caracterização Do Ácido AcetilsalicílicoDocumento9 páginasRelatório 4 - Sìntese e Caracterização Do Ácido AcetilsalicílicoAna ZanattaAinda não há avaliações
- Tabela de Dias de Auditoria ISO 9001Documento5 páginasTabela de Dias de Auditoria ISO 9001anderdrumerAinda não há avaliações
- Perda de Carga em Tubulações PDFDocumento1 páginaPerda de Carga em Tubulações PDFEduardo MirandaAinda não há avaliações
- Umidímetro SpeedyDocumento2 páginasUmidímetro SpeedyClaudio OliveiraAinda não há avaliações
- Relatório 4 - Leticia e JoséDocumento7 páginasRelatório 4 - Leticia e JoséJOSE CARDOSO DA SILVA NETOAinda não há avaliações
- LIVRO Concreto Armado Vol. 1Documento135 páginasLIVRO Concreto Armado Vol. 1Kimberley HollandAinda não há avaliações
- Trocadores de CalorDocumento33 páginasTrocadores de CalorJefferson SamuelAinda não há avaliações
- FQT2 - Lista 01 - LiquidosDocumento3 páginasFQT2 - Lista 01 - LiquidosLeo RugieriAinda não há avaliações
- Relat RioDocumento6 páginasRelat RioPamela BarbosaAinda não há avaliações
- Recomendação PV 01 LADO RODOVIA - XLSXDocumento3 páginasRecomendação PV 01 LADO RODOVIA - XLSXLeonardo QuirinoAinda não há avaliações
- Padronização NaOHDocumento1 páginaPadronização NaOHRebeca BauerAinda não há avaliações
- Prática 3 - Lab2Documento7 páginasPrática 3 - Lab2Beatriz PiresAinda não há avaliações
- Correlação e Regressão LinearDocumento14 páginasCorrelação e Regressão LinearSuzan Grazielle BenettiAinda não há avaliações
- EstatisticaDocumento10 páginasEstatisticaMariana Vieira De SouzaAinda não há avaliações
- AlucinaçãoDocumento8 páginasAlucinaçãoSinapse QuânticoAinda não há avaliações
- 2 Prova de Qualidade - Maria LopesDocumento9 páginas2 Prova de Qualidade - Maria LopesLorran Sousa PaulinoAinda não há avaliações
- Lista - Linhas de InfluênciaDocumento7 páginasLista - Linhas de InfluênciaCarlos FreireAinda não há avaliações
- Tabela Flange PRFVDocumento1 páginaTabela Flange PRFVrafaelAinda não há avaliações
- Tabela Correção Densímetro CervejaDocumento1 páginaTabela Correção Densímetro CervejaronaldoeliseubarbosaAinda não há avaliações
- Trabalho EstatisticaDocumento4 páginasTrabalho EstatisticaEverton CarmonaAinda não há avaliações
- Tabela de Correção de DensímetroDocumento1 páginaTabela de Correção de DensímetroVinícius Chiquetto Faria100% (1)
- Tabela Cabos Correntes PDFDocumento1 páginaTabela Cabos Correntes PDFjbrito2009Ainda não há avaliações
- Exercícios - Curvas de DeclínioDocumento1 páginaExercícios - Curvas de DeclínioAlfredö HeidyAinda não há avaliações
- Mapa FinalDocumento5 páginasMapa FinalLuana DantasAinda não há avaliações
- RELATÓRIOSDocumento29 páginasRELATÓRIOSdouglas sampaioAinda não há avaliações
- Teste T StudentDocumento8 páginasTeste T StudentHiroshi KogaAinda não há avaliações
- Exemplo Aua 21-011-2022Documento4 páginasExemplo Aua 21-011-2022Cleive Leones NevesAinda não há avaliações
- 332-R - Anexo 5 - Testes Físicos Admissão CEMAutDocumento5 páginas332-R - Anexo 5 - Testes Físicos Admissão CEMAutKamila NolascoAinda não há avaliações
- Lista I - Engenharia Da QualidadeDocumento6 páginasLista I - Engenharia Da QualidadeFlavil SilvaAinda não há avaliações
- Estimativas Do Volume de EfluentesDocumento7 páginasEstimativas Do Volume de EfluentesANIBAL JORGE DE LANAAinda não há avaliações
- SarespDocumento8 páginasSarespAmanda de Paulo SilvaAinda não há avaliações
- Condutas No Paciente Grave - Elias KnobelDocumento6 páginasCondutas No Paciente Grave - Elias KnobelluciohtAinda não há avaliações
- Parte 1A - para Quê A VisualizaçãoDocumento17 páginasParte 1A - para Quê A VisualizaçãoKamayaAinda não há avaliações
- João Nascif - Saresp 2021Documento8 páginasJoão Nascif - Saresp 2021Cesar Lima LimaAinda não há avaliações
- Tabela PressaoxTemperatura LinhaRLX-2Documento1 páginaTabela PressaoxTemperatura LinhaRLX-2Léo HilárioAinda não há avaliações
- Tabela Pressão X Temperatura - RefrigeraçãoDocumento1 páginaTabela Pressão X Temperatura - RefrigeraçãoCarlos TripodiAinda não há avaliações
- Tabela PressaoxTemperatura LinhaRLX-2Documento1 páginaTabela PressaoxTemperatura LinhaRLX-2fabricio marquesAinda não há avaliações
- T1 PE EduardoGelielPasa PDFDocumento10 páginasT1 PE EduardoGelielPasa PDFEdu GelielAinda não há avaliações
- 4 Curvas - Apostila 2011Documento37 páginas4 Curvas - Apostila 2011Graziele MoraesAinda não há avaliações
- 4.3 - Momentos Fletores, Regime Rígido-Plástico (Tepedino) - Tabela 3.9Documento1 página4.3 - Momentos Fletores, Regime Rígido-Plástico (Tepedino) - Tabela 3.9Isabela MadureiraAinda não há avaliações
- WordfisicaDocumento3 páginasWordfisicajackson vilellaAinda não há avaliações
- Tabela de Fusiveis.Documento1 páginaTabela de Fusiveis.ARIAinda não há avaliações
- Tabela de Fusiveis.Documento1 páginaTabela de Fusiveis.ARIAinda não há avaliações
- 4.2 - Momentos Fletores, Regime Elástico (Tepedino) - Tabela 3.11Documento1 página4.2 - Momentos Fletores, Regime Elástico (Tepedino) - Tabela 3.11Isabela MadureiraAinda não há avaliações
- Grau de Desacetilação Da QuitosanaDocumento5 páginasGrau de Desacetilação Da QuitosanaOscar AlhosAinda não há avaliações
- 104 Fio Rigido Antichamas 10mm SilDocumento1 página104 Fio Rigido Antichamas 10mm SilJoao PauloAinda não há avaliações
- Correlação e Regressão+planilhaDocumento10 páginasCorrelação e Regressão+planilhaJoão NetoAinda não há avaliações
- Tubos de Troca Termica - Trocador - B111 BWG 16Documento3 páginasTubos de Troca Termica - Trocador - B111 BWG 16WIGO WAIOAinda não há avaliações
- Tabelas de Motores Fios e CabosDocumento3 páginasTabelas de Motores Fios e CabosMauroAinda não há avaliações
- Cinética Microbiana ExercícioDocumento1 páginaCinética Microbiana ExercícioCarlos Eduardo De Farias SilvaAinda não há avaliações
- Tabela Dis FDocumento3 páginasTabela Dis FMaykJoaquimDosSantosAinda não há avaliações
- Determinação de Ácido Acetilsalicílico (Aas) em Analgésico Por Titulação PotenciométricaDocumento13 páginasDeterminação de Ácido Acetilsalicílico (Aas) em Analgésico Por Titulação PotenciométricaMatheus LucasAinda não há avaliações
- Notas Finais NoturnoDocumento1 páginaNotas Finais NoturnoLucka de Godoy GianvechioAinda não há avaliações
- Relatório Curva de CalibraçãoDocumento5 páginasRelatório Curva de CalibraçãoMatheusAinda não há avaliações
- Após Analisados Os Dados Conseguimos Chegar Á Conclusão de Diversas CaracterísticasDocumento7 páginasApós Analisados Os Dados Conseguimos Chegar Á Conclusão de Diversas CaracterísticasTiago SerranoAinda não há avaliações
- GB 40Documento2 páginasGB 40MarcioAinda não há avaliações
- Experimento 11 - Potenciometria - Quim. Analítica IIDocumento7 páginasExperimento 11 - Potenciometria - Quim. Analítica IIRAQUEL BEATRIZ MORAES E SILVAAinda não há avaliações
- Prática - Misturas Ternárias (Diagrama de Três Fases)Documento16 páginasPrática - Misturas Ternárias (Diagrama de Três Fases)Isabel SilvaAinda não há avaliações
- Banner Uenf Confit JOANA FinalDocumento1 páginaBanner Uenf Confit JOANA FinalAna Lucia DieguesAinda não há avaliações
- 2 Série - Química - TRILHA - Semana 18Documento1 página2 Série - Química - TRILHA - Semana 18Juvenal S. PereiraAinda não há avaliações
- Estudo Do Desgaste de Revestimento Interno de Um Moinho de Bolas Operando Com Rocha FosfáticaDocumento8 páginasEstudo Do Desgaste de Revestimento Interno de Um Moinho de Bolas Operando Com Rocha FosfáticaTamiris LourençoAinda não há avaliações
- Mecanismo - 2014Documento30 páginasMecanismo - 2014Gerson Lima100% (1)
- Analisador de GasesDocumento2 páginasAnalisador de GasesDaniel NóbregaAinda não há avaliações
- Master PurDocumento6 páginasMaster PurAndré GazzoniAinda não há avaliações
- Relatório IX - Pressão de VaporDocumento9 páginasRelatório IX - Pressão de VaporJeiel FrancisAinda não há avaliações
- Modulo de Elasticidade Materiais EngDocumento1 páginaModulo de Elasticidade Materiais EngJohnny Pereira de Sousa0% (1)
- Nomenclatura IUPAC Compostos InorganicosDocumento14 páginasNomenclatura IUPAC Compostos InorganicosNocas100% (1)
- Manual Instalação GeomembranaDocumento41 páginasManual Instalação GeomembranaRodrigoMouraMarquesAinda não há avaliações
- FISPQ - Eletrodo StarDocumento8 páginasFISPQ - Eletrodo Starmurillosc17Ainda não há avaliações
- Relatório 1 - RecristalizaçãoDocumento9 páginasRelatório 1 - RecristalizaçãoAlexander JuniorAinda não há avaliações
- QuimicaDocumento2 páginasQuimicaAline AlvesAinda não há avaliações
- Curva ABC - Planilha OrçamentáriaDocumento21 páginasCurva ABC - Planilha OrçamentáriaJean SantosAinda não há avaliações
- PCM2 2019-2 XPS e Esp AugerDocumento50 páginasPCM2 2019-2 XPS e Esp AugerMarcelo SouzaAinda não há avaliações
- As Patologias Mais Comuns Nas EstradasDocumento10 páginasAs Patologias Mais Comuns Nas EstradasTalita BarcelosAinda não há avaliações
- Catálogo de Produtos Spirax SarcoDocumento8 páginasCatálogo de Produtos Spirax SarcoRafael BentesAinda não há avaliações
- Ficha8 Química PDFDocumento6 páginasFicha8 Química PDFDaniela TargonAinda não há avaliações
- Classificação, Composição e Superfícies Dos Coloides No COTIDIANODocumento12 páginasClassificação, Composição e Superfícies Dos Coloides No COTIDIANOAnonymous UYDJtUnAinda não há avaliações
- Aula 5 - Ensaio de Flexão e DobramentoDocumento18 páginasAula 5 - Ensaio de Flexão e DobramentoPaulo Victor TosoAinda não há avaliações
- Adensamento Do SoloDocumento26 páginasAdensamento Do SoloDenise AlmeidaAinda não há avaliações
- PDF Catalogo CKC 333 Portas Corta FogoDocumento2 páginasPDF Catalogo CKC 333 Portas Corta FogodbarosengAinda não há avaliações
- Lista 01 Unidade I FCMDocumento3 páginasLista 01 Unidade I FCMEliesio OliveiraAinda não há avaliações
- Química - Teórico - VOLUME2Documento94 páginasQuímica - Teórico - VOLUME2Gerusa RodriguesAinda não há avaliações
- 19-A - Cap.17 (Antigo Cap.15) - Ligações ParafusadasDocumento22 páginas19-A - Cap.17 (Antigo Cap.15) - Ligações ParafusadasFernando LemeAinda não há avaliações