Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista Exercícios Ácido Base
Enviado por
Sâmia DantasTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Lista Exercícios Ácido Base
Enviado por
Sâmia DantasDireitos autorais:
Formatos disponíveis
6a Lista de exercícios de Química/ EEMA / 2019
1. Para uma solução 0,10 molar de HNO2 , calcule o pH e a percentagem de dissociação.(Ka =4,5 x 10 -4)
2. Uma solução de HNO3 com pH=2,3 é diluída com água a 8 vezes seu volume original.
Qual o pH da solução resultante?Qual a concentração de OH -?
3. As figuras abaixo representam soluções aquosas de 3 ácidos HA (A = X, Y ou Z). A água foi omitida
para facilitar o entendimento.
a) Qual o par conjugado de cada ácido?
b) Arranje os três ácidos em ordem crescente de força ácida.
c) Qual ácido, se existir, é uma ácido forte?
d) Qual ácido possui menor valor de Ka?
e) Qual o percentual dissociação da solução HZ?
4. Considere a curva de titulação de um ácido fraco, ácido acético (CH3COOH), com NaOH (base
forte). Na curva indique os pontos que correspondem ao que se segue.
a) O ponto de equivalência
b) O ponto no qual pH=pKa
c) O pH do ponto de equivalência será
maior, menor ou igual a 7? Justifique
usando equações químicas.
d) Qual seria o melhor indicador para ser
utilizado
Indicador Faixa de viragem
Azul de timol 8,0-10,0
Verde de bromocresol 3,8-5,4
Azul de bromotimol 6,0-7,5
5. Complete a tabela com os dados que faltam e responda:
Ácido propanóico Ácido acético Ácido fórmico
CH3CH2COOH CH3COOH HCOOH
Ka 1,3x10-5 1,8x10-4
pKa 4,74
a) Coloque os ácidos em ordem crescente da força ácida, justificando suas escolhas
b) Qual o pH de uma solução aquosa 0,01M de formiato de sódio (HCOONa)?
6. Você deseja preparar 1L de uma solução tampão com pH=4,3. Uma lista dos possíveis
ácidos (e suas bases conjugadas) são mostrados na tabela abaixo. Qual ácido você
escolheria para preparar o tampão desejado? Justifique. Qual a razão entre a
concentração do ácido e sua base conjugada deveria ser utilizada?
Ácido Base conjugada Ka
- 2-
HSO4 SO4 1,2x10-2
CH3COOH CH3COO- 1,8x10-5
- 2-
HCO3 CO3 4,8x10-11
7. Uma solução de um ácido fraco foi preparada dissolvendo 2,34 g em um volume final
de solução de 100,00 mL. Na titulação 42,60 mL de NaOH 0,25 M foram necessários
para atingir o ponto de equivalência. A forma da curva de titulação indica que se trata
de um ácido monoprótico. O pH no ponto de equivalência foi 9,40.
a) Calcule a massa molar do ácido.
b) b) Calcule o Ka do ácido
c) Calcule o pH da solução original.
d) Calcule o pH no meio da titulação ( quando 21,3 m foram adicionados)
8. Morfina (C17H19NO3), uma narcótico com ação analgésica, é uma base fraca. Se o pH de
uma solução 7,0 x 10-4 M de morfina possui pH 9,4, qual o valor do Kb para a morfina?
9. Classifique cada uma dos seguintes sais como ácido, base ou neutro:
a) Fe(NO)3 b) NH4I c) NH4NO2 d) (CH3NH3)Cl e) CH3COONH4 f) Ba(NO3)2
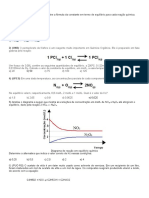
10. Em uma titulação de 39,6 mg de um ácido fraco desconhecido empregou-se NaOH0,1
M como titulante. Com base na curva detitulação ao lado apresente a massa molar
deste ácido e seu Ka. Qual dos três indicadores abaixo seria mais indicado para ser
utilizado nesta titulação?
Indicador Faixa de viragem
Azul de timol 8,0-10,0
Verde de bromocresol 3,8-5,4
Azul de bromotimol 6,0-7,5
11. Compare a força relativa das seguintes bases de
Lewis relacionando com a estrutura molecular: (metilamina: (CH 3)3N; dimetilamina:
(CH3)2NH; Amônia:NH3 )Complete a tabela relacionando cada espécie ao seu valor de K a
ou pKa e determine os valores que faltam na tabela.
Composto Kb pKb
5,4x10-4
3,44
1,8x10-5
Você também pode gostar
- Princípios de química analítica: Abordagem teórica qualitativa e quantitativaNo EverandPrincípios de química analítica: Abordagem teórica qualitativa e quantitativaNota: 5 de 5 estrelas5/5 (1)
- 7ºano Matemática Atividade 13 Instruções e Gabarito Da Atividade 12Documento6 páginas7ºano Matemática Atividade 13 Instruções e Gabarito Da Atividade 12Evelyn Pimentel Santa BrígidaAinda não há avaliações
- Casa e Decoração - Maio 2020Documento96 páginasCasa e Decoração - Maio 2020MiyoxAinda não há avaliações
- Relatório de Estágio na EJA e Espaço Não EscolarDocumento24 páginasRelatório de Estágio na EJA e Espaço Não EscolarVivian Ribeiro100% (1)
- Questionario Solucao TampaoDocumento20 páginasQuestionario Solucao Tampaoeubacteria0% (1)
- Gestão Da Qualidade e Produtividade ProvaDocumento5 páginasGestão Da Qualidade e Produtividade ProvaTabata OliveiraAinda não há avaliações
- Arteterapia e Expressão CorporalDocumento26 páginasArteterapia e Expressão CorporalFelipe Salles Xavier100% (1)
- Servos Servas Santos Santas Sábios Sábias Solidários Solidárias PDFDocumento18 páginasServos Servas Santos Santas Sábios Sábias Solidários Solidárias PDFsias1959Ainda não há avaliações
- Abril Ciencias Cadeia e Teia AlimentarDocumento4 páginasAbril Ciencias Cadeia e Teia AlimentarLuciana MandarinoAinda não há avaliações
- Química Geral para Engenharia - Lista de Exercícios Unidades 7 e 8Documento3 páginasQuímica Geral para Engenharia - Lista de Exercícios Unidades 7 e 8kaymenezes0% (1)
- Exercícios de Química OrgânicaDocumento7 páginasExercícios de Química OrgânicaFernando AlbuquerqueAinda não há avaliações
- Exercícios de equilíbrio químico em neutralizaçãoDocumento2 páginasExercícios de equilíbrio químico em neutralizaçãoMaxuel LemosAinda não há avaliações
- Lista Exercicios Equilibrio Parte 2 PDFDocumento2 páginasLista Exercicios Equilibrio Parte 2 PDFsheldonsingAinda não há avaliações
- Equilíbrio Químico Lista de ExercíciosDocumento2 páginasEquilíbrio Químico Lista de ExercíciossheldonsingAinda não há avaliações
- Exercicios TampaoDocumento2 páginasExercicios TampaoJamussene Bernardo PedroAinda não há avaliações
- pH e equilíbrio ácido-baseDocumento2 páginaspH e equilíbrio ácido-baseliAinda não há avaliações
- Exercícios - Ácido-Base - QG - 2018Documento7 páginasExercícios - Ácido-Base - QG - 2018Melissa CoutoAinda não há avaliações
- Lista de Exercícios de Química Geral sobre Ácidos e BasesDocumento3 páginasLista de Exercícios de Química Geral sobre Ácidos e BasesvitorAinda não há avaliações
- Constante de equilíbrio iônico e grau de ionizaçãoDocumento6 páginasConstante de equilíbrio iônico e grau de ionizaçãoFrancisco RamosAinda não há avaliações
- 11FQA Ficha Trab Ini Q2.1 - N.º 2 SoluçãoDocumento9 páginas11FQA Ficha Trab Ini Q2.1 - N.º 2 SoluçãoLara BibesAinda não há avaliações
- Titulação de ácidos e basesDocumento5 páginasTitulação de ácidos e basesalmeida.agostinho8406Ainda não há avaliações
- 8 Lista de Exercícios Ácidos e Bases 2010. 2Documento1 página8 Lista de Exercícios Ácidos e Bases 2010. 2Rafael GomesAinda não há avaliações
- 21 titulacoesABDocumento2 páginas21 titulacoesABCarolina RodriguesAinda não há avaliações
- Equilíbrio Iônico Ácido-Base - 5a Lista de ExercíciosDocumento2 páginasEquilíbrio Iônico Ácido-Base - 5a Lista de ExercíciosAlex SantosAinda não há avaliações
- Acidez e Basicidade de moléculas orgânicas: reações e constantes de acidezDocumento1 páginaAcidez e Basicidade de moléculas orgânicas: reações e constantes de acidezAndressa GalloAinda não há avaliações
- Alfa - Módulo 45Documento20 páginasAlfa - Módulo 45Juliano Abreu PrattiAinda não há avaliações
- Atividades Globais SD3Documento5 páginasAtividades Globais SD3milenerato2240Ainda não há avaliações
- 9-Lista Exercicios - Geral 2 - Acidos e BasesDocumento2 páginas9-Lista Exercicios - Geral 2 - Acidos e Baseswloe16253649Ainda não há avaliações
- Lista 3 IC608 Equilbrio Qumico e Clculo de PHDocumento4 páginasLista 3 IC608 Equilbrio Qumico e Clculo de PHCris PowerAinda não há avaliações
- Lista Equilà Brio à Cido-Base 13 03 2023 - RevisadoDocumento5 páginasLista Equilà Brio à Cido-Base 13 03 2023 - Revisadolarinha40037Ainda não há avaliações
- Lista de QuimicaDocumento5 páginasLista de QuimicaLinniker Godoi0% (1)
- Química Geral - Ácidos, bases e eletroquímicaDocumento2 páginasQuímica Geral - Ácidos, bases e eletroquímicaGerald RodriguesAinda não há avaliações
- Comportamento ácido-base de sais e soluçõesDocumento8 páginasComportamento ácido-base de sais e soluçõesAdriana BartolomeuAinda não há avaliações
- FT1 - Equilíbrio Ácido - BaseDocumento2 páginasFT1 - Equilíbrio Ácido - BaseAndré MatosAinda não há avaliações
- Equilibrio Acido BaseDocumento7 páginasEquilibrio Acido BaseSílvio Gualter Manuel Filipe0% (1)
- Ficha de Trabalho Ácido-BaseDocumento3 páginasFicha de Trabalho Ácido-Base.Ainda não há avaliações
- Ficha de Trabalho Ácido-BaseDocumento3 páginasFicha de Trabalho Ácido-Base.Ainda não há avaliações
- 6° LISTA DE EXERCÍCIOS.2019. Acidos e Bases EngenhariaDocumento3 páginas6° LISTA DE EXERCÍCIOS.2019. Acidos e Bases EngenhariaAlessandro MarinhoAinda não há avaliações
- QUÍMICA ANALÍTICA QUALITATIVA LISTA DE EXERCÍCIOSDocumento2 páginasQUÍMICA ANALÍTICA QUALITATIVA LISTA DE EXERCÍCIOSMatheus TavaresAinda não há avaliações
- pH e Constantes de AcidezDocumento2 páginaspH e Constantes de AcidezClertan Souza Martins de PaulaAinda não há avaliações
- Lista de Exercícios de Química Analítica QualitativaDocumento3 páginasLista de Exercícios de Química Analítica QualitativaGabriela BuenoAinda não há avaliações
- Equilíbrio químicoDocumento4 páginasEquilíbrio químicoAriélly RolimAinda não há avaliações
- Soluções aquosas e equilíbrios ácido-baseDocumento4 páginasSoluções aquosas e equilíbrios ácido-basejoao sequeiraAinda não há avaliações
- Química 11oano - Ficha de Trabalho 6Documento4 páginasQuímica 11oano - Ficha de Trabalho 6Mariana VazAinda não há avaliações
- Lista TampõesDocumento1 páginaLista Tampõesjufaveri2001Ainda não há avaliações
- Equilc3adbrio Ic3b4nicoDocumento3 páginasEquilc3adbrio Ic3b4nicoromansara966Ainda não há avaliações
- B35 Lista 02 - Tratamento de Dados Concentracao de SolucoesCalculo de PHDocumento2 páginasB35 Lista 02 - Tratamento de Dados Concentracao de SolucoesCalculo de PHKurt WolfgangAinda não há avaliações
- Solução aquosa de amônia: cálculo da concentração de íons OHDocumento5 páginasSolução aquosa de amônia: cálculo da concentração de íons OHTarcisio SalesAinda não há avaliações
- Exercicios - Equilibrio Ácido-Base - 11.1Documento2 páginasExercicios - Equilibrio Ácido-Base - 11.1Djamila CorreiaAinda não há avaliações
- Ácidos e Bases Química GeralDocumento18 páginasÁcidos e Bases Química GeralTi FerpAinda não há avaliações
- Lista TampaoDocumento4 páginasLista TampaoThiago Henrique Oliveira0% (1)
- Lista de Exercícios Química AnalíticaDocumento4 páginasLista de Exercícios Química AnalíticaRonaldRaimannAinda não há avaliações
- Resolucao de Exercicios de Acido-BaseDocumento7 páginasResolucao de Exercicios de Acido-BaseSara e JorgeAinda não há avaliações
- Resolucao de Exercicios de Acido-BaseDocumento7 páginasResolucao de Exercicios de Acido-BaseviniciusmacielleiteAinda não há avaliações
- Análise QualitativaDocumento4 páginasAnálise QualitativaLUCIANEAinda não há avaliações
- Lista-3 Acidos Bases - 1Documento6 páginasLista-3 Acidos Bases - 1Camila VitóriaAinda não há avaliações
- Lista Exercícios Química FunçõesDocumento4 páginasLista Exercícios Química FunçõesEriclene SarmentoAinda não há avaliações
- EquilíbrioDocumento2 páginasEquilíbrioFCiênciasAinda não há avaliações
- EquilibrioIonico - AvançadosDocumento4 páginasEquilibrioIonico - AvançadosSaymon SiqueiraAinda não há avaliações
- CQ094 Exerc Cap 3Documento5 páginasCQ094 Exerc Cap 3geopaiva88Ainda não há avaliações
- Equi Lib RioDocumento3 páginasEqui Lib RioJhennifer FonsecaAinda não há avaliações
- Exercícios de Química Analítica sobre Titulações e TampõesDocumento5 páginasExercícios de Química Analítica sobre Titulações e TampõesIlzonRamosAinda não há avaliações
- Ficha de Trabalho 3 q12Documento5 páginasFicha de Trabalho 3 q12Tomás CostaAinda não há avaliações
- Cidos e BasesDocumento4 páginasCidos e BasesliviadgpAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Farmacologia na neonatologia de animais de estimaçãoDocumento6 páginasFarmacologia na neonatologia de animais de estimaçãoPatricia SalvadorAinda não há avaliações
- Soldagem com máxima resistência à trincasDocumento1 páginaSoldagem com máxima resistência à trincasRobson PereiraAinda não há avaliações
- Bioeletrogênese e potencial de repousoDocumento9 páginasBioeletrogênese e potencial de repousoDenise Barth RebescoAinda não há avaliações
- Física - Revista Superinteressante - A Maior Teoria Do Século (Mecânica Quântica)Documento1 páginaFísica - Revista Superinteressante - A Maior Teoria Do Século (Mecânica Quântica)edurafaelsantosAinda não há avaliações
- Q&A sobre Sistemas DistribuídosDocumento24 páginasQ&A sobre Sistemas DistribuídosDaniel VilelaAinda não há avaliações
- Construção Galpão Industrial 630m2Documento7 páginasConstrução Galpão Industrial 630m2Edimilson AlvesAinda não há avaliações
- Relatório SedimentaçãoDocumento25 páginasRelatório SedimentaçãoMarianaAinda não há avaliações
- God Of War: luz e cor transformam jogoDocumento9 páginasGod Of War: luz e cor transformam jogoMARLLON KWE DA SILVA FERREIRAAinda não há avaliações
- 4 CicloCelular (Odisseia)Documento39 páginas4 CicloCelular (Odisseia)Isis PensoAinda não há avaliações
- Curso Qualificação Técnica EletrônicaDocumento42 páginasCurso Qualificação Técnica EletrônicaLuan Lemos de SouzaAinda não há avaliações
- TeravadaDocumento16 páginasTeravadatemistenesAinda não há avaliações
- Orientação sobre prova prática do RevalidaDocumento51 páginasOrientação sobre prova prática do Revalidalucas fiuzaAinda não há avaliações
- Lectio DivinaDocumento9 páginasLectio DivinaSemearAinda não há avaliações
- Campanha de DanielDocumento3 páginasCampanha de DanielFrancisco José Vitor MarquesAinda não há avaliações
- Citologia Resumo Para EstudoDocumento6 páginasCitologia Resumo Para Estudojessicakarolina1117Ainda não há avaliações
- C ADRIANO Um Guia para As Vanguardas CinematográficasDocumento16 páginasC ADRIANO Um Guia para As Vanguardas CinematográficasTasha BallardAinda não há avaliações
- Livro Capítulo Alimentos Funcionais e Perspectivas de InovaçõesDocumento18 páginasLivro Capítulo Alimentos Funcionais e Perspectivas de InovaçõesPara a FamíliaAinda não há avaliações
- Web MZX500 300-P-1A PTDocumento82 páginasWeb MZX500 300-P-1A PTEverson BrandãoAinda não há avaliações
- Classificação Climática de Köppen-GeigerDocumento18 páginasClassificação Climática de Köppen-GeigerGuilherme Netter100% (1)
- Augusto Comte e o Surgimento Da SociologiaDocumento4 páginasAugusto Comte e o Surgimento Da SociologiaTayane CostaAinda não há avaliações
- Comandante Alfor - "O Retorno Ao Velho Continente" - 23.03.2017Documento3 páginasComandante Alfor - "O Retorno Ao Velho Continente" - 23.03.2017Antonio N-silvaAinda não há avaliações
- Cafeína en Alimentos y BebidasDocumento14 páginasCafeína en Alimentos y BebidasalejandrajriveroAinda não há avaliações
- Levantamento Florístico - UFMG PDFDocumento6 páginasLevantamento Florístico - UFMG PDFFernando FrançaAinda não há avaliações