Escolar Documentos
Profissional Documentos
Cultura Documentos
1 Lista de Exercícios de Complexometria
Enviado por
Cristiane0 notas0% acharam este documento útil (0 voto)
36 visualizações1 páginalista de exercícios de complexometria
Título original
1ª Lista de Exercícios de Complexometria
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOC, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentolista de exercícios de complexometria
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOC, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
36 visualizações1 página1 Lista de Exercícios de Complexometria
Enviado por
Cristianelista de exercícios de complexometria
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOC, PDF, TXT ou leia online no Scribd
Você está na página 1de 1
Instituto Federal do Rio de Janeiro – IFRJ
Campus Rio de Janeiro
1ª Lista de Exercícios de Complexometria
1 - Definir constante de formação condicional.
2 - A constante de formação do complexo chumbo-EDTA é 1,10 x 10 18. Calcular a
constante de formação condicional em pH 3 e em pH 10.
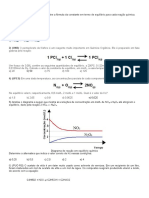
3 - Como varia a capacidade complexante do EDTA em função do pH do meio?
4 - Que tipo de espécie química podemos dosar diretamente com EDTA?
5 - Com relação à Complexometria, responda às questões abaixo:
a) Apesar de o aumento do pH favorecer a formação dos complexos de EDTA, não
podemos aumentar indiscriminadamente o pH do meio nas suas titulações. Por
quê?
b) Nas dosagens com EDTA, não permitimos (em quase todos os casos) que o meio seja
muito ácido, porque, como dissemos, “o abaixamento excessivo do pH tende a
destruir o complexo”. Por que na dosagem mercurimétrica de cloreto podemos
trabalhar com pH muito baixo? Obs.: Nós adicionamos HNO3 ao meio.
c) Na análise de Zn++ por EDTA que fizemos, elevamos o pH do meio a um valor no
qual o Zn++ geralmente precipita. Por que isto não aconteceu?
d) Na análise da água dura, que recurso usamos para que em uma titulação dosássemos
somente o cálcio e na outra o cálcio e o magnésio?
6 - Dê a fórmula estrutural do EDTA.
7- Quais são os outros agentes complexantes que existem? Para quais tipos de metais
eles servem?
Você também pode gostar
- Relatório de Solução-Tampão Citrato e Ác. CítricoDocumento17 páginasRelatório de Solução-Tampão Citrato e Ác. CítricoFelipe Pimentel Paixão100% (1)
- Questionario Exp 10Documento3 páginasQuestionario Exp 10Diana MarcelaAinda não há avaliações
- Exercicios de Bioquimica 1Documento20 páginasExercicios de Bioquimica 1Valdemiro NhantumboAinda não há avaliações
- Alfa - Módulo 47Documento22 páginasAlfa - Módulo 47Vanessa Menezes TheodoroAinda não há avaliações
- Roteiro de Aula 1 PH e TampõesDocumento4 páginasRoteiro de Aula 1 PH e TampõesMarcio BatistelaAinda não há avaliações
- 3°-Relatório de Aulas Práticas Bioquímica EstruturalDocumento24 páginas3°-Relatório de Aulas Práticas Bioquímica EstruturalVanderleia BernardoAinda não há avaliações
- Aula 7 - Acidez e BasicidadeDocumento14 páginasAula 7 - Acidez e Basicidadeleticia.iris06Ainda não há avaliações
- Questões Reposição de Ausências - Química2Documento1 páginaQuestões Reposição de Ausências - Química2Andrec FerrazAinda não há avaliações
- Logaritmos - PHDocumento3 páginasLogaritmos - PHFernando VianaAinda não há avaliações
- QUIMICADocumento2 páginasQUIMICAcarlosAinda não há avaliações
- Aula Equilibrio Acido Base 2Documento20 páginasAula Equilibrio Acido Base 2placreAinda não há avaliações
- Avaliacao de ConhecimentosDocumento10 páginasAvaliacao de ConhecimentosMatheus CamachoAinda não há avaliações
- Lista de Exercícios 2° Ano 27Documento2 páginasLista de Exercícios 2° Ano 27Anna OliveiraAinda não há avaliações
- Prova de Quimica Aplicada 1º BimestreDocumento2 páginasProva de Quimica Aplicada 1º BimestrevalterpimentelAinda não há avaliações
- Exercicios de Equilíbrio IônicoDocumento6 páginasExercicios de Equilíbrio IônicoCrisley DanielaAinda não há avaliações
- Lista 2º de Exercícios de PH e pOHDocumento4 páginasLista 2º de Exercícios de PH e pOHMárcia PoyartAinda não há avaliações
- O Que É PH - Toda MatériaDocumento1 páginaO Que É PH - Toda Matériammraul2124Ainda não há avaliações
- Cópia de Modelo de Relatório - Ácidos e Bases-1Documento6 páginasCópia de Modelo de Relatório - Ácidos e Bases-1picaopedro5Ainda não há avaliações
- Lista Revisão PO 2oano - 2osemestreDocumento10 páginasLista Revisão PO 2oano - 2osemestremauoscuroAinda não há avaliações
- Cesaltino Soares MartinsDocumento8 páginasCesaltino Soares MartinsEdhy CabralAinda não há avaliações
- Lista de Exercicios (Sistema Tampao e Protein As)Documento10 páginasLista de Exercicios (Sistema Tampao e Protein As)Viviane Costa100% (1)
- Primeira Lista de ExercíciosDocumento5 páginasPrimeira Lista de ExercíciosAlex Fonseca0% (1)
- Lista de ExercciosDocumento4 páginasLista de ExercciosVitoria AndradeAinda não há avaliações
- Volumetria de Complexação - Análise de CA em Leite em PóDocumento13 páginasVolumetria de Complexação - Análise de CA em Leite em PóEvandro Serafim Morais100% (1)
- Exercicio An Lise AmbientalDocumento3 páginasExercicio An Lise Ambientalyanna873Ainda não há avaliações
- Lista Sobre Equilíbrio Químico Química Geral PresençaDocumento4 páginasLista Sobre Equilíbrio Químico Química Geral PresençaAriélly RolimAinda não há avaliações
- Revisão ProjetoDocumento7 páginasRevisão ProjetoJucelino SantosAinda não há avaliações
- Questionario 02 - Equilibrio Quimico - RESPOSTASDocumento5 páginasQuestionario 02 - Equilibrio Quimico - RESPOSTASmisaelinacioAinda não há avaliações
- Lista Com GabaritoDocumento3 páginasLista Com GabaritoKety CostaAinda não há avaliações
- Prova de Quimica 3Documento3 páginasProva de Quimica 3Enzo VasconcelosAinda não há avaliações
- Lista de QuímicaDocumento7 páginasLista de QuímicaLetícia OliveiraAinda não há avaliações
- Revisões - FQ 2023Documento7 páginasRevisões - FQ 2023Marta TeresoAinda não há avaliações
- AP Equilíbrio Ácido-BaseDocumento5 páginasAP Equilíbrio Ácido-BaseValdimiro VarAinda não há avaliações
- 4-Exercícios BioquímicaDocumento4 páginas4-Exercícios BioquímicaGuilherme Henrique Costa SilvaAinda não há avaliações
- Constante de Dissociação ÁcidaDocumento9 páginasConstante de Dissociação ÁcidaRenan GuerraAinda não há avaliações
- Template de Relatório de Aulas Práticas - Química Geral e ExperimentalDocumento10 páginasTemplate de Relatório de Aulas Práticas - Química Geral e ExperimentalAmauri SilvaAinda não há avaliações
- FQE2 EXP8 TampaoDocumento12 páginasFQE2 EXP8 TampaoMarcelampbtAinda não há avaliações
- Ficha 3Documento5 páginasFicha 3Carlos LopesAinda não há avaliações
- Relatorio de TampãoDocumento9 páginasRelatorio de TampãoCaique EndelAinda não há avaliações
- Roteiro COMPLETO Das Aulas QMC 5307Documento65 páginasRoteiro COMPLETO Das Aulas QMC 5307Alessandra SantanaAinda não há avaliações
- Experiemneto 1 - Titulação Ácido BaseDocumento10 páginasExperiemneto 1 - Titulação Ácido BaseVinicius NogueiraAinda não há avaliações
- Prtica TAMPODocumento6 páginasPrtica TAMPOkassiojfAinda não há avaliações
- QUI01046 - Roteiros Das Práticas - 2023 - 2Documento19 páginasQUI01046 - Roteiros Das Práticas - 2023 - 2Bruno Schafer ManiqueAinda não há avaliações
- Gabarito Praticas - LaboratoriaDocumento15 páginasGabarito Praticas - Laboratoriadianaalmeiida08Ainda não há avaliações
- 7 Lista - Equilíbrio IônicoDocumento2 páginas7 Lista - Equilíbrio IônicoClertan Souza Martins de PaulaAinda não há avaliações
- Titulometria e Formação de ComplexosDocumento26 páginasTitulometria e Formação de ComplexosHenrique Fernandes100% (2)
- Aula 8 - Volumetria de Precipitação - Prof. CasteloDocumento48 páginasAula 8 - Volumetria de Precipitação - Prof. CasteloNarciso BaloiAinda não há avaliações
- P HDocumento2 páginasP HliAinda não há avaliações
- Lista de Exercícios QuímicaDocumento6 páginasLista de Exercícios QuímicaJulia MargrafAinda não há avaliações
- Aula 2 - VoltametriaDocumento48 páginasAula 2 - VoltametriaRaimundo Rodrigues RodriguesAinda não há avaliações
- Prova Mestrado IQ Unicamp 2011-2sDocumento7 páginasProva Mestrado IQ Unicamp 2011-2srennan_ps49950% (2)
- 1 Lista de Exerc-Quím Org-RafaelDocumento4 páginas1 Lista de Exerc-Quím Org-RafaelRokcclaneAinda não há avaliações
- Roteiro COMPLETO Das Aulas QMC 5307Documento65 páginasRoteiro COMPLETO Das Aulas QMC 5307ZoordiAinda não há avaliações
- Apostila I - Bioquímica IIIDocumento68 páginasApostila I - Bioquímica IIIBia la FériaAinda não há avaliações
- Teste Modulo Q4 12DDocumento4 páginasTeste Modulo Q4 12DCatarina VelosoAinda não há avaliações
- Relatório Solução TampãoDocumento7 páginasRelatório Solução TampãoLuana Silva FerreiraAinda não há avaliações
- PH e Condutividade Elétrica de Ácidos e BasesDocumento3 páginasPH e Condutividade Elétrica de Ácidos e BasesFernanda MattosAinda não há avaliações
- Telemetria Com Envio De E-mail Para Medir Ph Com Base No Esp8266 Programado Em ArduinoNo EverandTelemetria Com Envio De E-mail Para Medir Ph Com Base No Esp8266 Programado Em ArduinoAinda não há avaliações
- Projetos Com Esp8266 Programado Em Lua - Parte XxiNo EverandProjetos Com Esp8266 Programado Em Lua - Parte XxiAinda não há avaliações
- Projetos Em Clp Ladder Baseado No Twidosuite Parte XiiNo EverandProjetos Em Clp Ladder Baseado No Twidosuite Parte XiiAinda não há avaliações