Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista 1
Enviado por
Tatiana Hartenberger CiscottoDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Lista 1
Enviado por
Tatiana Hartenberger CiscottoDireitos autorais:
Formatos disponíveis
1
Universidade Federal Fluminense
EGQ - Instituto de Química
GQA - Departamento de Química Analítica
Química Analítica I
Prof: Rafael Machado Dornellas
1ª Lista de Exercícios
1 – O ser humano adulto possui, em média, 4,90 litros de sangue com cloreto de
sódio (NaCl) dissolvido na concentração de 5,40 g/L. Qual é a massa total de
cloreto de sódio (NaCl) no sangue de uma pessoa adulta? Resposta: 26,46 g
2 - Qual a concentração em mol L-1 (molaridade) de uma solução que contém
260,00 g de ácido sulfúrico (H2SO4) em 520,00 cm3 de solução? Dados: MA
(g/mol) H=1,00; S=32,00; O=16,00. Resposta: 5,10 mol L-1.
3 - Qual a concentração, em g/L, de uma solução resultante da dissolução de
75,00 g de NaCl para um volume final de 333,00 mL? Resposta: 225,20 g/L
4 - Qual o volume final que deve ter uma solução para que tenha concentração
igual a 12,30 g/L a partir de 49,00 g de soluto? Resposta: 3,98 L
5 - Determine a massa de NaCl existente em um galão de 4 litros contendo água
do mar. Dados: MMNaCl = 58,50 g / mol, molaridade = 0,60 molar. Resposta:139,20
g.
6- Uma solução de K2SO4 em água foi preparada de acordo com os seguintes
dados: MA (g/mol) K = 39,00; S = 32,00; O = 16,00; m = 8,70 g, V = 500,00 mL
Pede-se calcular:
a) A concentração em g / L. Resposta:17,40 g/L
b) A densidade em g/cm3. Resposta:1,74 x 10-2 g/cm3
2
c) A molaridade da solução. Resposta: 0,10 M
7 – Prepare uma solução de 250,00 mL de solução de ácido perclórico 0,50 mol
L-1 a partir do ácido perclórico concentrado. Descreva os cálculos e procedimentos
envolvidos.
(Dado: Cl=35,50 g/mol; H=1,00 g/mol; O = 16,00 g/mol, densidade 1,68 g mL-1 e
pureza 70,00% (m/v))
8 - Prepare uma solução de 50,00 mL de solução de ácido clorídrico 0,05 mol L-1
a partir do ácido clorídrico concentrado. Descreva os cálculos e procedimentos
envolvidos.
(Dado: Cl=35,50 g/mol; H=1,00 g/mol; densidade 1,19 kg L-1 e pureza 36,00 a
37,00 % (m/v))
9 - Em termos de condutibilidade elétrica, qual a diferença entre uma solução de
sal (NaCl) e uma solução de açúcar (sacarose C12H22O11)?
10 - Qual o requisito básico para haver uma solução condutora de corrente
elétrica?
11 - Uma mistura de óleo + água pode ser considerada uma solução? Explique.
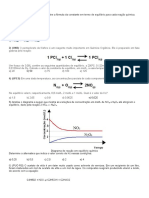
12 - Considere o equilíbrio que ocorre em fase gasosa a uma certa temperatura:
SO3 + NO SO2 + NO2
3
Explique:
a) o efeito no equilíbrio provocado pela remoção de NO2.
b) por que um aumento de pressão sobre o sistema não influi no equilíbrio.
13 - Um sistema está em equilíbrio quando todas as suas propriedades são as
mesmas em todos os seus pontos e não variam com o tempo.
Em relação ao equilíbrio químico:
N2(g) + 3 H2(g) ⇔ 2 NH3(g),
Qual ou quais as afirmativas são corretas?
a) Diminuindo a quantidade de NH3(g), o equilíbrio se desloca para a direita.
b) Aumentando a quantidade de H2(g), o equilíbrio se desloca para a direita.
c) Diminuindo a quantidade de N2(g), o equilíbrio se desloca para a esquerda.
d) Aumentando ou diminuindo as quantidades das espécies químicas dessa
equação, o equilíbrio não se altera.
e) Aumentando a pressão, o equilíbrio se desloca para a esquerda.
14 - O que é o efeito salino do eletrólito? Defina força iônica. Qual é a força iônica
µ de uma solução 0,08 mol L-1 de H2SO4 e 0,09 mol L-1 Mn(NO3)2 ? Compare a
força iônica e a concentração molar.
15 - Qual a razão de se empregar o parâmetro atividade no lugar de
concentração?
4
16 – Calcule a atividade utilizando a equação Debye-Hückel e a equação
estendida para os íons de uma solução contendo HClO4 0,10 mol/L e Mn(NO3)2
0,12 mol/L? Compare a diferença entre os resultados obtidos. Dados: 𝜶𝒙 = 9,00;
3,00; 5,00; 6,00 e 3,00 para H+, ClO4-, Mn2+ e NO3-, respectivamente. A = 50,83 x
10-2 e B = 32,81 x 10-2.
Você também pode gostar
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Lista de Exercícios IIDocumento6 páginasLista de Exercícios IIIgor Ferreira da SilvaAinda não há avaliações
- 1a Lista de Exercícios - Química IIDocumento5 páginas1a Lista de Exercícios - Química IIAlmeida Malembe100% (1)
- Introdução A Quimica AnalíticaDocumento5 páginasIntrodução A Quimica AnalíticaGuilherme FernandesAinda não há avaliações
- Exercícios de Química AnalíticaDocumento5 páginasExercícios de Química AnalíticaChrys Prazeres100% (1)
- Quimica AnaliicaDocumento8 páginasQuimica AnaliicaCamila MoreiraAinda não há avaliações
- 2 A Lista de Exerccios Qumica Analtica Clssica PDFDocumento3 páginas2 A Lista de Exerccios Qumica Analtica Clssica PDFAna MyrtaAinda não há avaliações
- Concentrações Das Soluções 2Documento16 páginasConcentrações Das Soluções 2GleisonAinda não há avaliações
- Lista de Exercício de Química AnalíticaDocumento4 páginasLista de Exercício de Química AnalíticaLuisa Gardênia FariasAinda não há avaliações
- Exercicios SolubilidadeDocumento13 páginasExercicios SolubilidadeManuel FranciscoAinda não há avaliações
- Química Geral e Inorgânica I UEM - Fac. Ciências - Depto de QuímicaDocumento7 páginasQuímica Geral e Inorgânica I UEM - Fac. Ciências - Depto de QuímicaGeremias Armindo ArmindoAinda não há avaliações
- Lista 2 - QFL1111Documento3 páginasLista 2 - QFL11115qjs9spvngAinda não há avaliações
- Disciplina: Eb932A - Química Geral Aplicada A Engenharia - Profa. Dra. Maria Aparecida Carvalho de MedeirosDocumento19 páginasDisciplina: Eb932A - Química Geral Aplicada A Engenharia - Profa. Dra. Maria Aparecida Carvalho de MedeirosGabriel Marinho RamosAinda não há avaliações
- Lista de Exercícios de Química Analítica IDocumento2 páginasLista de Exercícios de Química Analítica ICaroline BarrosoAinda não há avaliações
- Exercícios Extras de SoluçõesDocumento4 páginasExercícios Extras de SoluçõesDavi VergaraAinda não há avaliações
- AdhbhskDocumento3 páginasAdhbhskKatia FonsecaAinda não há avaliações
- Gama - Módulo SolucoesDocumento24 páginasGama - Módulo SolucoesAntonio ManuelAinda não há avaliações
- Lista 3 EnunciadosDocumento7 páginasLista 3 EnunciadosFelipe FelixAinda não há avaliações
- 1 Lista Exercicios Quantitativa 2013Documento4 páginas1 Lista Exercicios Quantitativa 2013Emanuele Dal Pisol SchwabAinda não há avaliações
- 1a Lista de Exercícios QUI126 Oficial 2Documento5 páginas1a Lista de Exercícios QUI126 Oficial 2Eugenio ManuelAinda não há avaliações
- Lista de Exercícios - QUI 119Documento3 páginasLista de Exercícios - QUI 119Odilon NetoAinda não há avaliações
- Lista de Exercício Química Analítica Quantitativa PDFDocumento2 páginasLista de Exercício Química Analítica Quantitativa PDFNely Targino67% (3)
- Avaliacao Parcial Sobre Efeitos Coligativos 2018Documento17 páginasAvaliacao Parcial Sobre Efeitos Coligativos 2018Clebson RamosAinda não há avaliações
- QUíMICA - 1 AnoDocumento6 páginasQUíMICA - 1 AnoMaria OliveiraAinda não há avaliações
- Lista de Soluções AlineDocumento3 páginasLista de Soluções AlineAna MyrtaAinda não há avaliações
- Lista de Métodos Instrumentais de AnáliseDocumento3 páginasLista de Métodos Instrumentais de AnáliseDimitrius000% (1)
- Mistura de Soluções Com Reação Química e TitulaçãoDocumento10 páginasMistura de Soluções Com Reação Química e TitulaçãoCláudio DanielAinda não há avaliações
- 1 - Lista de Exercicios 08 - 08 - 11Documento5 páginas1 - Lista de Exercicios 08 - 08 - 11Beth Koltz100% (1)
- Lista 1 - Calculo 4Documento3 páginasLista 1 - Calculo 4Mayara FigueiredoAinda não há avaliações
- QuiDocumento10 páginasQuiMaria ClaraAinda não há avaliações
- Analise Titrimetrica e Espctroscopia MolecularDocumento2 páginasAnalise Titrimetrica e Espctroscopia MolecularSandra SilvaAinda não há avaliações
- Prova 2010.1 OkDocumento2 páginasProva 2010.1 OkISRAEL DA LUZ RODRIGUESAinda não há avaliações
- Exercícios Soluções (Com Gabarito)Documento4 páginasExercícios Soluções (Com Gabarito)Orlando FirmezaAinda não há avaliações
- Molaridade e Normalidade - Exercícios e TeoriaDocumento3 páginasMolaridade e Normalidade - Exercícios e TeoriaAlbertoAlecioAinda não há avaliações
- Lista Sobre Equilíbrio Químico Química Geral PresençaDocumento4 páginasLista Sobre Equilíbrio Químico Química Geral PresençaAriélly RolimAinda não há avaliações
- 1 Lista de Exercicios de Quimica CEIS - 2 UNIDADEDocumento5 páginas1 Lista de Exercicios de Quimica CEIS - 2 UNIDADEMannulo100% (1)
- Lista de Exercicio - Solucoes.cinetica - equilibrio.quimico.2015.2.CE801.QuimicaGeralDocumento5 páginasLista de Exercicio - Solucoes.cinetica - equilibrio.quimico.2015.2.CE801.QuimicaGeralismaelsilva3692Ainda não há avaliações
- Aula 8 - Estequiometria Parte IIIDocumento26 páginasAula 8 - Estequiometria Parte IIIbrandownAinda não há avaliações
- Lista de Exercicios 1Documento4 páginasLista de Exercicios 1Mariana MartinsAinda não há avaliações
- Exercícios Lista 2 (Atualizada)Documento2 páginasExercícios Lista 2 (Atualizada)Laura Antonio SantosAinda não há avaliações
- 4879ae3c3f022c31ef2371c718039c86Documento2 páginas4879ae3c3f022c31ef2371c718039c86Jobson Tavares TeixeiraAinda não há avaliações
- TopD Reacoes em Solucao Aquosa e Estequiometria RESPOSTASDocumento7 páginasTopD Reacoes em Solucao Aquosa e Estequiometria RESPOSTASMaria AliceAinda não há avaliações
- 1a Lista Unidades ConcDocumento3 páginas1a Lista Unidades ConcJoão Lucas PaulaAinda não há avaliações
- Segunda Prova de QG - Gabarito - Versão FinalDocumento3 páginasSegunda Prova de QG - Gabarito - Versão FinalThomas JacobsenAinda não há avaliações
- Atividade de Íons H3O+ em SoluçãoDocumento17 páginasAtividade de Íons H3O+ em SoluçãoAna Paula MathiasAinda não há avaliações
- Relatório Preparo de SoluçõesDocumento8 páginasRelatório Preparo de Soluçõescarlossvinicius987Ainda não há avaliações
- Titulação - Módulo 27Documento22 páginasTitulação - Módulo 27Ricardo AlmeidaAinda não há avaliações
- Exercícios QFL1150Documento9 páginasExercícios QFL1150Renata MullerAinda não há avaliações
- Gama - Módulo 23Documento15 páginasGama - Módulo 23Profe KeideeAinda não há avaliações
- Lista de Exercícios - Operações Com SoluçõesDocumento2 páginasLista de Exercícios - Operações Com SoluçõesBiancaAinda não há avaliações
- Lista Cinética - Qmc5138Documento5 páginasLista Cinética - Qmc5138Joice SchuhAinda não há avaliações
- A No 3Documento2 páginasA No 3Gabriel ZemunerAinda não há avaliações
- Relações Entre As Concentrações Das SoluçõesDocumento15 páginasRelações Entre As Concentrações Das SoluçõesGleisonAinda não há avaliações
- Lista 1 de Exercicios - SolucoesDocumento2 páginasLista 1 de Exercicios - SolucoesnalytoncostaAinda não há avaliações
- Lista 2Documento2 páginasLista 2Raquel CamposAinda não há avaliações
- 2a Lista de ExercíciosDocumento6 páginas2a Lista de Exercíciosramon7789Ainda não há avaliações
- QuiV152 84Documento20 páginasQuiV152 84Rokcclaneiguatu@gmail.comAinda não há avaliações
- Mistura de Solucoes Com Reacao QuimicaDocumento6 páginasMistura de Solucoes Com Reacao QuimicaRonaldo AdrianoAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Grupo1 Aromaterapia LaabDocumento11 páginasGrupo1 Aromaterapia LaabTatiana Hartenberger CiscottoAinda não há avaliações
- Lista 2Documento4 páginasLista 2Tatiana Hartenberger CiscottoAinda não há avaliações
- CronogramaDocumento2 páginasCronogramaTatiana Hartenberger CiscottoAinda não há avaliações
- Lista QuimicaDocumento2 páginasLista QuimicaTatiana Hartenberger CiscottoAinda não há avaliações
- Gab List 2Documento4 páginasGab List 2Tatiana Hartenberger CiscottoAinda não há avaliações
- Lista 2: Cinemática em Uma DimensãoDocumento5 páginasLista 2: Cinemática em Uma DimensãoTatiana Hartenberger CiscottoAinda não há avaliações
- Importante:: Lista 1: Conceitos de MovimentoDocumento3 páginasImportante:: Lista 1: Conceitos de MovimentoTatiana Hartenberger CiscottoAinda não há avaliações
- IogurteDocumento11 páginasIogurteTatiana Hartenberger CiscottoAinda não há avaliações
- Apostila de Laboratório de Fisqui 1 Técnico SecuredDocumento23 páginasApostila de Laboratório de Fisqui 1 Técnico SecuredJean Cesar BenassiAinda não há avaliações
- Quimica Geral Exercicios Resolvidos PH1Documento18 páginasQuimica Geral Exercicios Resolvidos PH1Ti FerpAinda não há avaliações
- Correcao Exame Normal Q. Analitica 2011Documento4 páginasCorrecao Exame Normal Q. Analitica 2011Gabriel Bonifacio ViagemAinda não há avaliações
- Química Analítica ExperimentalDocumento30 páginasQuímica Analítica ExperimentalGabriel GuimarãesAinda não há avaliações
- Apostila Análise de Processos Físico Químicos 2016Documento54 páginasApostila Análise de Processos Físico Químicos 2016Raquel Izabel De Souza SantosAinda não há avaliações
- AULA1Documento11 páginasAULA1Pâmela FerreiraAinda não há avaliações
- Apostila 2020 2 FinalDocumento26 páginasApostila 2020 2 FinalMarcello TrevisanAinda não há avaliações
- Relatório Actividade ExperimentalDocumento10 páginasRelatório Actividade Experimentalvalsassina100% (3)
- Princípios de CromatografiaDocumento49 páginasPrincípios de CromatografiaNoberto Fontenele FrotaAinda não há avaliações
- Aula 7 RedoxDocumento39 páginasAula 7 RedoxDanilo FerreiraAinda não há avaliações
- Exercícios Equilíbrio QuímicoDocumento3 páginasExercícios Equilíbrio QuímicoDayane TelesAinda não há avaliações
- Aula 8 Química Da Atmosfera Parte 3 1S2018Documento28 páginasAula 8 Química Da Atmosfera Parte 3 1S2018Izabelli de PieriAinda não há avaliações
- Aula 3 Cálculo Do Equilíbrio QuímicoDocumento2 páginasAula 3 Cálculo Do Equilíbrio QuímicoMYLENA FARIAS DO NASCIMENTOAinda não há avaliações
- Lista Exercícios Ácido BaseDocumento3 páginasLista Exercícios Ácido BaseSâmia DantasAinda não há avaliações
- Gabarito Lista de Exercicios P2 QAQ PDFDocumento19 páginasGabarito Lista de Exercicios P2 QAQ PDFElyakyn GuimarãesAinda não há avaliações
- A.L 1.6Documento2 páginasA.L 1.6Pedro DiasAinda não há avaliações
- Calculo de Volumes - 1 PDFDocumento2 páginasCalculo de Volumes - 1 PDFLeandro Flávia RochaAinda não há avaliações
- Ficha 10 - Equilibrio Iônico Da Água, PH e pOHDocumento10 páginasFicha 10 - Equilibrio Iônico Da Água, PH e pOHcastellarclara210Ainda não há avaliações
- 3a AulaDocumento14 páginas3a AulaDiego FrançaAinda não há avaliações
- Novo 12Q - Miniteste Sobre A AL 3 - FuncionamentoDocumento3 páginasNovo 12Q - Miniteste Sobre A AL 3 - FuncionamentoTelmo NunesAinda não há avaliações
- Determinação Da Acidez Total em Frutas CítricasDocumento7 páginasDeterminação Da Acidez Total em Frutas CítricasCristiane MotaAinda não há avaliações
- 1-Sistema TampaoDocumento43 páginas1-Sistema TampaoProf Adriana FroutmanAinda não há avaliações
- Atividade 2 Instrumental - 2021Documento5 páginasAtividade 2 Instrumental - 2021João Bruno GontijoAinda não há avaliações
- TitulaçãoDocumento2 páginasTitulaçãoGabriel Thomé da RosaAinda não há avaliações
- Aula 7 - Equilíbrio Ácido-BaseDocumento33 páginasAula 7 - Equilíbrio Ácido-BaseAfonso VasconcelosAinda não há avaliações
- Solos TP6 Troca Ionica 2020Documento17 páginasSolos TP6 Troca Ionica 2020Diogo SMVAinda não há avaliações
- Lista 4 - Titulação Ácido e BaseDocumento3 páginasLista 4 - Titulação Ácido e BaseRaquel Ramos Morita 202010257811Ainda não há avaliações
- Relatorio 4Documento13 páginasRelatorio 4Geilson SilvaAinda não há avaliações
- Exercicios de VolumetriaDocumento5 páginasExercicios de Volumetriaquimica antares26Ainda não há avaliações
- Lista TampaoDocumento4 páginasLista TampaoThiago Henrique Oliveira0% (1)