Escolar Documentos
Profissional Documentos
Cultura Documentos
Química Prof. Durval Exercícios Corrigidos 02.03 2º Ano
Enviado por
thomasbarreto213Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Química Prof. Durval Exercícios Corrigidos 02.03 2º Ano
Enviado por
thomasbarreto213Direitos autorais:
Formatos disponíveis
CEMP – ENSINO MÉDIO
2º ANO
QUÍMICA PROF. DURVAL – EXERCÍCIOS CORRIGIDOS – SEGUNDO ANO – 02/ 03/ 21
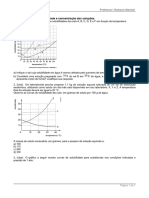
1) (Ime 2017) A figura a seguir representa as curvas de solubilidade de duas substâncias e
Com base nela, pode-se afirmar que:
a) No ponto as soluções apresentam a mesma temperatura mas as solubilidades de e são diferentes.
b) A solução da substância está supersaturada no ponto
c) As soluções são instáveis no ponto
d) As curvas de solubilidade não indicam mudanças na estrutura dos solutos.
e) A solubilidade da substância segue o perfil esperado para a solubilidade de gases em água.
2) (Acafe 2016) O cloreto de potássio é um sal que adicionado ao cloreto de sódio é vendido
comercialmente como “sal light”, com baixo teor de sódio. Dezoito gramas de cloreto de potássio estão
dissolvidos em de água e armazenados em um frasco aberto sob temperatura constante de
Dados: Considere a solubilidade do cloreto de potássio a igual a de água.
Qual a massa mínima e aproximada de água que deve ser evaporada para iniciar a cristalização do soluto?
a)
b) 60º ===== 45/100= m/200 ==== m=90g
90/200 = 18/ x(massa de água )
x=40g
massa evaporada = 200- 40 =160g
c)
d)
3) (Ufes 1996) Ao se adicionar cloreto de amônio a uma certa quantidade de água a 25 C, observa-se um
°
resfriamento na solução. Com base nessa informação, pode-se afirmar:
a) O processo é exotérmico e a solubilidade do NH Cℓ aumenta com o aumento da temperatura.
4
b) O processo é endotérmico e a solubilidade do NH Cℓ aumenta com o aumento da temperatura.
4
c) O processo é exotérmico e a solubilidade do NH Cℓ diminui com o aumento da temperatura.
4
d) O processo é endotérmico e a solubilidade do NH Cℓ diminui com o aumento da temperatura.
4
e) O processo é endotérmico e a solubilidade do NH Cℓ independe da temperatura.
4
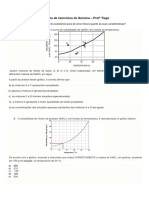
4) . (Unesp 2009) No gráfico, encontra-se representada a curva de solubilidade do nitrato de potássio (em
gramas de soluto por 1000 g de água).
200/500 = m/1000 ==== m=400g
ponto no gráfico
Para a obtenção de solução saturada contendo 200 g de nitrato de potássio em 500 g de água, a solução
deve estar a uma temperatura, aproximadamente, igual a
a) 12°C. b) 17°C. c) 22°C. d) 27°C. e) 32°C.
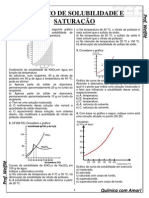
5) Analise o gráfico que representa a solubilidade do (massa molar em água à pressão
a) A dissolução do gás carbônico em água é um processo endotérmico ou exotérmico? Justifique sua resposta.
b) Calcule a quantidade de gás carbônico, em g, dissolvida em litro de água, a ea saturada
com este gás. Apresente os cálculos efetuados.
pelo gráfico
10°c :::::::: 0,22g/100ml
0,22g/100ml = m / 1000ml
m=2,2g
6)A sacarose é extraordinariamente solúvel em água, como mostram os dados da tabela abaixo.
T (°C) 30 50
Solubilidade 220 260
A)Prepara-se uma solução saturada(limite) dissolvendo de sacarose em de água a Qual a
quantidade de água a ser adicionada a esta solução inicial, de modo que, quando a solução resultante for
resfriada até tenhamos uma solução saturada de sacarose em água, sem presença de precipitados
(corpo de fundo)?
50º ===sat.=65g/25g
tabela: 30º=====220/100 = 65/m(massa de água)
m= 29,5g
massa de água adicionada= 29,5 - 25= 4,5 g de água adicionada
B) Qual a classificação da solução obtida dissolvendo 100g de sacarose em 50g de água a 30ºC?
tabela: 30º=====220/100 = m /50 ==== m=110g
100g<110g ===solução insaturada
Você também pode gostar
- Provas de admissão para escola marista em AngolaDocumento5 páginasProvas de admissão para escola marista em AngolaYamba António Mfulu QI76% (17)
- Misturas PDFDocumento2 páginasMisturas PDFAngela Maria100% (1)
- Coeficiente de SolubilidadeDocumento5 páginasCoeficiente de SolubilidadeRubia MariathAinda não há avaliações
- 16 SolubilidadeDocumento7 páginas16 SolubilidadeFRANKE MERO TESTEAinda não há avaliações
- Solubilidade e curvas de solubilidadeDocumento19 páginasSolubilidade e curvas de solubilidadeJoão PauloAinda não há avaliações
- 2012 - TMedicina - Quimica - Borges - Exercícios de Solubilidade - SiteDocumento12 páginas2012 - TMedicina - Quimica - Borges - Exercícios de Solubilidade - SiteDhieniffer FerreiraAinda não há avaliações
- 16 SolubilidadeDocumento6 páginas16 SolubilidadeEverton FisicoAinda não há avaliações
- Exercícios Soluções QuímicaDocumento6 páginasExercícios Soluções QuímicaRenan Barcelos MendesAinda não há avaliações
- Coeficiente de SolubilidadeDocumento38 páginasCoeficiente de SolubilidadeMarguiené BragaAinda não há avaliações
- ListaExercíciosQuímicaSoluçõesDocumento5 páginasListaExercíciosQuímicaSoluçõesAna Ester CavalcanteAinda não há avaliações
- Estudo Das Solucoes Coeficiente de SolubilidadeDocumento13 páginasEstudo Das Solucoes Coeficiente de SolubilidadeGildo Silva100% (1)
- SolubilidadeDocumento38 páginasSolubilidadeLXM10% (1)
- Atividade Sobre Coeficiente de SolubilidadeDocumento13 páginasAtividade Sobre Coeficiente de SolubilidadePedro HélioxAinda não há avaliações
- Curva de solubilidade de cloreto de amônioDocumento83 páginasCurva de solubilidade de cloreto de amônioThiago Alonso Rodrigues da Hora67% (3)
- Soluções (Curvas de SolubilidadeDocumento38 páginasSoluções (Curvas de SolubilidadeGleisonAinda não há avaliações
- Soluções e solubilidadeDocumento15 páginasSoluções e solubilidadeRaquel Reis Duarte PinheiroAinda não há avaliações
- DL 50Documento11 páginasDL 50Rita Sofia Ramos MesquitaAinda não há avaliações
- Química Lista de ExercíciosDocumento4 páginasQuímica Lista de Exercícioshtq87rbdjgAinda não há avaliações
- Exercícios Coeficiente de SolubilidadeDocumento7 páginasExercícios Coeficiente de SolubilidadeGraciete QuentalAinda não há avaliações
- Soluções químicas e concentraçõesDocumento39 páginasSoluções químicas e concentraçõesbio1988Ainda não há avaliações
- Gab - gb22 Lrp3b.qui 2emaeb 3bimDocumento3 páginasGab - gb22 Lrp3b.qui 2emaeb 3bimabidabugaAinda não há avaliações
- DispersõeDocumento5 páginasDispersõeHelton ClistenesAinda não há avaliações
- Capítulo 1 - SoluçõesDocumento18 páginasCapítulo 1 - SoluçõesGerson LimaAinda não há avaliações
- 31-Soluções e SolubilidadeDocumento4 páginas31-Soluções e Solubilidadenv77vnm100% (2)
- 12 - Soluções Curvas de SolubilidadeDocumento4 páginas12 - Soluções Curvas de SolubilidadeRodrigo MetteAinda não há avaliações
- Solucoes PDFDocumento15 páginasSolucoes PDFThiago Magno Tavares Machado100% (1)
- Fisico Quimica Solubilidade ExerciciosDocumento10 páginasFisico Quimica Solubilidade ExerciciosRubia MariathAinda não há avaliações
- Solubilidade da lactose e cristalizaçãoDocumento12 páginasSolubilidade da lactose e cristalizaçãoTiago RodriguesAinda não há avaliações
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Documento5 páginasA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10Ainda não há avaliações
- Lista Certa Do RobinhoDocumento4 páginasLista Certa Do RobinhogiovanarezendebensiAinda não há avaliações
- Lista 1 QG 1-19Documento6 páginasLista 1 QG 1-19schottbpAinda não há avaliações
- Estudo Das Soluções PDFDocumento47 páginasEstudo Das Soluções PDFRenanEQAinda não há avaliações
- Solubilidade Sal KNO3Documento8 páginasSolubilidade Sal KNO3Rafael MottaAinda não há avaliações
- Arquivo de Soluções Do Prof° VieiraDocumento9 páginasArquivo de Soluções Do Prof° VieiravieirasalesAinda não há avaliações
- CoeficienteDocumento12 páginasCoeficienteOtoazevedo OtoazevedoAinda não há avaliações
- Solubilidade de sais e efeitos da temperaturaDocumento10 páginasSolubilidade de sais e efeitos da temperaturaLuana GregórioAinda não há avaliações
- Exercicios de SolubilidadeDocumento6 páginasExercicios de Solubilidadesua mae de 4Ainda não há avaliações
- Gama - Módulo 19Documento23 páginasGama - Módulo 19Koelho CoelhoAinda não há avaliações
- Atividade 5 de Abril - Pré ProvaDocumento5 páginasAtividade 5 de Abril - Pré ProvaAlfredo Sahade VespaAinda não há avaliações
- Soluções saturadas de sais: propriedades e aplicaçõesDocumento2 páginasSoluções saturadas de sais: propriedades e aplicaçõesromezioh7716Ainda não há avaliações
- Gabarito Lista 1- SoluçõesDocumento5 páginasGabarito Lista 1- Soluçõesbrigida.lucinAinda não há avaliações
- Lista de exercícios de Química sobre solubilidade e concentraçãoDocumento4 páginasLista de exercícios de Química sobre solubilidade e concentraçãoMichel KaipperAinda não há avaliações
- Lista Química 2º (A, B, C e D)Documento4 páginasLista Química 2º (A, B, C e D)wwwisaque18Ainda não há avaliações
- SolubilidadeDocumento4 páginasSolubilidadeCleber SerafinAinda não há avaliações
- Atividade Propriedades ColigativasDocumento4 páginasAtividade Propriedades ColigativasRafaela França MariniAinda não há avaliações
- 378870-Módulo 01 - Soluções 1 PDFDocumento8 páginas378870-Módulo 01 - Soluções 1 PDFÍtalo SantosAinda não há avaliações
- Fisicoquimica II ApostilaDocumento36 páginasFisicoquimica II ApostilaMario SantanaAinda não há avaliações
- Solubilidade de sais: conceitos e curvas de solubilidadeDocumento12 páginasSolubilidade de sais: conceitos e curvas de solubilidadeCarolynne MourãoAinda não há avaliações
- Coeficiente de Solubilidade e Tipos de SaturaçãoDocumento5 páginasCoeficiente de Solubilidade e Tipos de SaturaçãoWelff Junior100% (2)
- Apostila QUÍMICA Com GabaritoDocumento39 páginasApostila QUÍMICA Com GabaritoMichelle Alkmim50% (2)
- Lista+de+exercícios+para+1 +prova+Quimica+AnalíticaDocumento5 páginasLista+de+exercícios+para+1 +prova+Quimica+Analíticabenedito.nasaAinda não há avaliações
- Química: 3 Lista de ResoluçãoDocumento5 páginasQuímica: 3 Lista de ResoluçãoJader Pereira de AraujoAinda não há avaliações
- Coeficiente de solubilidade de saisDocumento48 páginasCoeficiente de solubilidade de saisandreik83100% (1)
- Exercicios SolucoesDocumento12 páginasExercicios SolucoesEraclitoSL91% (11)
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Tratamento de Lodos de Estações de Tratamento de ÁguaNo EverandTratamento de Lodos de Estações de Tratamento de ÁguaAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Biodiesel de Óleo de Babaçu por Destilação ReativaNo EverandBiodiesel de Óleo de Babaçu por Destilação ReativaAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Teste de Electrotecnia: Circuitos ElétricosDocumento3 páginasTeste de Electrotecnia: Circuitos ElétricosPaulo MoreiraAinda não há avaliações
- DS SG36KTL-M PTBRDocumento2 páginasDS SG36KTL-M PTBReduardoAinda não há avaliações
- Matemática: Problemas de geometria e porcentagemDocumento1 páginaMatemática: Problemas de geometria e porcentagemJoao fillipe SantiagoAinda não há avaliações
- Trabalho da Força Elétrica sobre CargasDocumento6 páginasTrabalho da Força Elétrica sobre CargasAlex AlvesAinda não há avaliações
- Manual de Instrumentaçao PB 1963-1Documento125 páginasManual de Instrumentaçao PB 1963-1Carlos AlvarezAinda não há avaliações
- Manutenção preventiva SurdialDocumento1 páginaManutenção preventiva SurdialYoung VanadioAinda não há avaliações
- Trigonometria básicaDocumento37 páginasTrigonometria básicaCalido CamaráAinda não há avaliações
- NR 11Documento29 páginasNR 11D'ArtagnanMoraesAinda não há avaliações
- Atividade Avaliativa Geometria MolecularDocumento1 páginaAtividade Avaliativa Geometria MolecularMarcela NascimentoAinda não há avaliações
- Lista 3 - Ondas - 13-08Documento12 páginasLista 3 - Ondas - 13-08felipegodrvAinda não há avaliações
- Filtros Stauff PDFDocumento127 páginasFiltros Stauff PDFEduardo Cramer100% (1)
- Desenho artístico - Luz e sombraDocumento18 páginasDesenho artístico - Luz e sombraBruno Martins100% (2)
- Ensaios físicos de comprimidosDocumento5 páginasEnsaios físicos de comprimidosNayara CarolineAinda não há avaliações
- Programador Horario 16A - Serie 12 PDFDocumento16 páginasProgramador Horario 16A - Serie 12 PDFmquaiottiAinda não há avaliações
- Análise de riscos e liberação para trabalhos perigososDocumento2 páginasAnálise de riscos e liberação para trabalhos perigosospoteitorAinda não há avaliações
- Cabo Opgw Desempenho Descarg AtmosfDocumento6 páginasCabo Opgw Desempenho Descarg AtmosfWilliam CruzAinda não há avaliações
- Descritivo Técnio Glroa 414 UfkDocumento1 páginaDescritivo Técnio Glroa 414 Ufkmaristela.rodcarAinda não há avaliações
- Apresentacao Aula 01Documento34 páginasApresentacao Aula 01Jeremias SilvaAinda não há avaliações
- Relatório - Experimento 4Documento4 páginasRelatório - Experimento 4Lucas CostaAinda não há avaliações
- Sistemas Estruturais - Unidade IDocumento46 páginasSistemas Estruturais - Unidade Ieder eduardoAinda não há avaliações
- 600.408 NeoEnergia-Manual DescritivoDocumento19 páginas600.408 NeoEnergia-Manual DescritivoNPL TEFAinda não há avaliações
- Bsi ConfiguraçãoDocumento6 páginasBsi Configuraçãojonathinhas20Ainda não há avaliações
- Investigando a Viscosidade da LavaDocumento5 páginasInvestigando a Viscosidade da LavaIsaura SilvaAinda não há avaliações
- Alternador carroDocumento5 páginasAlternador carroCezar MachadoAinda não há avaliações
- NR-31 - Apresentação Das Principais AlteraçõesDocumento22 páginasNR-31 - Apresentação Das Principais Alteraçõesvagner100% (1)
- Prova de 2016 TrabalhoDocumento16 páginasProva de 2016 TrabalhoJoão Victor De Lorenzzo MoreiraAinda não há avaliações
- 5 Capitulo - IV 6o Ano GABARITO2Documento14 páginas5 Capitulo - IV 6o Ano GABARITO2Gilmar Rodrigues100% (1)
- Lei de Ohm: fluxo de carga, tensão e resistênciaDocumento3 páginasLei de Ohm: fluxo de carga, tensão e resistênciaGabriel Kuhs da RosaAinda não há avaliações