Escolar Documentos
Profissional Documentos
Cultura Documentos
REVISADO F Sic
Enviado por
lukcasdias40Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
REVISADO F Sic
Enviado por
lukcasdias40Direitos autorais:
Formatos disponíveis
alfaconcursos.com.
br
SUMÁRIO
O ÁTOMO DE BOHR E O PRINCÍPIO DA INCERTEZA ....................................................................................... 2
O MODELO ATÔMICO DE BOHR ............................................................................................................... 2
INTRODUÇÃO ....................................................................................................................................... 2
ASPECTOS QUANTITATIVOS.................................................................................................................. 3
DUALIDADE ONDA-PARTÍCULA E O PRINCÍPIO DA INCERTEZA .................................................................11
A NATUREZA DUAL DA LUZ..................................................................................................................11
A HIPÓTESE DE DE BROGLIE ................................................................................................................12
O PRINCÍPIO DA INCERTEZA DE HEISENBERG .......................................................................................14
MUDE SUA VIDA!
1
alfaconcursos.com.br
O ÁTOMO DE BOHR E O PRINCÍPIO DA INCERTEZA
O MODELO ATÔMICO DE BOHR
INTRODUÇÃO
O verdadeiro objeto de estudo da física quântica é o mundo atômico e subatômico, isto é,
a física das partículas. Claro, esse mesmo estudo ramifica-se e intersecta diversos outros ramos
do saber humano, mas o foco é de fato o estudo das partículas a nível atômico.
A tentativa de modelar o átomo em um modelo físico terá início nos nossos estudos de
hoje com o modelo proposto pelo físico Ernest Rutherford. Rutherford propôs, em
consequência às suas experimentações como físico, que o átomo teria a seguinte configuração:
uma estrutura rígida central de carga positiva (que ele veio a chamar de núcleo) e uma “nuvem”
orbital ao redor desse núcleo composta por partículas de carga negativa. Veja abaixo essa
estrutura proposta:
É importante que tenhamos consciência de como Rutherford propôs o seu modelo
atômico, mas mais importante ainda para a gente é que tenhamos noção de como o seu modelo
peca em relação às experimentações da física moderna.
Em primeiro lugar, considere um elétron que se desloque em direção ao núcleo de um
átomo. De acordo com a teoria do eletromagnetismo de Maxwell, um elétron emite radiação de
frequência igual à do seu movimento. Ora, como o movimento até o núcleo acontece de modo
variado, a da radiação emitida por esse elétron também deveria sê-lo. Mas não é isso que os
experimentos nos mostram.
Os dados experimentais nos mostram (e veremos mais à frente o que de fato acontece)
que essa radiação (a radiação emitida por um átomo) assumirá apenas alguns valores
específicos de frequência (diferentemente de um corpo, que emite radiação contínua).
Bohr foi o responsável pelo modelo atômico que trazia consigo uma explicação condizente
com os experimentos, “consertando” o modelo de Rutherford.
MUDE SUA VIDA!
2
alfaconcursos.com.br
ASPECTOS QUANTITATIVOS
Segundo Bohr:
Para que a eletrosfera de um átomo se mantenha estável, os seus elétrons só
podem assumir alguns específicos valores para seus níveis de energia. Esses níveis
de energia são chamados de estados estacionários ou estados quânticos.
Isso significa que, nesse novo modelo, as eletrosferas possuem uma determinada ordem,
não são mais simples eletrosferas. Para cada uma delas, o elétron encontra-se em um
determinado estado estacionário. Associado a cada um dos possíveis estados estacionários de
um átomo está um número chamado número quântico principal (que será identificado por 𝑛).
Dessa forma, para cada estado estacionário existe um 𝑛. Quanto mais afastado do núcleo estiver
a órbita, maior será o valor do número quântico principal. Veja abaixo um exemplo dessa
disposição de forma geral:
Uma nomenclatura importante: quando o número quântico do estado estacionário for 1
(isto é, quando 𝑛 = 1), o estado estacionário será chamado de estado fundamental. Qualquer
outro estado (isto é, para qualquer 𝑛 ≠ 1) será chamado simplesmente de estado excitado.
Como foi dito, para cada uma das órbitas, haverá um valor estacionário para a energia do
elétron, isto é, para uma mesma órbita estará sempre associado apenas um valor de energia.
O átomo mais cobrado em concursos é o átomo de hidrogênio. Num nível orbital de nível
𝑛, a energia do elétron pode ser calculada pela expressão abaixo (que deve ser memorizada
pelo estudante):
13,6
𝐸𝑛 = −
𝑛2
Essa energia, quando calculada por essa fórmula, é encontrada na unidade eV (elétron-
volt).
MUDE SUA VIDA!
3
alfaconcursos.com.br
Há um último aspecto do modelo proposto por Bohr que precisamos discutir, que são os
saltos energéticos.
Segundo Bohr, e as experimentações nos dizem que a proposição é verdadeira, elétrons
podem saltar de um nível energético para outro. Quando um elétron absorve um fóton, ele salta
para um nível energético acima do que estava (mas não necessariamente o nível seguinte).
Porém, quando ele salta para um nível energético menor, ele emite um fóton (cuja energia é a
diferença entre os níveis de salto), como podemos ver na figura abaixo:
Nesse salto, por exemplo, a energia do fóton ser calculada como:
𝐸 =ℎ⋅𝑓
Mas também pode ser calculada como a diferença entre os níveis de salto:
𝐸 = 𝐸2 − 𝐸1
Daí, poderíamos até mesmo descobrir a frequência do fóton emitido:
𝐸2 − 𝐸1
ℎ ⋅ 𝑓 = 𝐸2 − 𝐸1 → 𝑓 =
ℎ
Em geral, lembre-se sempre do seguinte:
Quando um átomo recebe uma radiação eletromagnética, um elétron dele só
poderá absorver um fóton se a energia deste (lembre-se, calculável por ℎ ⋅ 𝑓) for
exatamente a quantidade de energia necessária para o elétron saltar de um nível
permitido para outro também permitido. Caso isso não aconteça, ele não absorve o
fóton.
Para entender melhor o que acabamos de falar, vamos fazer alguns exercícios de exemplo.
MUDE SUA VIDA!
4
alfaconcursos.com.br
1. O diagrama abaixo representa alguns níveis de energia do átomo de hidrogênio.
Átomos de hidrogênio, inicialmente no estado fundamental, começam a ser incididos
continuamente por radiações eletromagnéticas de diferentes energias 𝐸𝑖 :
𝐸1 = 2,3 𝑒𝑉,
𝐸2 = 1,9𝑒𝑉 e
𝐸3 = 10,2 𝑒𝑉.
Quais destas radiações serão absorvidas pelos átomos de H, sem causar ionização?
(a) apenas 𝐸2
(b) apenas 𝐸3
(c) apenas 𝐸2 𝑒 𝐸3
(d) Todas
Esse gráfico que podemos ver na questão é um tipo de gráfico muito comum (muito
mesmo) em questões que envolvam saltos energéticos no modelo atômico de Bohr. Antes de
resolvermos a questão, vamos dar uma olhada no que ele nos informa.
Cada um dos valores na região esquerda do gráfico representam as energias dos níveis
descritos na região direita do gráfico. Dessa forma, por exemplo, a energia de um elétron no
estado fundamental (𝑛 = 1) é 𝐸1 = −13,6 𝑒𝑉. Já a energia no primeiro estado excitado do elétron
(𝑛 = 2) é 𝐸2 = −3,4 𝑒𝑉 (muito cuidado para não confundir o primeiro estado excitado com 𝑛 = 1;
veja que para estar excitado, o elétron deve ter número quântico maior que 1, e dessa forma o
primeiro estado excitado corresponde a 𝑛 = 2).
Bom, agora que temos essa noção, vamos à questão. Temos três tipos de energias para
as radiações: 𝐸1 = 2,3 𝑒𝑉, 𝐸2 = 1,9𝑒𝑉 e 𝐸3 = 10,2 𝑒𝑉. Nos foram informados, no gráfico, 4 níveis
energéticos. Vejamos todos os possíveis saltos energéticos que um elétron poderia fazer no
átomo (1 → 2; 1 → 3; 1 → 4; 2→ 3; 2→ 4; 3→ 4):
MUDE SUA VIDA!
5
alfaconcursos.com.br
– Salto de 𝑛 = 1 para 𝑛 = 2: o ganho energético seria:
𝐸2 − 𝐸1 = −3,4 − (−13,6) = −3,4 + 13,6 = 10,2 𝑒𝑉
Veja que esse valor corresponde ao ganho energético provocado pela radiação de
energia 𝐸1. Dessa forma, 𝐸1 causaria ionização.
– Salto de 𝑛 = 1 para 𝑛 = 3: o ganho energético seria:
𝐸3 − 𝐸1 = −1,51 − (−13,6) = −1,51 + 13,6 = 12,09 𝑒𝑉
Veja que esse valor não corresponde a nenhuma das energias apresentadas.
– Salto de 𝑛 = 1 para 𝑛 = 4: o ganho energético seria:
𝐸4 − 𝐸1 = −0,85 − (−13,6) = −0,85 + 13,6 = 12,75 𝑒𝑉
Veja que esse valor não corresponde a nenhuma das energias apresentadas.
– Salto de 𝑛 = 2 para 𝑛 = 3: o ganho energético seria:
𝐸3 − 𝐸2 = −1,51 − (−3,4) = −1,51 + 3,4 = 1,89 𝑒𝑉
Veja que esse valor não corresponde a nenhuma das energias apresentadas.
– Salto de 𝑛 = 2 para 𝑛 = 4: o ganho energético seria:
𝐸4 − 𝐸2 = −0,85 − (−3,4) = −0,85 + 3,4 = 2,55 𝑒𝑉
Veja que esse valor não corresponde a nenhuma das energias apresentadas.
– Salto de 𝑛 = 3 para 𝑛 = 4: o ganho energético seria:
𝐸4 − 𝐸3 = −0,85 − (−1,51) = −0,85 + 1,51 = 0,66 𝑒𝑉
Veja que esse valor não corresponde a nenhuma das energias apresentadas.
Dessa forma, como nem 𝐸2 e nem 𝐸3 são capazes de fazer o elétron saltar para nenhum nível
superior, a alternativa correta é C.
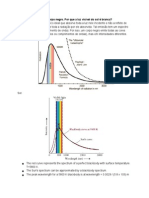
2. Ano: 2013 Banca: AFA Órgão: FAB
O elétron do átomo de hidrogênio, ao passar do primeiro estado estacionário excitado, n = 2, para
o estado fundamental, n = 1, emite um fóton. Tendo em vista o diagrama da figura abaixo, que
apresenta, de maneira aproximada, os comprimentos de onda das diversas radiações,
componentes do espectro eletromagnético, pode-se concluir que o comprimento de onda desse
fóton emitido corresponde a uma radiação na região do(s)
(a) raios gama
(b) raios X
(c) ultravioleta
MUDE SUA VIDA!
6
alfaconcursos.com.br
(d) infravermelho
Que excelente questão para assentarmos a nossa teoria. Vamos lá entendê-la.
Antes de tudo, veja que se trata novamente de um elétron de um átomo de hidrogênio
passando do primeiro estado estacionário excitado (𝑛 = 2) para o estado fundamental (𝑛 = 1). Já
vimos isso antes, certo? Vou até trazer a figura para cá:
Veja que, de fato, se trata exatamente da mesma situação que vimos antes. Precisaremos
calcular a energia do fóton liberado. Para isso, precisaremos das energias dos níveis de salto. O
elétron saltou de 𝑛 = 2 para 𝑛 = 1; dessa forma, precisaremos calcular 𝐸2 e 𝐸1.
Como estamos falando do átomo de hidrogênio, sabemos que:
13,6
𝐸𝑛 = − 2
𝑛
Dessa forma, temos:
13,6 13,6
𝐸2 = − 2 = − = −3,4 𝑒𝑉.
2 4
13,6 13,6
𝐸1 = − 2 = − = −13,6 𝑒𝑉.
1 1
Daí a energia do fóton emitido pelo elétron é:
𝐸 = −3,4 − (−13,6) = −3,4 + 13,6 = 10,2 𝑒𝑉.
Agora podemos utilizar a equação de Planck, com ℎ ≈ 4,1 ⋅ 10−15 𝑒𝑉 ⋅ 𝑠. Para fazermos
𝑐
aparecer o comprimento de onda, precisamos nos lembrar que 𝑐 = 𝜆𝑓, isto é, que 𝑓 = . Temos,
𝜆
então:
ℎ𝑐
𝐸 =ℎ⋅𝑓 =
𝜆
4,1 ⋅ 10−15 ⋅ 3 ⋅ 108
10,2 =
𝜆
4,1 ⋅ 10−15 ⋅ 3 ⋅ 108
𝜆= ≈ 1,2 ⋅ 10−7 𝑚
10,2
MUDE SUA VIDA!
7
alfaconcursos.com.br
Vemos então que, pelo comprimento de onda encontrado, observando o espectro
eletromagnético, essa é uma radiação ultravioleta.
3. Ano: 2015 Banca: AFA Órgão: FAB
O diagrama a seguir mostra os níveis de energia permitidos para elétrons de um certo elemento
químico.
Durante a emissão de radiação por este elemento, são observados três comprimentos de onda: 𝜆𝐴 ,
𝜆
𝜆𝐵 e 𝜆𝐶 . Sabendo-se que𝜆𝐴 < 𝜆𝐵 < 𝜆𝐶 , pode-se afirmar que 𝜆𝐴 é igual a:
𝐶
𝐸
(a) 𝐸3
1
𝐸3 −𝐸2
(b) 𝐸3
𝐸3 −𝐸2
(c) 𝐸
3 −𝐸1
𝐸2
(d) 𝐸
1
Para fazermos aparecer o comprimento de onda, precisamos novamente nos lembrar que
𝑐
𝑐 = 𝜆𝑓, isto é, que 𝑓 = . Temos, então:
𝜆
ℎ𝑐
𝐸 =ℎ⋅𝑓 =
𝜆
Dessa forma quanto menor o comprimento de onda, maior será a energia. Logo, 𝜆𝐴
(menor comprimento de onda) corresponde à maior energia possível de ser emitida por esse
elemento químico. A maior energia possível é emitida quando o átomo salta do nível 3 para o
nível 1; tal energia vale 𝐸𝑚á𝑥𝑖𝑚𝑎 = 𝐸3 − 𝐸1. Temos, então:
ℎ𝑐 ℎ𝑐
𝐸𝑚á𝑥𝑖𝑚𝑎 = → 𝜆𝐴 =
𝜆𝐴 𝐸3 − 𝐸1
Utilizando-se da mesma expressão podemos concluir também que quanto maior o
comprimento de onda, menor será a energia. Logo, 𝜆𝐶 (maior comprimento de onda)
corresponde à menor energia possível de ser emitida por esse elemento químico. A menor
energia possível é emitida quando o átomo salta do nível 2 para o nível 3 (pois o nível 2 está
energeticamente mais próximo do nível 3 que do nível 1); tal energia vale 𝐸𝑚í𝑛𝑖𝑚𝑎 = 𝐸3 − 𝐸2 .
Temos, então:
MUDE SUA VIDA!
8
alfaconcursos.com.br
ℎ𝑐 ℎ𝑐
𝐸𝑚í𝑛𝑖𝑚𝑎 = → 𝜆𝐶 =
𝜆𝐶 𝐸3 − 𝐸2
𝜆𝐴
O problema nos pede , logo:
𝜆𝐶
ℎ𝑐
𝜆𝐴 𝐸3 − 𝐸1 𝐸3 − 𝐸2
= = .
𝜆𝐶 ℎ𝑐 𝐸3 − 𝐸1
𝐸3 − 𝐸2
Dessa forma, a alternativa correta é C.
4. Ano: 2016 Banca: AFA Órgão: FAB
O diagrama abaixo ilustra os níveis de energia ocupados por elétrons de um elemento químico 𝐴.
Dentro das possibilidades apresentadas nas alternativas abaixo, a energia que poderia restar a
um elétron com energia de 12,0 eV, após colidir com um átomo de A, seria de, em eV,
(a) 0
(b) 1,0
(c) 5,0
(d) 5,4
Existem seis possíveis mudanças de estado: 1 → 2; 1 → 3; 1 → 4; 2→ 3; 2→ 4; 3→ 4.
Precisamos analisar a energia que sobra no elétron incidente após colidir com o elétron do átomo
de A. Vejamos:
– Salto de 𝑛 = 1 para 𝑛 = 2: o ganho energético seria:
𝐸2 − 𝐸1 = −14,4 − (−21,4) = −14,4 + 21,4 = 7,0 𝑒𝑉
Caso essa transição fosse provocada pelo elétron externo com 12,0 eV, restariam:
𝐸𝑟𝑒𝑠𝑡𝑎𝑛𝑡𝑒 = 12,0 − 7,0 = 5,0 𝑒𝑉, que é o gabarito. Farei as outras para completar!
– Salto de 𝑛 = 1 para 𝑛 = 3: o ganho energético seria:
𝐸3 − 𝐸1 = −8,4 − (−21,4) = −8,4 + 21,4 = 13 𝑒𝑉
Essa seria uma transição impossível de ser provocada pelo elétron externo, por ter
menos energia que a necessária.
– Salto de 𝑛 = 1 para 𝑛 = 4: o ganho energético seria:
𝐸4 − 𝐸1 = −4,0 − (−21,4) = −4,0 + 21,4 = 17,4 𝑒𝑉
Essa seria uma transição impossível de ser provocada pelo elétron externo, por ter
menos energia que a necessária.
MUDE SUA VIDA!
9
alfaconcursos.com.br
– Salto de 𝑛 = 2 para 𝑛 = 3: o ganho energético seria:
𝐸3 − 𝐸2 = −8,4 − (−14,4) = −8,4 + 14,4 = 6,0 𝑒𝑉
Caso essa transição fosse provocada pelo elétron externo com 12,0 eV, restariam:
𝐸𝑟𝑒𝑠𝑡𝑎𝑛𝑡𝑒 = 12,0 − 6,0 = 6,0 𝑒𝑉, que não se encontra em nenhuma das alternativas
– Salto de 𝑛 = 2 para 𝑛 = 4: o ganho energético seria:
𝐸4 − 𝐸2 = −4,0 − (−14,4) = −4,0 + 14,4 = 10,4 𝑒𝑉
Caso essa transição fosse provocada pelo elétron externo com 12,0 eV, restariam:
𝐸𝑟𝑒𝑠𝑡𝑎𝑛𝑡𝑒 = 12,0 − 10,4 = 1,6 𝑒𝑉, que não se encontra em nenhuma das alternativas
– Salto de 𝑛 = 3 para 𝑛 = 4: o ganho energético seria:
𝐸4 − 𝐸3 = −4,0 − (−8,4) = −4,0 + 8,4 = 4,4 𝑒𝑉
Caso essa transição fosse provocada pelo elétron externo com 12,0 eV, restariam:
𝐸𝑟𝑒𝑠𝑡𝑎𝑛𝑡𝑒 = 12,0 − 4,4 = 7,6 𝑒𝑉, que não se encontra em nenhuma das alternativas
Dessa forma, como nem 𝐸2 e nem 𝐸3 são capazes de fazer o elétron saltar para nenhum nível
superior, a alternativa correta é C.
5. Ano: 2017 Banca: AFA Órgão: FAB
A Figura 1 abaixo representa um arranjo experimental para a obtenção do espectro de emissão
da luz emitida por uma lâmpada de gás de hidrogênio.
Ao passar pelo prisma, a luz divide-se em quatro feixes de cores distintas: violeta, anil, azul e
vermelho. Projetando-se esses feixes em um anteparo, eles ficam espalhados, como ilustrado na
Figura 1. Considere, agora, a Figura 2, que ilustra esquematicamente alguns níveis de energia do
átomo de hidrogênio, onde as setas I, II, III e IV mostram transições possíveis para esse átomo.
MUDE SUA VIDA!
10
alfaconcursos.com.br
Relacionando as informações contidas na Figura 2 com as cores da luz emitida pela lâmpada de
gás de hidrogênio mostrada na Figura 1, é correto afirmar que a cor anil corresponde à transição
(a) I
(b) II
(c) III
(d) IV
As cores dispostas no anteparo estão, de cima para baixo, na ordem crescente das
frequências de suas respectivas radiações. Dessa forma, temos:
𝑓𝑣𝑒𝑟𝑚𝑒𝑙ℎ𝑜 < 𝑓𝑎𝑧𝑢𝑙 < 𝑓𝑎𝑛𝑖𝑙 < 𝑓𝑣𝑖𝑜𝑙𝑒𝑡𝑎
Veja então que anil é a segunda maior frequência. Visto que quanto maior for a frequência maior
será a energia, estamos procurando a segunda maior energia. Podemos ver pelo gráfico da
Figura 2 que a segunda maior energia é a energia II, que é o gabarito.
DUALIDADE ONDA-PARTÍCULA E O PRINCÍPIO DA INCERTEZA
A NATUREZA DUAL DA LUZ
Comentamos rapidamente sobre a dualidade da natureza luminosa em nossa primeira
aula de física quântica. A ideia aqui é que façamos mais alguns comentários pertinentes para
que não sejamos pegos de surpresa em nosso exame. Essa parte teórica é bastante importante.
Vamos lá, então!
Na última aula vimos que Planck e Einstein foram pioneiros na ideia dos quanta de
energia. Einstein em particular, como vimos, foi o responsável por estender o que foi teorizado
por Planck. Ele propôs que a luz também era constituída de porções energéticas (os fótons) e
que, com isso, assumia características corpusculares (isto é, características de partícula, de
corpo). Essa teoria foi a teoria necessária para que o efeito fotoelétrico fosse corretamente
explicado. Todos nos lembramos disso, certo?
Acontece que da mesma forma que é necessário considerar o comportamento corpuscular
da luz para explicar o efeito fotoelétrico, também é necessário considerarmos a natureza
ondulatória da luz para que possamos explicar fenômenos como a interferência e a difração.
Dessa forma, apesar de serem naturezas totalmente opostas, apresentam-se dualmente para a
natureza luminosa.
A essa simultaneidade exótica dá-se o nome de natureza dual da luz. Entende-se com essa
natureza que a luz é meio camaleônica em relação ao seu comportamento. Em certas
circunstâncias ela se comporta como partícula e noutras se comporta como onda.
MUDE SUA VIDA!
11
alfaconcursos.com.br
A HIPÓTESE DE DE BROGLIE
Assim como praticamente tudo na ciência, uma descoberta acaba acarretando outra(s).
Da mesma forma que houve consentimento dos cientistas modernos de que a luz se comporta
como partícula e como onda, houve o questionamento em se partículas em geral também não
poderiam ter alguma relação com o comportamento ondulatório.
A princípio é um pouco anti-intuitivo ficarmos pensando nisso. E de fato é, mas tudo será
explicado nos detalhes que são exigidos do seu exame. Então, sigamos!
Em particular, o físico Louis Victor De Broglie foi um dos que vieram a fazer exatamente
esse questionamento acerca do comportamento particular e ondulatório. Ele criou a hipótese
(que mais tarde ficou conhecida como a hipótese de De Broglie) de que uma partícula pode sim
assumir comportamentos ondulatórios e de que a teoria ondulatória estava de certo modo
conectada à teoria corpuscular.
Matematicamente o que ele fez foi o seguinte. Sabemos da teoria da relatividade que:
𝐸 = 𝑚 ⋅ 𝑐2
Dessa forma, vale que:
𝐸
𝑚=
𝑐2
Ele expressou a relação utilizando a quantidade de movimento de um corpo. Vale aqui
lembrarmos que:
𝑄 =𝑚⋅𝑣
𝐸
Mas como 𝑚 = 𝑐 2 , temos:
𝐸
𝑄= ⋅𝑣
𝑐2
Como 𝑣 = 𝑐, temos:
𝐸
𝑄= ⋅𝑐
𝑐2
E daí, conclui-se que:
𝐸
𝑄=
𝑐
Agora, devemos nos lembrar de que, pela equação de Planck, temos:
𝐸 =ℎ⋅𝑓
Dessa forma, podemos substituir na equação encontrada:
ℎ⋅𝑓
𝑄=
𝑐
MUDE SUA VIDA!
12
alfaconcursos.com.br
Pela natureza ondulatória da luz, temos que:
𝑐 =𝜆⋅𝑓
Substituindo mais uma vez na expressão encontrada, temos:
ℎ⋅𝑓
𝑄=
𝜆⋅𝑓
Que nos permite, finalmente, concluir que:
ℎ
𝑄=
𝜆
Com essa expressão hipotética, De Broglie consegue relacionar o comprimento de onda 𝜆
(grandeza característica da teoria ondulatória) e a quantidade de movimento 𝑄 (grandeza
característica da teoria corpuscular). Uma nomenclatura importante (e razoavelmente óbvia):
o comprimento de onda 𝜆 é chamado de comprimento de onda de De Broglie.
Essa equação foi proposta por De Broglie em 1924. Posteriormente a hipótese foi
verificada verdadeira, após a comprovação da difração de elétrons.
6. Existe uma carga 𝑞 que se move em um círculo de raio 𝑅 dentro de um campo magnético de
módulo 𝐵 ⃗ . Calcule o comprimento de onda de De Broglie para a carga.
𝐵
(a) ℎ𝑞𝑅
ℎ𝑅
(b) 𝐵𝑞
ℎ𝑞
(c) 𝐵𝑅
ℎ
(d) 𝑅𝑞𝐵
Pela equação que De Broglie obteve em sua hipótese, temos que:
ℎ
𝑄=
𝜆
Podemos então reorganizar essa expressão, visto que 𝑄 = 𝑚𝑣:
ℎ
𝑚𝑣 =
𝜆
Essa é a primeira parte. Para a segunda parte (que envolve eletromagnetismo), há duas
possibilidades. Ou você já sabe a fórmula para o raio 𝑅 da trajetória de uma partícula de carga
𝑞 e massa 𝑚 que se move com velocidade 𝑣:
𝑚𝑣
𝑅=
𝑞𝐵
MUDE SUA VIDA!
13
alfaconcursos.com.br
A outra possibilidade é claro, você não saber dessa expressão. Daí você pode chegar nela da
seguinte forma.
Sabemos que a força magnética agente sobre a partícula é dada por 𝐹𝑚 = 𝑞𝑣𝐵. Essa força age
como resultante centrípeta sobre a partícula (podemos verificar isso pela regra da mão direita,
a qual não detalharei aqui). Temos, então:
𝐹𝑐𝑝 = 𝑞𝑣𝐵
Abrindo a expressão da força centrípeta:
𝑚𝑣 2
= 𝑞𝑣𝐵
𝑅
Isolando 𝑅:
𝑚𝑣 2
𝑅=
𝑞𝑣𝐵
Cancelando 𝑣:
𝑚𝑣
𝑅=
𝑞𝐵
ℎ
Mas pela hipótese de De Broglie, temos que 𝑚𝑣 = , logo:
𝜆
ℎ
𝑅= 𝜆
𝑞𝐵
Reduzindo a fração:
ℎ
𝑅=
𝜆𝑞𝐵
Finalmente, trocando 𝜆 e 𝑅 de lugar:
ℎ
𝜆=
𝑅𝑞𝐵
O gabarito é a alternativa D.
O PRINCÍPIO DA INCERTEZA DE HEISENBERG
Imagine-se realizando determinado experimento relacionado a partículas subatômicas.
Em especial, imagine que em determinado instante desse experimento, você deseje localizar
determinado elétron. Você consegue imaginar um certo problema em fazer isso? Bom, vamos
falar um pouco sobre.
Em primeiro lugar, para que você consiga perceber o elétron, haverá algum mediador
tecnológico para que ele possa ser observado (um supermicroscópio, por exemplo). Mas para
MUDE SUA VIDA!
14
alfaconcursos.com.br
que esse elétron possa ser observado por esse supermicroscópio, a luz deverá sair do elétron
para que o mesmo possa ser finalmente localizado.
Acontece que se luz saiu do elétron é porque luz incidiu no elétron. E se houve incidência,
houve colisão (pois como vimos, fótons possuem quantidade de movimento). Se houve colisão,
houve alteração nos dados que buscávamos e, portanto, a informação que se obtém não é
precisa. Dessa forma, apenas poderão ser feitas ponderações, isto é, conjecturas acerca da
posição do elétron, ou de sua quantidade de movimento. Essa é a base do princípio da incerteza
de Heisenberg. Agora, vamos enunciá-lo.
Quanto maior a precisão na determinação da posição do elétron, menor é a
precisão na determinação de sua velocidade ou de sua quantidade de movimento e
vice-versa.
Veja como o nosso exemplo funciona para essa situação de modo ideal. Aumentar a
precisão na determinação da posição do elétron significa, aqui, aumentar a capacidade de
localizá-lo. Para isso, necessitaríamos de maior intensidade luminosa, e esse aumento provoca
a consequente diminuição das precisões, visto que as alterações serão maiores (porque maiores
serão as colisões, dentro do exemplo que mencionei).
Heisenberg conseguiu relacionar a incerteza Δ𝑥 na medida da posição 𝑥 da partícula com
a incerteza Δ𝑄 na medida da quantidade de movimento 𝑄 da partícula. Segundo Heisenberg:
ℎ
Δ𝑥 ⋅ Δ𝑄 ≥
4𝜋
Veja então que há um limite inferior para o produto das incertezas. E mais, como elas estão se
multiplicando, quando uma incerteza está muito pequena, a outra compensará a precisão da
outra com a imprecisão própria, a fim de manter a igualdade descrita por Heisenberg.
MUDE SUA VIDA!
15
Você também pode gostar
- 3º Ano - Física Quântica - A Física Do Muito PequenoDocumento11 páginas3º Ano - Física Quântica - A Física Do Muito PequenoJoão PerniasAinda não há avaliações
- F2.3 Ficha3 QuímicaDocumento2 páginasF2.3 Ficha3 QuímicaÂngela CarneiroAinda não há avaliações
- Física Quântica - 2021.3 - QS - Lista 3 - Tema: Espectros e Modelos Atômicos (De Dalton À Bohr) GabaritoDocumento7 páginasFísica Quântica - 2021.3 - QS - Lista 3 - Tema: Espectros e Modelos Atômicos (De Dalton À Bohr) GabaritoAndre Luiz CostaAinda não há avaliações
- Aplicações Da Eletricidade Na EngenhariaDocumento63 páginasAplicações Da Eletricidade Na EngenhariaEduardo SouzaAinda não há avaliações
- TEMA 01 - Aplicações Da Eletricidade Na Engenharia.Documento63 páginasTEMA 01 - Aplicações Da Eletricidade Na Engenharia.Rodrigo RochaAinda não há avaliações
- FQ RevisaoDocumento23 páginasFQ RevisaoVanessa SoaresAinda não há avaliações
- Química GeralDocumento103 páginasQuímica GeralalchemnautaAinda não há avaliações
- Volume 03Documento10 páginasVolume 03orivalmedeiros100% (2)
- Modelo Atómico de Bohr - Espetro de Emissão Do Átomo de Hidrogénio (2393)Documento2 páginasModelo Atómico de Bohr - Espetro de Emissão Do Átomo de Hidrogénio (2393)pauloAinda não há avaliações
- Material de Revisão 3º Colegial Física DudunegãoDocumento9 páginasMaterial de Revisão 3º Colegial Física DudunegãoLucas Rafaldini CoutoAinda não há avaliações
- Apontamentos - O Átomo de HidrogénioDocumento11 páginasApontamentos - O Átomo de HidrogénioAna Lopes100% (1)
- QUIMICADocumento11 páginasQUIMICAThiago TavaresAinda não há avaliações
- Mecanica QuanticaDocumento3 páginasMecanica QuanticaMarcelo AraujoAinda não há avaliações
- Apostila de Fisica 47 E28093 Fisica QuanticaDocumento4 páginasApostila de Fisica 47 E28093 Fisica Quanticawendelbatista25Ainda não há avaliações
- Modelo de Bohr - Átomo de HidrogénioDocumento5 páginasModelo de Bohr - Átomo de HidrogénioSusana FernandesAinda não há avaliações
- Atomo de Bohr - CompletoDocumento4 páginasAtomo de Bohr - Completoluciana da cruz barrosAinda não há avaliações
- Aula 2Documento26 páginasAula 2Sem futuro animeAinda não há avaliações
- Apostila de QuímicaDocumento63 páginasApostila de QuímicaOctavio MacedoAinda não há avaliações
- Física Quântica - BCK0103-15: Aula 6 - Princípio Da Incerteza e RevisãoDocumento24 páginasFísica Quântica - BCK0103-15: Aula 6 - Princípio Da Incerteza e RevisãoAndre Luiz CostaAinda não há avaliações
- Revisão Primeira AvaliaçãoDocumento6 páginasRevisão Primeira AvaliaçãosrfesjiunAinda não há avaliações
- Modelo de Bohr Átomo de Hidrogénio (1165)Documento2 páginasModelo de Bohr Átomo de Hidrogénio (1165)Francisco Marques100% (1)
- Estrutura Atômica e DistribuiçãoDocumento2 páginasEstrutura Atômica e Distribuiçãoluluzinha_rj100% (2)
- Teoria de Bohr para o Átomo de HidrogênioDocumento11 páginasTeoria de Bohr para o Átomo de Hidrogêniomickey_ze100% (1)
- 3 Prova Trabalho 2022Documento5 páginas3 Prova Trabalho 2022Michael TobiasAinda não há avaliações
- IAM Lista 01 Respostas PDFDocumento30 páginasIAM Lista 01 Respostas PDFgilliardAinda não há avaliações
- 5 - FF 4 EnergiaEletrõesÁtomosCORR 10ºD-AnexoDocumento4 páginas5 - FF 4 EnergiaEletrõesÁtomosCORR 10ºD-AnexoAna MarquesAinda não há avaliações
- Química Geral e TecnologicaDocumento42 páginasQuímica Geral e TecnologicaVitóriaLimaAinda não há avaliações
- ATOMÍSTICA Complemento 2014Documento11 páginasATOMÍSTICA Complemento 2014José Augusto Dos SantosAinda não há avaliações
- RelLabFisMod - Quantização Dos Estados de Energia Do Átomo de Mercúrio. (Experimento de Franck-Hertz)Documento19 páginasRelLabFisMod - Quantização Dos Estados de Energia Do Átomo de Mercúrio. (Experimento de Franck-Hertz)Rafael BratifichAinda não há avaliações
- Estrutura Eletrônica Dos ÁtomosDocumento45 páginasEstrutura Eletrônica Dos ÁtomosNatan SanglardAinda não há avaliações
- Relatório - Experimento de Franck - Hertz Com Tubo de HG - Passei DiretoDocumento11 páginasRelatório - Experimento de Franck - Hertz Com Tubo de HG - Passei DiretoCleiton CameloAinda não há avaliações
- Resumo de Química Geral IDocumento20 páginasResumo de Química Geral IAna Paula Do NascimentoAinda não há avaliações
- A Física Do Século XXDocumento30 páginasA Física Do Século XXtjmigoto@hotmail.comAinda não há avaliações
- Resumo1 - Elementos Químicos e A Sua OrganizaçãoDocumento5 páginasResumo1 - Elementos Químicos e A Sua OrganizaçãonmnicolauAinda não há avaliações
- Química 10Documento8 páginasQuímica 10MariassAinda não há avaliações
- Aula 03 - O Modelo Atômico Atual - Orbitais AtômicosDocumento50 páginasAula 03 - O Modelo Atômico Atual - Orbitais Atômicosmatheus mgaAinda não há avaliações
- Resumo2 - Elementos Químicos e A Sua OrganizaçãoDocumento10 páginasResumo2 - Elementos Químicos e A Sua OrganizaçãonmnicolauAinda não há avaliações
- Fisica Sec XXDocumento30 páginasFisica Sec XXLuiz Gabriel Brésio De LimaAinda não há avaliações
- Bohr AnotaçõesDocumento2 páginasBohr AnotaçõesDessah QueirozAinda não há avaliações
- Espetros e Modelo de Bohr - 10QDocumento4 páginasEspetros e Modelo de Bohr - 10QMargarida GranjaAinda não há avaliações
- Eletronica 10 3 2010Documento12 páginasEletronica 10 3 2010Fernando Ferreira PasseAinda não há avaliações
- Conceitos Fundamentais IQuímica FinalDocumento6 páginasConceitos Fundamentais IQuímica FinalMaria LobatoAinda não há avaliações
- Aula 1 Modelo AtomicoDocumento49 páginasAula 1 Modelo AtomicoLeonardo MacielAinda não há avaliações
- Propriedades Periodicas Teoria e ExerciciosDocumento3 páginasPropriedades Periodicas Teoria e ExerciciosAlexandro Lima GomesAinda não há avaliações
- Relatividade - Equivalência de MassaDocumento7 páginasRelatividade - Equivalência de Massazelda skywalkerAinda não há avaliações
- Física Quântica - ResumoDocumento8 páginasFísica Quântica - Resumoroger_meloAinda não há avaliações
- Física PPT - Século XXDocumento30 páginasFísica PPT - Século XXFísica PPT100% (2)
- Resumo 10Q1.2 - N.º 1Documento8 páginasResumo 10Q1.2 - N.º 1Francisco MendesAinda não há avaliações
- Estrutura Atômica PDFDocumento2 páginasEstrutura Atômica PDFcajungarcia50% (2)
- Modelo Atômico de Bohr e Diagrama de Linus PaulingDocumento11 páginasModelo Atômico de Bohr e Diagrama de Linus PaulingGabrielle Cristina MoreiraAinda não há avaliações
- 2 Ficha de Exercícios Q.B PDFDocumento6 páginas2 Ficha de Exercícios Q.B PDFEmmanue neloAinda não há avaliações
- Física - Relatividade - IDocumento15 páginasFísica - Relatividade - Ilukcasdias40Ainda não há avaliações
- Sumário: Mude Sua Vida!Documento13 páginasSumário: Mude Sua Vida!lukcasdias40Ainda não há avaliações
- Sumário: Mude Sua Vida!Documento12 páginasSumário: Mude Sua Vida!lukcasdias40Ainda não há avaliações
- Sumário: Mude Sua Vida!Documento19 páginasSumário: Mude Sua Vida!lukcasdias40Ainda não há avaliações
- Sumário: Mude Sua Vida!Documento7 páginasSumário: Mude Sua Vida!lukcasdias40Ainda não há avaliações
- Sumário: Mude Sua Vida!Documento19 páginasSumário: Mude Sua Vida!lukcasdias40Ainda não há avaliações
- UNR - Zona Sul - 752Documento33 páginasUNR - Zona Sul - 752Natã PerfeitoAinda não há avaliações
- LORENZETTI RAICIK DAMASIO - Divulgação Científica Pra Que e Pra QuemDocumento27 páginasLORENZETTI RAICIK DAMASIO - Divulgação Científica Pra Que e Pra QuemJoão Vitor VenceslauAinda não há avaliações
- Do Mito Ao Pensamento RacionalDocumento2 páginasDo Mito Ao Pensamento RacionalMichele MascarenhasAinda não há avaliações
- Principios Da Pesquisa CientificaDocumento22 páginasPrincipios Da Pesquisa Cientificarcbalbinati100% (2)
- Recensão Crítica - Pluralidade Na Teoria Das Elites - O Contributo de C. Wright Mills em AnáliseDocumento9 páginasRecensão Crítica - Pluralidade Na Teoria Das Elites - O Contributo de C. Wright Mills em AnáliseGonçalo Marques100% (1)
- Filosofia IIDocumento2 páginasFilosofia IIEduardo MarquesAinda não há avaliações
- Geografia Dos Transportes e Comunicacoes e TurismoDocumento5 páginasGeografia Dos Transportes e Comunicacoes e TurismoJorge José Dias SalihinaAinda não há avaliações
- Administração 1Documento30 páginasAdministração 1Soares Solimar SilvaAinda não há avaliações
- Profanando A Ciência - Relativizando Seus Saberes, Questionando Suas Verdades - Paula Corrêa HenningDocumento27 páginasProfanando A Ciência - Relativizando Seus Saberes, Questionando Suas Verdades - Paula Corrêa Henningelementocatalisador100% (1)
- Paper Estagio - Leticia PaulliDocumento11 páginasPaper Estagio - Leticia PaulliMichael Camurça100% (1)
- O Terrorista Lirico - Cristovao TezzaDocumento94 páginasO Terrorista Lirico - Cristovao TezzaRodrigo LuzAinda não há avaliações
- O Demonio de Golgota - Frank de FelittaDocumento342 páginasO Demonio de Golgota - Frank de FelittaAlexandre SantanaAinda não há avaliações
- Maikon Chaider Silva ScaldaferroDocumento148 páginasMaikon Chaider Silva ScaldaferroRafael VaillantAinda não há avaliações
- Para Compreender As Políticas Públicas: Uma Leitura IntrodutóriaDocumento6 páginasPara Compreender As Políticas Públicas: Uma Leitura IntrodutóriaCarlos Henrique BrazAinda não há avaliações
- O PENSAMENTO SISTÊMICO EM PSICOLOGIA Por Abilio MachadoDocumento4 páginasO PENSAMENTO SISTÊMICO EM PSICOLOGIA Por Abilio MachadoAbilio MachadoAinda não há avaliações
- O Uso Do Bom Humor e o Cuidado Na Saúde Autor Rayanne Rodrigues Luiz e Gladys Miyashiro MiyashiroDocumento33 páginasO Uso Do Bom Humor e o Cuidado Na Saúde Autor Rayanne Rodrigues Luiz e Gladys Miyashiro MiyashiroAntonio Ubaldo Ramalho JuniorAinda não há avaliações
- O Prazer Da Leitura Rubem AlvesDocumento24 páginasO Prazer Da Leitura Rubem Alvesjuliabelatriz100% (2)
- Entrevista Com Silvio Seno ChibeniDocumento12 páginasEntrevista Com Silvio Seno Chibeniedson1d.1gilAinda não há avaliações
- TCC II - CIÊNCIAS ECONÔMICAS 2021.2 - Aspectos Gerais Do Trabalho de Conclusão Do Curso (TCC)Documento1 páginaTCC II - CIÊNCIAS ECONÔMICAS 2021.2 - Aspectos Gerais Do Trabalho de Conclusão Do Curso (TCC)Alex NascimentoAinda não há avaliações
- Manual de Estágio Supervisionado Fsa 2018Documento22 páginasManual de Estágio Supervisionado Fsa 2018João Paulo MoraisAinda não há avaliações
- 12 22 PB PDFDocumento371 páginas12 22 PB PDFColombiologo CaquetensisAinda não há avaliações
- Questões para A Prova de SociologiaDocumento12 páginasQuestões para A Prova de SociologiaAndréSouzaAinda não há avaliações
- Silva, Felipe Stribe DaDocumento167 páginasSilva, Felipe Stribe Dakarla santosAinda não há avaliações
- ILC - Indicador de Letramento CientíficoDocumento44 páginasILC - Indicador de Letramento CientíficoMárcio RodriguesAinda não há avaliações
- C A L Ieb/Usp: - : Oleção Lberto Amego Recuperação Formação Digitalização E AcessoDocumento93 páginasC A L Ieb/Usp: - : Oleção Lberto Amego Recuperação Formação Digitalização E AcessoTheresaAinda não há avaliações
- História Da Literatura Brasileira - Luciana Stegagno-PicchioDocumento715 páginasHistória Da Literatura Brasileira - Luciana Stegagno-Picchiobarbara cavichioli100% (9)
- Aprendizagens Essenciais - Estudo Do Meio 2º Ano 1ºCEBDocumento10 páginasAprendizagens Essenciais - Estudo Do Meio 2º Ano 1ºCEBSónia Gomes VilelaAinda não há avaliações
- LSD - Minha Criança Problema - Albert HoffmanDocumento92 páginasLSD - Minha Criança Problema - Albert HoffmanPierre de Aguiar AzevedoAinda não há avaliações
- Livro Psicossociologia Análise Do Social e IntervençãoDocumento238 páginasLivro Psicossociologia Análise Do Social e IntervençãoAna GlauciaAinda não há avaliações
- A Atividade Económica e A Ciência Económica (Teste Com Correção) 2Documento3 páginasA Atividade Económica e A Ciência Económica (Teste Com Correção) 2Delmar SábioAinda não há avaliações