Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista 5 Fisico Quimica
Enviado por
marcondes oliveira0 notas0% acharam este documento útil (0 voto)
8 visualizações2 páginaslista de exercicios
Título original
lista 5 fisico quimica
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOC, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentolista de exercicios
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOC, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
8 visualizações2 páginasLista 5 Fisico Quimica
Enviado por
marcondes oliveiralista de exercicios
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOC, PDF, TXT ou leia online no Scribd
Você está na página 1de 2
LISTA DE EXERCÍCIOS
Cinética
1) Abaixo estão alguns dados coletados em uma série de experiências sobre a reação
do óxido nítrico com o bromo: 2NO(g) + Br2(g) 2NOBr(g) a 273ºC.
Experiência Concentração Inicial (mol/L) Velocidade Inicial (mol/L.s)
NO Br2
1 0.1 0.1 12
2 0.1 0.2 24
3 0.1 0.3 36
4 0.2 0.1 48
5 0.3 0.1 108
Determine a lei de velocidades para a reação e calcule o valor da constante de
velocidade.
V=K[NO]0,5[Br2]1
K= 379,47s-1
2) A 25ºC, o período de meia-vida para a decomposição do N 2O5 é de 5,7 h e é
independente da pressão inicial do N2O5. Calcular:
a) a constante específica de velocidade;
K=0,121h-1
b) o tempo necessário par a decomposição de 90% da substância.
t= 19,02 h
3) A decomposição catalizada de H2O2 em solução aquosa é uma reação de primeira
ordem , estudada mediante a titulação de H 2O2 não decomposta com uma solução
de KmnO4.
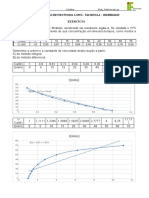
Construir um gráfico com os dados a seguir e calcular a constante específica de
velocidade:
Tempo (min) 0 5 10 20 30 50
Volume de KMnO4 (cm3) 46.1 37.1 29.8 19.6 12.3 5.0
K= 0,044 min-1 ou 7,33.10-4s-1
4) Na tabela a seguir estão relacionadas as constantes específicas de velocidade k
para a decomposição do N2O5 a várias temperaturas:
To C 0 25 35 45 55 65
K(s-1) 7,87.10-7 3,46.10-5 1,35.10-4 4,98.10-4 1,40.10-3 4,87.10-3
Determine graficamente a energia de ativação e a constante específica de velocidade, a
50ºC.
Ea= 102,5 KJ.mol-1
K50°C= 8,51.10-4s-1
5) A 300ºC, a constante de velocidade para a reação de transformação do ciclopropano
em propeno é 2,41.10-10 s-1. A 400ºC, k é igual a 1,16.10-6 s-1. Quais são os valores de Ea
( em KJ/mol) e de A, para esta reação?
Ea=284,2 KJ.mol-1
A= 1,93.1016
Você também pode gostar
- 5a Lista de Exercicios de Fisico Quimica11Documento5 páginas5a Lista de Exercicios de Fisico Quimica11Lisiane AliesAinda não há avaliações
- Exercícios de Cinética Química Com GabaritoDocumento10 páginasExercícios de Cinética Química Com Gabaritoguilhermegb100% (5)
- (20170920141627) Lista de Exercícios 1 - CinéticaDocumento4 páginas(20170920141627) Lista de Exercícios 1 - CinéticaJeferson ThomazAinda não há avaliações
- Lista de Exercicios Cinetica Quimica EQM061Documento13 páginasLista de Exercicios Cinetica Quimica EQM061Mariana DomicianoAinda não há avaliações
- 1listadeexerciciosdecinetica 2010Documento3 páginas1listadeexerciciosdecinetica 2010givaldo_antonio47050% (1)
- Lista de Exercícios CinéticaDocumento3 páginasLista de Exercícios CinéticaLucas Morais0% (1)
- Exercícios de Cinética QuímicaDocumento6 páginasExercícios de Cinética QuímicaVinicyus MartinsAinda não há avaliações
- Exercicios Cinetica - Parte 1Documento6 páginasExercicios Cinetica - Parte 1Rafael AldreemAinda não há avaliações
- LISTA DE EXERCCIOS Tpico 7 e 8Documento4 páginasLISTA DE EXERCCIOS Tpico 7 e 8a.mendesAinda não há avaliações
- ListacineticaDocumento2 páginasListacineticaSARAHAinda não há avaliações
- Lista de Cinética 1Documento3 páginasLista de Cinética 1Lucas CamargoAinda não há avaliações
- 7 Lista QGE2001 CineticaDocumento5 páginas7 Lista QGE2001 CineticaWashington RamosAinda não há avaliações
- Lista Cinética em SoluçãoDocumento1 páginaLista Cinética em SoluçãoJoão RicardoAinda não há avaliações
- Lista de Exercícios CQCRDocumento6 páginasLista de Exercícios CQCRGustavo TeixeiraAinda não há avaliações
- Lista Exercicios Cinetica PDFDocumento2 páginasLista Exercicios Cinetica PDFsheldonsingAinda não há avaliações
- Lista de ExercíciosDocumento3 páginasLista de ExercíciosSamira Aguiar PedrosaAinda não há avaliações
- Cinética QuímicaDocumento3 páginasCinética QuímicaParth PrinceAinda não há avaliações
- Lista de Exercícios 1 - CinéticaDocumento3 páginasLista de Exercícios 1 - CinéticaJamille SilvaAinda não há avaliações
- Complexos de Coordenação de Níquel - Inorgânica Exp. 3 PDFDocumento18 páginasComplexos de Coordenação de Níquel - Inorgânica Exp. 3 PDFJúlia Victória Diana Costa DiasAinda não há avaliações
- Ficha de Exercicios de Cinetica QuimicaDocumento8 páginasFicha de Exercicios de Cinetica QuimicaBenitoAinda não há avaliações
- Avaliação QuímicaDocumento3 páginasAvaliação QuímicaMatheus Paes LemeAinda não há avaliações
- 3 Lista de Exercicios - Cinética Química e Equilíbrio Químico (Gabarito)Documento3 páginas3 Lista de Exercicios - Cinética Química e Equilíbrio Químico (Gabarito)Dvmr AnapAinda não há avaliações
- Folha 2 de Cinética Química-IME-ITADocumento3 páginasFolha 2 de Cinética Química-IME-ITAHelton MoreiraAinda não há avaliações
- Lista 05Documento4 páginasLista 05Nicole PacíficoAinda não há avaliações
- LISTA 3 - CINÉTICA-completaDocumento7 páginasLISTA 3 - CINÉTICA-completaRodrigo BertaciniAinda não há avaliações
- 3a Lista de Exercicios - CineticaDocumento3 páginas3a Lista de Exercicios - CineticaTércia AragãoAinda não há avaliações
- Lista de Exercicios 1Documento4 páginasLista de Exercicios 1Mariana MartinsAinda não há avaliações
- Lista Exercicios P2Documento7 páginasLista Exercicios P2liviadiasrjAinda não há avaliações
- Lista de Exercício CINETICA (Corrigida)Documento4 páginasLista de Exercício CINETICA (Corrigida)Lael EduardoAinda não há avaliações
- Ficha Cinetica LEF LEBM 2022 23Documento3 páginasFicha Cinetica LEF LEBM 2022 23Gabriel PereiraAinda não há avaliações
- CQ091 ListaExercicios L3 L4 L5Documento3 páginasCQ091 ListaExercicios L3 L4 L5Leo CrozAinda não há avaliações
- Lista QuímicaDocumento2 páginasLista QuímicaPedro MarizAinda não há avaliações
- Química 2 Ano - Iii Unid - Cinética QuímicaDocumento41 páginasQuímica 2 Ano - Iii Unid - Cinética QuímicaJuca GordoAinda não há avaliações
- Unidade Curricular:: Modelagem e Simulação Do Mundo Físico Químico Profa. DanielaDocumento21 páginasUnidade Curricular:: Modelagem e Simulação Do Mundo Físico Químico Profa. DanielaJúlio VianaAinda não há avaliações
- Lista Da P2Documento4 páginasLista Da P2Felipe Viana Rios RossiAinda não há avaliações
- Cinética .PPTX 0b38f14e5e474e08828c9b - PFLMKDRDocumento40 páginasCinética .PPTX 0b38f14e5e474e08828c9b - PFLMKDRGilvanilza OLIVEIRAAinda não há avaliações
- Lista Exercícios CinéticaB - 23Documento8 páginasLista Exercícios CinéticaB - 23isamatias01Ainda não há avaliações
- Cinética Química - Exercicios 08-10-2022Documento8 páginasCinética Química - Exercicios 08-10-2022FELIPE SILVAAinda não há avaliações
- 1 AlistacinetDocumento2 páginas1 AlistacinetTito Weber CarnavalliAinda não há avaliações
- Lista Área II Química FundamentalDocumento20 páginasLista Área II Química FundamentalGuillaume HaddadAinda não há avaliações
- Teste 2 de Quimica 12 ClasseDocumento3 páginasTeste 2 de Quimica 12 ClasseJaime Ernesto NaeneAinda não há avaliações
- 3L.E. - Eng - Cinética QuímicaDocumento4 páginas3L.E. - Eng - Cinética QuímicaguilhermegbAinda não há avaliações
- Exercícios Revisão CinéticaDocumento20 páginasExercícios Revisão CinéticaIara DaherAinda não há avaliações
- Física e Química A: Ficha de Trabalho 3QDocumento3 páginasFísica e Química A: Ficha de Trabalho 3QTomás FerreiraAinda não há avaliações
- Lista de Exercícios - Cinética QuímicaDocumento2 páginasLista de Exercícios - Cinética QuímicaJoão Valdir Miranda100% (2)
- Livro D QuímicaDocumento11 páginasLivro D QuímicaKaua Moraes vieiraAinda não há avaliações
- L2 Qui117 2015-1Documento4 páginasL2 Qui117 2015-1Emanuel RodriguesAinda não há avaliações
- Lista de Exercícios Cinética Química - Exercícios SlidesDocumento6 páginasLista de Exercícios Cinética Química - Exercícios SlidesElmer TercioAinda não há avaliações
- Exercício Cinética QuímicaDocumento6 páginasExercício Cinética QuímicaLucas BentesAinda não há avaliações
- FFQ - Lista 2 - Leis Da TermodinamicaDocumento6 páginasFFQ - Lista 2 - Leis Da TermodinamicaVitor AmaranteAinda não há avaliações
- Exercicios Reações Químicas Cinética Parte 1Documento5 páginasExercicios Reações Químicas Cinética Parte 1Daniel ArrudaAinda não há avaliações
- Cinética SeminárioDocumento14 páginasCinética SeminárioMatheus FerreiraAinda não há avaliações
- Exercícios - Cinética Química IIIDocumento6 páginasExercícios - Cinética Química IIIRamonquimicoAinda não há avaliações
- Lista II - CINÉTICA QUÍMICA.Documento16 páginasLista II - CINÉTICA QUÍMICA.Vanessa MarcelliAinda não há avaliações
- LISTA 06-Cinética QuímicaDocumento4 páginasLISTA 06-Cinética QuímicaBreno RochaAinda não há avaliações
- Ficha 1. Parte2 Cinetica Qumica 2Documento2 páginasFicha 1. Parte2 Cinetica Qumica 2Clarice Natália GalvãoAinda não há avaliações
- Lista de ExercíciosDocumento6 páginasLista de ExercíciosMikele ViannaAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Eletroquímica 1Documento23 páginasEletroquímica 1marcondes oliveiraAinda não há avaliações
- Lista de Termoquímica 2024Documento5 páginasLista de Termoquímica 2024marcondes oliveiraAinda não há avaliações
- Lista de Rendimentos 2024Documento1 páginaLista de Rendimentos 2024marcondes oliveiraAinda não há avaliações
- Lista Do Primeiro Princípio 2024Documento1 páginaLista Do Primeiro Princípio 2024marcondes oliveiraAinda não há avaliações
- Lista 3 - QO1 - Ácidos e Bases - ReatividadeDocumento2 páginasLista 3 - QO1 - Ácidos e Bases - Reatividademarcondes oliveiraAinda não há avaliações
- Lista 2 - QO1 - Grupos Funcionais e Forças Intermoleculares Estrutura e LigaçõesDocumento2 páginasLista 2 - QO1 - Grupos Funcionais e Forças Intermoleculares Estrutura e Ligaçõesmarcondes oliveiraAinda não há avaliações
- Lista de Exercícios 1 - QO1 - Estrutura e LigaçõesDocumento2 páginasLista de Exercícios 1 - QO1 - Estrutura e Ligaçõesmarcondes oliveiraAinda não há avaliações