Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista de Exercícios
Enviado por
Samira Aguiar PedrosaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Lista de Exercícios
Enviado por
Samira Aguiar PedrosaDireitos autorais:
Formatos disponíveis
UNIVERSIDADE FEDERAL DO MARANHÃO
DEPARTAMENO DE QUÍMICA
DISCIPLINA: FÍSICO-QUÍMICA III
Lista de Exercícios sobre Cinética Química
1) Esboce um gráfico mostrando como pode variar a concentração de um reagente com o
tempo. Recorrendo ao seu gráfico, explique a diferença entre as velocidades média e
instantânea.
2) Escreva uma expressão que simbolize cada uma das seguintes velocidades instantâneas: (a)
velocidade de consumo de H2; (b) velocidade de formação de ClO-.
3) Se -d[N2]/dt, para a reação em fase gasosa N2 + 3H2 2NH3, é 2,60 x 10-3 molL-1s-1, quanto
vale -d[H2]/dt? (7,8 x 10-3 molL-1s-1)
4) Quanto vale d[NH3]/dt para a reação do exercício 3?
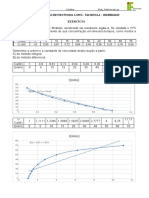
5) A velocidade de decréscimo de [A] numa reação foi medida com os dados abaixo:
tempo (min) 0,0 20,0 40,0 60,0 80,0 100,0
[A] (mol/L) 1,00 0,819 0,670 0,549 0,449 0,368
Calcular a velocidade média da reação (-d[A]/dt) entre: (a) 40,0 e 60,0 min; (b) 20,0 e 80,0
min; (c) 0,00 e 100,0 min. (6,05 X 10-3 molL-1min-1, 6,17 x 10-3 molL-1min-1, 6,32 x 10-3 molL-
1min-1)
6) A partir dos dados do problema anterior, calcule a velocidade instantânea da reação - d[A]/dt
a: (a) 50,0 min; (b) 0,0 min.
7) Em que condições as velocidades médias e as velocidades instantâneas são essencialmente
iguais?
8) Para a reação 2A + B C + 3D foram obtidas as seguintes velocidades iniciais:
[A] inicial (mol/L) [B] inicial (mol/L) - d[A]/dt inicial (molL-1s-1)
0,127 0,346 1,64 10-6
0,254 0,346 3,28 10-6
0,254 0,692 1,31 10-5
(a) Escreva a equação de velocidade para a reação;
(b) Calcule o valor da constante de velocidade;
(c) Calcule a velocidade de consumo de A quando [A] = 0,100 mol/L e [B] = 0,200 mol/L;
(d) Calcule a velocidade de formação de D sob as condições de (c).
(b-1,08 x 10-4 mol-2L2s-1, c - 4,32 x 10-2 molL-1s-1, d - 6,48 x 10-7 molL-1s-1)
9) Escreva a equação de velocidade e calcule a constante para a reação A + B C usando os
dados abaixo: (k3 = 5,25 x 10-5 mol-2 L2s-1)
[A] inicial (mol/L) [B] inicial (mol/L) - d[A]/dt inicial (molL-1s-1)
0,395 0,284 1,67 x 10-5
0,482 0,284 2,04 x 10-5
0,482 0,482 5,88 x 10-5
10) Os dados abaixo foram obtidos a 320 °C para a reação SO2Cl2 SO2 + Cl2:
tempo (h) 0,0 1,0 2,0 3,0 4,0
[SO2Cl2] (mol/L) 1,200 1,109 1,024 0,946 0,874
Determine, mediante um gráfico, a ordem e a constante de velocidade a 320 °C. (7,83 x 10-5
h-1)
11) Qual é a meia vida de uma reação de primeira ordem para a qual k =1,4 x 10-2min-1? (49,5
min)
12) A meia vida de uma reação de primeira ordem é independente da sua concentração inicial.
Como dependerá a meia-vida de uma reação de segunda ordem do tipo 2A produtos da
concentração inicial. E no caso de uma reação de ordem zero?
13) Escreva a equação de velocidade para os seguintes processos elementares:
(a) X + Y produtos; (b) 2X produtos; (c) 2X + Y produtos
14) Para a reação A(g) + 2B(g) produto foram obtidos os seguintes dados cinéticos:
Exp. [A]0 (mol/L) [B]0 (mol/L) Vinicial (molL-1s-1)
1 0,60 0,30 12,6
2 0,20 0,30 1,4
3 0,60 0,10 4,2
4 0,17 0,25 ?
a. Qual a ordem em relação a cada um dos reagentes e a ordem global da reação?
b. Determine a lei de velocidade para esta reação.
c. A partir dos dados, determine a constante de velocidade da reação.
d. Utilize os dados para prever a velocidade da reação para o experimento 4.
15) Os seguintes dados cinéticos foram obtidos para a reação 2IClg) + H2(g) + I2(g) + 2HCl(g):
Exp. [IC ]0 (mol/L) [H2]0 (mol/L) Vinicial (molL-1s-1)
1 1,5 1,5 3,7 × 10-7
2 3,0 1,5 7,4 × 10-7
3 3,0 4,5 22 × 10-7
4 4,7 2,7 ?
a. Determine a lei de velocidade para esta reação.
b. A partir dos dados, determine a constante de velocidade da reação.
c. Utilize os dados para prever a velocidade da reação para o experimento 4.
16) Os seguintes dados cinéticos foram obtidos para a reação A + B + C produtos:
Exp. [A]0 [B]0 [C]0 Vinicial
(mol/L) (mol/L) (mol/L) (molL-1s-1)
1 1,25 1,25 1,25 8,7
2 2,50 1,25 1,25 17,4
3 1,25 3,02 1,25 50,8
4 1,25 3,02 3,75 457
5 3,01 1,00 1,15 ?
a. Determine a lei de velocidade para esta reação.
b. Qual a ordem da reação?
c. Determine o valor da constante de velocidade da reação.
d. Utilize os dados para prever a velocidade da reação para o experimento 5.
Você também pode gostar
- Lista de Exercicios Cinetica Quimica EQM061Documento13 páginasLista de Exercicios Cinetica Quimica EQM061Mariana DomicianoAinda não há avaliações
- Apostila Trabalho A QuenteDocumento33 páginasApostila Trabalho A QuenteClinaldo GuedesAinda não há avaliações
- Avaliações Quimica Analitica QualitativaDocumento18 páginasAvaliações Quimica Analitica QualitativaEAD - Apoio Curso de Química100% (1)
- Manual de Instalacao Do CompressorDocumento5 páginasManual de Instalacao Do CompressorEdson JoséAinda não há avaliações
- O Clima Urbano e o Sistema Clima Urbano (S.C.UDocumento19 páginasO Clima Urbano e o Sistema Clima Urbano (S.C.UPaulo Weslley RamalhoAinda não há avaliações
- Lubrificação Industrial: tudo sobre lubrificantes, métodos e ferramentasDocumento18 páginasLubrificação Industrial: tudo sobre lubrificantes, métodos e ferramentasildoAinda não há avaliações
- Apostila 2 INT-TEC-TEX CompletaDocumento73 páginasApostila 2 INT-TEC-TEX CompletaJulianaAinda não há avaliações
- Exercícios de Cinética Química Com GabaritoDocumento10 páginasExercícios de Cinética Química Com Gabaritoguilhermegb100% (5)
- Aula sobre equipamentos topográficosDocumento137 páginasAula sobre equipamentos topográficosMarcela Yada100% (1)
- Rising Damp in Old Masonry WallsDocumento124 páginasRising Damp in Old Masonry WallsVinicius Langer GreterAinda não há avaliações
- N 06Documento8 páginasN 06vinimoraispauloAinda não há avaliações
- Trabalhos Sob Ar ComprimidoDocumento59 páginasTrabalhos Sob Ar ComprimidoRafael Oshima100% (2)
- Lista de exercícios cinéticaDocumento4 páginasLista de exercícios cinéticaJeferson ThomazAinda não há avaliações
- Lista de Distribuição de PoissonDocumento3 páginasLista de Distribuição de PoissonLeonardo BraulinoAinda não há avaliações
- ListacineticaDocumento2 páginasListacineticaSARAHAinda não há avaliações
- Lista Área II Química FundamentalDocumento20 páginasLista Área II Química FundamentalGuillaume HaddadAinda não há avaliações
- Cinética Química - ExercíciosDocumento6 páginasCinética Química - ExercíciosRafael AldreemAinda não há avaliações
- Aula09ExercciosdeCinticadaReao_20240416145414Documento21 páginasAula09ExercciosdeCinticadaReao_20240416145414Júlio VianaAinda não há avaliações
- 7 Lista QGE2001 CineticaDocumento5 páginas7 Lista QGE2001 CineticaWashington RamosAinda não há avaliações
- LISTADocumento5 páginasLISTAAcássio PaivaAinda não há avaliações
- 3a Lista de Exercicios - CineticaDocumento3 páginas3a Lista de Exercicios - CineticaTércia AragãoAinda não há avaliações
- Cinética Química - Lista de ExercíciosDocumento4 páginasCinética Química - Lista de ExercíciosLael EduardoAinda não há avaliações
- Lista Exercícios CinéticaB - 23Documento8 páginasLista Exercícios CinéticaB - 23isamatias01Ainda não há avaliações
- Físico-Química II - Lista de Exercícios Cinética QuímicaDocumento3 páginasFísico-Química II - Lista de Exercícios Cinética QuímicaLucas CamargoAinda não há avaliações
- Folha 2 de Cinética Química-IME-ITADocumento3 páginasFolha 2 de Cinética Química-IME-ITAHelton MoreiraAinda não há avaliações
- Química Cinética Reações Ordens VelocidadesDocumento51 páginasQuímica Cinética Reações Ordens VelocidadesCarlos Henrique0% (1)
- Determinação da ordem e constante de velocidade de reações químicasDocumento7 páginasDeterminação da ordem e constante de velocidade de reações químicasRodrigo BertaciniAinda não há avaliações
- Cinética Química: exercícios sobre leis de velocidade e fatores que influenciam reaçõesDocumento10 páginasCinética Química: exercícios sobre leis de velocidade e fatores que influenciam reaçõesFabiane De Oliveira Cantão FonsecaAinda não há avaliações
- Exercícios de Físico-químicaDocumento5 páginasExercícios de Físico-químicaLisiane AliesAinda não há avaliações
- Cinética Química-ExercíciosDocumento3 páginasCinética Química-ExercíciosBeatriz FerreiraAinda não há avaliações
- Cinética Química Lista 1Documento3 páginasCinética Química Lista 1Maria TargaryenAinda não há avaliações
- LISTA_DE_EXERCCIOS_Tpico_7_e_8Documento4 páginasLISTA_DE_EXERCCIOS_Tpico_7_e_8a.mendesAinda não há avaliações
- Atividade Cinética Química FEITADocumento2 páginasAtividade Cinética Química FEITAnathaliafanaia19Ainda não há avaliações
- Reações Químicas e EletroquímicaDocumento3 páginasReações Químicas e EletroquímicaLeo CrozAinda não há avaliações
- Lista 05Documento4 páginasLista 05Nicole PacíficoAinda não há avaliações
- Aula 14 - Revisão e Lista de ExercíciosDocumento4 páginasAula 14 - Revisão e Lista de ExercíciosLílian Barreto GonçalvesAinda não há avaliações
- Reações Químicas UFMADocumento5 páginasReações Químicas UFMADaniel ArrudaAinda não há avaliações
- Introdução à Química ExperimentalDocumento2 páginasIntrodução à Química ExperimentalmamaemtolokoAinda não há avaliações
- Lista de Exercícios de Química Geral com Reações de VelocidadeDocumento2 páginasLista de Exercícios de Química Geral com Reações de VelocidadePedro MarizAinda não há avaliações
- MECÂNICA QUÍMICA E CINÉTICA REACIONALDocumento4 páginasMECÂNICA QUÍMICA E CINÉTICA REACIONALguilhermegbAinda não há avaliações
- Lista II - CINÉTICA QUÍMICA.Documento16 páginasLista II - CINÉTICA QUÍMICA.Vanessa MarcelliAinda não há avaliações
- Físico-Química III – Cinética QuímicaDocumento2 páginasFísico-Química III – Cinética QuímicaodnumiarAinda não há avaliações
- Cinética Química ExercíciosDocumento23 páginasCinética Química ExercíciosmatBarreto e transferidor o nome do objeto.Ainda não há avaliações
- Lista Cinética 6 - Método DiferencialDocumento3 páginasLista Cinética 6 - Método DiferencialFabio ReisAinda não há avaliações
- Ficha V - Cinetica QuimicaDocumento3 páginasFicha V - Cinetica QuimicaAngelique ViannyAinda não há avaliações
- Lista 6 - Cinetica Quimica - Quimica 2 PDFDocumento15 páginasLista 6 - Cinetica Quimica - Quimica 2 PDFArthur GarciaAinda não há avaliações
- Cinética Química - Velocidades de ReaçãoDocumento3 páginasCinética Química - Velocidades de Reaçãogivaldo_antonio47050% (1)
- Cinética química: Teoria das colisões e lei cinéticaDocumento6 páginasCinética química: Teoria das colisões e lei cinéticaAnica GabrielliAinda não há avaliações
- Lista de Exercicios 1Documento4 páginasLista de Exercicios 1Mariana MartinsAinda não há avaliações
- Eng. Químico - Casa Da MoedaDocumento5 páginasEng. Químico - Casa Da MoedaprincipiaAinda não há avaliações
- CINÉTICA - Lista de ExeríciosDocumento3 páginasCINÉTICA - Lista de ExeríciosrobsonAinda não há avaliações
- Ficha Cinetica LEF LEBM 2022 23Documento3 páginasFicha Cinetica LEF LEBM 2022 23Gabriel PereiraAinda não há avaliações
- Exercícios Revisão CinéticaDocumento20 páginasExercícios Revisão CinéticaIara DaherAinda não há avaliações
- Lista de Exerccios Cintica - 32 Horas - SDocumento3 páginasLista de Exerccios Cintica - 32 Horas - SJoyce OliverAinda não há avaliações
- Prova de cinetica 2 - Francisco MarceloDocumento5 páginasProva de cinetica 2 - Francisco MarceloMarcelo SilvaAinda não há avaliações
- Cinética Química: exercícios resolvidos de reações de primeira e segunda ordemDocumento3 páginasCinética Química: exercícios resolvidos de reações de primeira e segunda ordemRafael MusicasAinda não há avaliações
- LISTA 06-Cinética QuímicaDocumento4 páginasLISTA 06-Cinética QuímicaBreno RochaAinda não há avaliações
- Lista de Exercícios CQCRDocumento6 páginasLista de Exercícios CQCRGustavo TeixeiraAinda não há avaliações
- 2021.2 Cinetica Quimica 1a Lista de ExerciciosDocumento2 páginas2021.2 Cinetica Quimica 1a Lista de ExerciciosDanielle SylvaAinda não há avaliações
- Cinética Química - Exercícios-07-07-2020Documento9 páginasCinética Química - Exercícios-07-07-2020Amanda SoteroAinda não há avaliações
- Cinética químicaDocumento6 páginasCinética químicaRanked PlayerAinda não há avaliações
- Lista de Exercícios de Química Geral sobre Reações Químicas e Células EletroquímicasDocumento2 páginasLista de Exercícios de Química Geral sobre Reações Químicas e Células EletroquímicasMarco AurelioAinda não há avaliações
- LISTA 05-Cinética QuímicaDocumento4 páginasLISTA 05-Cinética QuímicaMarcsAinda não há avaliações
- Cin QuiDocumento29 páginasCin QuiGuiAinda não há avaliações
- Exercícios - Cinética QuímicaDocumento4 páginasExercícios - Cinética QuímicaIara DaherAinda não há avaliações
- Cinética Química: Leis de Velocidade e ConstanteDocumento1 páginaCinética Química: Leis de Velocidade e ConstanteAna CarolinaAinda não há avaliações
- Cinética Química UFCEDocumento3 páginasCinética Química UFCEPaulo GonçalvesAinda não há avaliações
- Reações Químicas: Velocidade e FatoresDocumento30 páginasReações Químicas: Velocidade e FatoresromezioAinda não há avaliações
- Exercício Cinética QuímicaDocumento6 páginasExercício Cinética QuímicaLucas BentesAinda não há avaliações
- Massa MolarDocumento10 páginasMassa MolarsegecsAinda não há avaliações
- Potencial Eletroquímico (NA-003) - Apostila Multiend Rev2.pdf - 22.08Documento45 páginasPotencial Eletroquímico (NA-003) - Apostila Multiend Rev2.pdf - 22.08Douglas CoelhoAinda não há avaliações
- Dilatação linear de materiaisDocumento1 páginaDilatação linear de materiaisMÁRIO LIMAAinda não há avaliações
- Antibiótico SN-720-VDocumento10 páginasAntibiótico SN-720-VFlavio Jorge Miranda PimentelAinda não há avaliações
- 2 - Atividade de H+ em Soluções ÁcidasDocumento4 páginas2 - Atividade de H+ em Soluções ÁcidasIzaias Campos da Paixão0% (1)
- 2010ME TobiasACPereiraDocumento283 páginas2010ME TobiasACPereiraLuis Claudio MachadoAinda não há avaliações
- Determinação do teor de Mg(OH)2 em leite de magnésia por retrotitulaçãoDocumento12 páginasDeterminação do teor de Mg(OH)2 em leite de magnésia por retrotitulaçãoRebeca CardosoAinda não há avaliações
- Texto de Apoio Q12Documento42 páginasTexto de Apoio Q12Neopreno Aramida KevlarAinda não há avaliações
- Relatório Da Prática de Reações Químicas CertoDocumento5 páginasRelatório Da Prática de Reações Químicas CertoMaria Clara Ribeiro Tarabal0% (1)
- Proteínas, enzimas e suas funçõesDocumento2 páginasProteínas, enzimas e suas funçõesJoao Victor Henn100% (1)
- Capitulo 4 Conveccao Natural 12Documento13 páginasCapitulo 4 Conveccao Natural 12Francisco CossaAinda não há avaliações
- Técnicas de Amostras MicrobiológicasDocumento54 páginasTécnicas de Amostras MicrobiológicasAlexandre CasarolliAinda não há avaliações
- Lista de exercícios Mecânica dos Fluidos Aplicada avaliaçãoDocumento5 páginasLista de exercícios Mecânica dos Fluidos Aplicada avaliaçãoLarissa DinizAinda não há avaliações
- Exercicios de FreiosDocumento8 páginasExercicios de FreiosCaio Felipe100% (1)
- JET GROUTING COLUNASDocumento9 páginasJET GROUTING COLUNASEvandro Santiago100% (1)
- Ementas Eng AgrDocumento173 páginasEmentas Eng Agrapi-27495974100% (1)
- Organelas PDFDocumento6 páginasOrganelas PDFmarieAinda não há avaliações
- Pasta Fosqueante para Vidros - Jateamento - MattglassDocumento2 páginasPasta Fosqueante para Vidros - Jateamento - MattglassdjcirAinda não há avaliações
- MPF pede reparação ambiental e socioeconômica após rompimento de barragemDocumento359 páginasMPF pede reparação ambiental e socioeconômica após rompimento de barragemAnselmo CarvalhoAinda não há avaliações