Escolar Documentos
Profissional Documentos
Cultura Documentos
Subproduto 2 - Cinetica Enzimatica
Enviado por
Deborah Rocha0 notas0% acharam este documento útil (0 voto)
8 visualizações1 páginasubproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)
Título original
subproduto 2 - Cinetica enzimatica (1)
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentosubproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
8 visualizações1 páginaSubproduto 2 - Cinetica Enzimatica
Enviado por
Deborah Rochasubproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)subproduto 2 - Cinetica enzimatica (1)
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 1
Biologia estrutural e metabolismo
Valor: 5 pontos
Atividade em grupo : até 5 pessoas
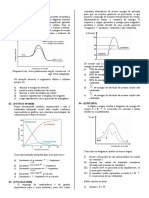
A cinética de uma enzima foi medida em função da concentração de substrato [S] na
presença e ausência de 2 mM do inibidor “I”, conforme a tabela abaixo:
Utilizando os conhecimentos adquiridos sobre a equação de Michaelis-menten e de duplo
recíproco execute as questões que se seguem:
a) Elabore um gráfico que correlaciona a concentração do substrato com sem inibidor e
com inibidor em relação a velocidade de reação conforme a tabela dada.
b) Quais são os valores de Vmax e KM na ausência e presença de inibidor?
c) Elabore o gráfico duplo recíproco, usando equações dadas, lembrando que o ponto
que cruza o eixo x corresponde ao valor de 1/Km e o valor que cruza o eixo y é o
valor de 1/Vmax.
d) conforme suas conclusões acerca dos gráficos obtidos discuta qual o tipo de inibição?
e) Qual é a constante de afinidade do inibidor? Explique esse conceito.
ATENÇÂO: Para a resolução dessa atividade a leitura do capítulo 6 do livro Principios da
Bioquimica de Lehninger, mais especificamente o topico 6..3- A cinética enzimática como
abordagem à compreensão do mecanismo. (presente na aba do AVA -Material
complementar ) Certamente irá auxiliar muito.
Você também pode gostar
- Aula 7 Cinetica EnzimaticaDocumento3 páginasAula 7 Cinetica EnzimaticaAndréia AnschauAinda não há avaliações
- ListaDocumento2 páginasListaGildo FreitasAinda não há avaliações
- QBQ230N-Aula 6 - Enzimas Estudo Dirigido 2012Documento2 páginasQBQ230N-Aula 6 - Enzimas Estudo Dirigido 2012cadimogirlAinda não há avaliações
- Exercícios EnzimasDocumento2 páginasExercícios EnzimasBeatriz MouraAinda não há avaliações
- Resolução Prova Bioquimica UFMGDocumento4 páginasResolução Prova Bioquimica UFMGWilza GomesAinda não há avaliações
- Lista de Exercícios - Bioquímica 1Documento2 páginasLista de Exercícios - Bioquímica 1Bruno Campana SeverinoAinda não há avaliações
- Roteiro de Estudo EnzimologiaDocumento2 páginasRoteiro de Estudo EnzimologiaLourivalPaivaGrilloJúniorAinda não há avaliações
- 3-A Ligação Peptídica Resulta Da União Entre o Grupo: A) Carboxila de Um Aminoácido e o Grupo CarboxilaDocumento2 páginas3-A Ligação Peptídica Resulta Da União Entre o Grupo: A) Carboxila de Um Aminoácido e o Grupo CarboxilaAna Julia De Almeida BragaAinda não há avaliações
- Estudo Dirigido BioquimicaDocumento2 páginasEstudo Dirigido BioquimicaCiroAinda não há avaliações
- Calculando KMDocumento28 páginasCalculando KMAldayr Melo0% (1)
- Prova de BiofísicaDocumento3 páginasProva de BiofísicaPaola BarbosaAinda não há avaliações
- Estudo Dirigido - EnzimasDocumento3 páginasEstudo Dirigido - EnzimasbghnhAinda não há avaliações
- Lista de Exercícios de Enzimas e Introdução A Cinética EnzimáticaDocumento4 páginasLista de Exercícios de Enzimas e Introdução A Cinética EnzimáticaThiagoAinda não há avaliações
- Módulo 3Documento14 páginasMódulo 3Pedro FigueiraAinda não há avaliações
- Discursiva Estruturas Hiperestaticas EDSON PDFDocumento2 páginasDiscursiva Estruturas Hiperestaticas EDSON PDFNatália FlorianoAinda não há avaliações
- Segmentos Proposcionais ShowDocumento3 páginasSegmentos Proposcionais ShowAldemir GuimarãesAinda não há avaliações
- TF0328 - Atividade 02 - 2021Documento3 páginasTF0328 - Atividade 02 - 2021Alan PortalAinda não há avaliações
- Aulab MSSD Sistemas MecanicosDocumento3 páginasAulab MSSD Sistemas MecanicosSOPHIA LOREN DA SILVA GOMESAinda não há avaliações
- Prova de CN Mecânica ADNP 28 - 10 - 2020Documento1 páginaProva de CN Mecânica ADNP 28 - 10 - 2020Vitor PalmaAinda não há avaliações
- 10 Classe Exercicio 2Documento13 páginas10 Classe Exercicio 2Santos Sinababa80% (5)
- Victor Diego Faria Estudo Dirigido 3 - Engenharia Enzimática 1Documento11 páginasVictor Diego Faria Estudo Dirigido 3 - Engenharia Enzimática 1Victor Diego FariaAinda não há avaliações
- 1 Avaliaçaõ 20222Documento1 página1 Avaliaçaõ 20222Alesca VitoriaAinda não há avaliações
- Apostila de ExercíciosDocumento44 páginasApostila de Exercícioscjriger100% (1)
- Unit Operations of Chemical Engineering-WarrenL. McCabeDocumento6 páginasUnit Operations of Chemical Engineering-WarrenL. McCabeRaira CheferAinda não há avaliações
- Aula3 FeitaDocumento13 páginasAula3 FeitaRandom NameAinda não há avaliações
- Problema Cinetica Enzimatica QB-2021Documento5 páginasProblema Cinetica Enzimatica QB-2021Maria PintoAinda não há avaliações
- Estr. HiperesDocumento3 páginasEstr. HiperesGabriela BahiaAinda não há avaliações
- Lista 2 - Matriz Inversa Determinantes e Sistemas LinearesDocumento2 páginasLista 2 - Matriz Inversa Determinantes e Sistemas LinearesMarcelo LimaAinda não há avaliações
- Agro Roteiro 04Documento3 páginasAgro Roteiro 04Erivelton OliveiraAinda não há avaliações
- FT Diversidade Na Biosfera (Tudo)Documento5 páginasFT Diversidade Na Biosfera (Tudo)Ana PerfeitoAinda não há avaliações
- NUM Exercícios Lista UnicaDocumento10 páginasNUM Exercícios Lista UnicaMarcio LuizAinda não há avaliações
- Exercícios EnzimasDocumento1 páginaExercícios EnzimasJairelda Sousa RodriguesAinda não há avaliações
- LBP Estatístico Aplicado Ao Reconhecimento de Expressões FaciaisDocumento12 páginasLBP Estatístico Aplicado Ao Reconhecimento de Expressões FaciaisRaphael MendonçaAinda não há avaliações
- Colégio Pedro Ii - Campus São Cristóvão Iii Aprofundamento de Matemática - 2014 Professores: Maria Helena / Walter Tadeu AULA 12: MatrizesDocumento6 páginasColégio Pedro Ii - Campus São Cristóvão Iii Aprofundamento de Matemática - 2014 Professores: Maria Helena / Walter Tadeu AULA 12: MatrizesgeovanacamposAinda não há avaliações
- Lista de Exercícios - CinéticaDocumento1 páginaLista de Exercícios - CinéticaAna CarolinaAinda não há avaliações
- Alocação de Bancos de Capacitores - CONNEPIDocumento8 páginasAlocação de Bancos de Capacitores - CONNEPIildemisonAinda não há avaliações
- Respostas 3a Prova GAAL TOL ExtraDocumento5 páginasRespostas 3a Prova GAAL TOL ExtraMarcelo LimaAinda não há avaliações
- Questionário Ii - Algebra LinearDocumento4 páginasQuestionário Ii - Algebra LinearLucenildo VitorinoAinda não há avaliações
- Atividade 4Documento30 páginasAtividade 4Francinette Mendes LopesAinda não há avaliações
- POTENCIASDocumento2 páginasPOTENCIASIsaac PimentelAinda não há avaliações
- 2 Prova de Química Orgânica I Teorica-1Documento4 páginas2 Prova de Química Orgânica I Teorica-1Virgínia Moura0% (1)
- Análise de Componentes PrincipaisDocumento13 páginasAnálise de Componentes PrincipaisRose NascimentoAinda não há avaliações
- Segunda Prova Tecn FermentDocumento3 páginasSegunda Prova Tecn FermentPriscilla MartinsAinda não há avaliações
- Teste Avaliacao 06Documento7 páginasTeste Avaliacao 06MafaldaAinda não há avaliações
- Atividade de EstatisticaDocumento3 páginasAtividade de EstatisticaHugo FerrerAinda não há avaliações
- 1a Lista - Reacões e MecanismosDocumento5 páginas1a Lista - Reacões e MecanismosMarcelle BispoAinda não há avaliações
- Qa415 QuimioDocumento13 páginasQa415 QuimioWerickson Fortunato de Carvalho RochaAinda não há avaliações
- Mat. Compositos 3 VA - 2021-1Documento2 páginasMat. Compositos 3 VA - 2021-1Maria EduardaAinda não há avaliações
- Ficha ComplementarDocumento3 páginasFicha ComplementarAdriano RafaelAinda não há avaliações
- Conjunto SDocumento33 páginasConjunto SRoger MascarenhasAinda não há avaliações
- Cinética Lista IDocumento4 páginasCinética Lista ICoordenação Pedagógica LúmenAinda não há avaliações
- Apostila Quimica 3Documento5 páginasApostila Quimica 3Elizabeth CarvalhoAinda não há avaliações
- Exercício 2Documento1 páginaExercício 2Luana MorenaAinda não há avaliações
- Caderno Exercicios EstatisticaDocumento40 páginasCaderno Exercicios EstatisticaMateus De JesusAinda não há avaliações
- Aula 02 Cinetica QuimicaDocumento45 páginasAula 02 Cinetica Quimicacadsus susAinda não há avaliações
- Estudos Sobre Os Parâmetros Cinéticos Da Reação Da Enzima Acetilcolinesterase Imobilizada Sobre Nanotubos de CarbonoDocumento1 páginaEstudos Sobre Os Parâmetros Cinéticos Da Reação Da Enzima Acetilcolinesterase Imobilizada Sobre Nanotubos de CarbonoNICOLAS BENEDICTO ALMEIDAAinda não há avaliações
- Análise de Componentes PrincipaisDocumento13 páginasAnálise de Componentes PrincipaisRose NascimentoAinda não há avaliações
- Prova 3 II 2001Documento2 páginasProva 3 II 2001Iago LimaAinda não há avaliações