Escolar Documentos
Profissional Documentos
Cultura Documentos
Transição de Cores Teste de Chama
Transição de Cores Teste de Chama
Enviado por
Felipe B. de Oliveira FlorêncioDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Transição de Cores Teste de Chama
Transição de Cores Teste de Chama
Enviado por
Felipe B. de Oliveira FlorêncioDireitos autorais:
Formatos disponíveis
5
Introduo A luz composta por radiaes eletromagnticas, um tipo de onda formada por um campo eltrico e um campo magntico. Todas as radiaes eletromagnticas viajam no vcuo a uma velocidade de 3,00x108 m/s, e esta velocidade representada pela constante c, sendo chamada de velocidade da luz (1). As caractersticas ondulatrias da radiao eletromagntica se devem s oscilaes peridicas entre o campo magntico e o campo eltrico. Isto d origem a duas caractersticas da onda: o comprimento ( e freqncia ( . O comprimento e
a frequncia da onda eletromagntica esto relacionados, pois a velocidade da onda sempre a mesma (velocidade da luz). Se o comprimento da onda longo, sua frequncia ser baixa; se a frequncia da onda alta, seu comprimento ser curto. Desta forma, pode-se dizer que a frequncia de uma onda eletromagntica inversamente proporcional ao seu comprimento e diretamente proporcional razo entre a velocidade da luz e o comprimento de onda (2).
Esta relao entre o comprimento e a frequncia da onda pode ser observada na figura 1:
Figura 1 Relao entre o comprimento e a frequncia de uma onda. Quanto maior o comprimento, mais baixa a frequncia; quanto menor o comprimento, mas alta a frequncia.
A frequncia expressa em ciclos por segundo, e a sua unidade o Hertz (Hz). Esta unidade equivale ao inverso de um segundo, ou seja:
ou
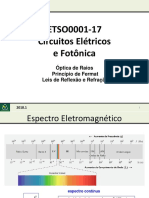
a frequncia da luz que determina a sua cor. Nossos olhos detectam diferentes cores porque eles respondem de forma diferente a cada freqncia (). Apenas uma estreita faixa de frequncias (e, consequentemente de comprimentos de onda), visvel ao olho humano. o chamado espectro da luz visvel. Esta faixa de luz visvel se estende entre as frequncias maiores que o infravermelho e menores que o ultravioleta, e entre comprimentos menores que 700 nm maiores que 420 nm como pode ser observado na figura 2 e na tabela A:
(1)
Figura 2 Espectro de luz visvel.
Cor Violeta Azul Verde Amarelo Laranja Vermelho
Comprimento de onda ( 420 nm 470 nm 530 nm 580 nm 620 nm 700 nm
Frequncia 7,1x10-14 Hz 6,4x10-14 Hz 5,7x10-14 Hz 5,2x10-14 Hz 4,8x10-14 Hz 3,0x10-14 Hz
Tabela A - Comprimentos de onda e frequncia caractersticos de cada cor de radiao eletromagntica.
Quando um objeto aquecido, ele emite radiao, que pode ser observada atravs da sua cor. Um exemplo o aquecimento de metais nas indstrias metalrgicas, quando eles emitem uma cor vermelha intensa, como pode ser visto na figura 3:
Figura 3 Ao fundido emitindo radiao luminosa quando aquecido.
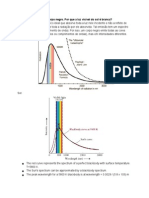
Observa-se que a cor emitida pelo corpo aquecido depende da sua temperatura. Assim, pode-se concluir que a frequncia e o comprimento da radiao eletromagntica est diretamente ligada energia absorvida pelo corpo durante o aquecimento. A figura 4 mostra a relao entre a energia e a frequncia da onda eletromagntica:
Figura 4 - Relao entre a energia e a frequncia de uma onda.
Pela figura, podemos ver que um corpo que emite radiao em uma frequncia percebida pelos nossos olhos como azul tem mais energia, e, portanto, mais quente do que um corpo que emite radiao na faixa do vermelho. Este um fenmeno que os fsicos do final do sculo XIX tentavam explicar. Contudo, as leis da Fsica ainda no eram capazes de explicar estas observaes. Foi em 1900 que o fsico alemo Max Planck props que a energia era liberada ou absorvida pelos tomos dos corpos aquecidos em pacotes de energia de valores mnimos, os quais Planck chamou de quantum (plural quanta), e que a energia de um nico quantum igual frequncia da onda eletromagntica multiplicada por uma constante. Esta constante, representada por Planck. Esta constante tem valor igual a e conhecida como constante de (joule segundo). De acordo
com Planck, a energia emitida ou absorvida por um corpo em mltiplos de Portanto, a energia de um nico quantum igual a:
Alguns anos aps a apresentao da teoria de Planck, alguns cientistas comearam a perceber que podiam aplicar esta teoria a algumas observaes experimentais antes em explicao, e se tornou fcil perceber que Planck havia
iniciado uma revoluo nos conhecimentos do mundo fsico. Depois de Planck, cientistas iniciaram seus estudos partindo da teoria da energia quantizada. Albert Einstein, por exemplo, ganhou um prmio Nobel de Fsica ao explicar o efeito fotoeltrico, fenmeno pelo qual foi observado que existe uma frequncia mnima de luz para que um eltron seja emitido de uma superfcie metlica onde h incidncia de um feixe de luz. Einstein props que a energia que atinge a superfcie metlica um fluxo contnuo de pacotes de energia mnima, e a cada pacote de energia mnima, Einstein denominou de fton. Complementando a teoria de Planck, Einstein deduziu que cada fton deveria ter uma energia proporcional frequncia da luz, e, portanto, a prpria energia radiante quantizada. Depois de Einstein, Niels Bohr foi outro cientista a receber um prmio Nobel em Fsica por estudos realizados a partir da teoria de Planck. A partir destes estudos, Bohr elaborou sua teoria sobre a estrutura atmica, a teoria atmica mais completa aceita at os dias de hoje. Partindo de suas descobertas, Bohr acabou por explicar o modelo atmico de Rutherford, que ainda era um desafio para a sociedade cientfica, pois no poderia ser explicado pela Fsica Clssica. De acordo com Rutherford, os eltrons ou ficariam estacionados ao redor do ncleo, ou descreveriam rbitas ao seu redor, como se fosse uma representao microscpica do sistema solar, que, das duas proposies, era a mais aceita. Porm, de acordo com a Fsica Clssica, se os eltrons permanecessem estacionados, seriam imediatamente atrados pelo ncleo, e se os eltrons descrevessem rbitas ao seu redor, perderiam energia gradativamente e tambm acabariam por cair no ncleo, o que destruiria o tomo. O trabalho de Bohr teve incio nas observaes dos espectros de linhas (figura 5), um fenmeno que intrigava os cientistas da poca.
Figura 5 - Espectro de linhas do hidrognio.
10
Os espectros de linhas so um fenmeno atravs do qual se observa que, quando um gs submetido alta presso dentro de um tubo e aplicada uma alta voltagem, este gs emite diferentes cores de luz. Quando esta luz passa atravs de um prisma, o espectro resultante composto apenas por algumas linhas em poucos comprimentos de onda. Estas linhas so espaadas por regies escuras, onde no se observa a incidncia de luz, e, portanto, correspondem ausncia de comprimentos de onda naquelas determinadas faixas. possvel tambm observar que os tomos excitados deste gs brilham exatamente na cor de suas linhas espectrais. Este fenmeno intrigava a sociedade cientfica, pois esta ainda no compreendia como um tomo poderia emitir exclusivamente algumas frequncias de luz, e no todas simultaneamente. Bohr, ento, prope que um tomo s pode perder energia em certas quantidades discretas e definidas. A partir desta proposio, surge uma explicao a nvel eletrnico, que daria origem teoria atmica de Bohr: se um tomo s pode perder energia em quantidades discretas e definidas, isto sugere que os eltrons s podem existir em uma srie de nveis discretos e definidos de energia. Quando um eltron absorve mais energia do que a energia definida que j possui, ele passa a ocupar um nvel maior de energia, realizando o chamado de salto quntico, como pode ser observado na figura 6:
Figura 6 - Salto quntico realizado pelo eltron, quando este absorve um pacote de energia caracterstico (fton) e salta para um nvel mais energtico.
Porm, o tomo no permanece estvel quando realiza este salto quntico, e tende a liberar esta energia e voltar a seu nvel inicial de energia. Ao voltar ao seu nvel inicial de energia, a energia absorvida liberada em forma de luz, de cor
11
caracterstica do elemento deste tomo e diretamente relacionada com a energia caracterstica de absoro deste elemento. Os pacotes de energia mnima liberada so chamados ftons. A energia de um fton calculada pela diferena entre a energia superior e a energia inferior:
Estas teorias so hoje comprovadas a partir de clculos e experimentos. Entre eles, est o teste de chama. Neste experimento, sais (principalmente os que possuem nions volteis na chama oxidante, como o cloro, por exemplo) so expostos chama. Na chama, absorvem energia em forma de calor e esta energia provoca a excitao dos eltrons, forando-os a realizar o salto quntico. Ao retornarem ao seu estado inicial de energia, liberam ftons de luz de cores caractersticas a cada elemento. Na tabela abaixo esto relacionadas as cores da radiao eletromagntica emitida por cada elemento (os elementos mais comuns utilizados em testes de chama): Elemento Ltio Sdio Potssio Clcio Estrncio Brio Ferro Cobre Cobalto Cor da luz emitida Vermelho Amarelo Violeta Laranja Vermelho Verde Laranja Verde Azul
Tabela B - Cores da radiao emitida por alguns elementos.
Objetivos Identificar a colorao emitida por alguns compostos por via seca (na chama), pois se algum dia ao se deparar com alguns compostos que no possui identificao, pode-se analis-lo por via seca, para se saber que sal possui, e confirmar com isso a teoria de Bohr e Planck para explicar o fenmeno ocorrido no teste de chama,
12
observando-se a cor emitida por certos sais na chama, calculando-se tambm a energia radiante emitida por cada sal. Procedimento Experimental a) Materiais utilizados: - Bico de Bunsen; - Fio de Platina; - Bquer; - Esptula de metal; - 7 Vidros de relgio; - HCl; - LiCl; - NaCl; - KCl; - CaCl2; - SrCl2; - BaCl2; - CuCl2; b) Procedimento: Primeiramente, colocou-se uma soluo de HCl dentro de um bquer limpo, para que pudesse ser feita a limpeza do fio de platina. O fio de patina foi mergulhado na soluo de HCl e levado a chama do bico de Bunsen para ser retiradas as impurezas nele contidas. Feito isso, com a ajuda de uma esptula, foram coletados em sete vidros de relgio os seguintes sais LiCl, NaCl, KCl, CaCl2, SrCl2, BaCl2, CuCl2. Uma vez coletado os sais e com o fio de patina devidamente limpo, mergulhou-se o fio de platina no vidro de relgio contendo o LiCl para que o sal aderisse ao fio. Com o sal aderido ao fio, levou-se o fio a chama do bico de Bunsen para que o sal fosse aquecido. Logo aps foi efetuada a limpeza do fio de platina, mergulhando-o na soluo de HCl e levando o em seguida a chama. Este procedimento foi repetido com todos os sais, observando-se a colorao da chama emitida por cada um dos sais testados.
13
Resultados e Discusses Comparando as cores encontradas na literatura com as cores observadas experimentalmente tem-se: Sal LiCl NaCl KCl CaCl2 SrCl2 BaCl2 CuCl2 Cor na literatura Vermelho Amarelo Violeta Laranja Vermelho Verde Verde Cor observada Vermelho Amarelo Amarelo Laranja Vermelho Verde Azul esverdeado
Tabela C: cores observadas na literatura e cores observadas no teste de chama.
Pode-se observar que algumas cores observadas no condizem com a literatura. Assim, surgem algumas diferentes hipteses para a margem de erro, como:
Observou-se que o CuCl2 quando levado a chama durante o experimento apresentou-se uma colorao entre o azul e o verde. Pensou-se, num primeiro momento, que o fio de clipe poderia estar contaminado. Ento, mergulhou-se o fio no cido clordrico concentrado e levou-se a chama, mas percebeu-se que o fio estava limpo. A partir da pode-se concluir que o sal pode emitir dois comprimentos de onda diferentes, ou seja, porque tem mais orbitais e mais nmeros de eltrons, conseqentemente, mais nveis energticos e por isso duas cores.
A amostra do sal tambm poderia estar contaminada, pois o fio utilizado no era adequado, pois o que utilizamos era um clipe, onde o contato com a chama tambm poderia faz-la reagir e formar compostos com as substncias que so utilizadas na sua fabricao. O ideal utilizar-se fio inerte, como o de platina, que resulta numa chama limpa e brilhante, no influencia na cor da chama.
Outro erro, pode-ser dizer, o fato de ficarem presos no fio outros sais, contaminando os outros e modificando a colorao. Por isso, aps todos os ensaios, o fio de clipe deve ser limpo com cido clordrico como foi feito na prtica. melhor conservar o fio permanente no cido e tambm a cada aquecimento esperar a haste esfriar.
14
Outro fato ocorrido foi o ensaio do KCl ser deixado por ltimo para levar a chama. A cor observada foi totalmente diferente, pois a literatura nos forneceu a cor violeta, porm a cor observada, conforme a tabela 1 foi amarela. O fato se explica pelo fato do bico de Bunsen utilizado na prtica ser diferente dos outros contidos no laboratrio, e, talvez, algum defeito neste bico de Bunsen. Testando-se mais de duas vezes, com a ajuda do professor, pudemos finalmente ver a cor violeta nas bordas da chama, mas com dificultosa visualizao.
Mesmo havendo margem de erros, calculou-se, a partir da tabela contida na introduo, a energia radiante de cada composto, de acordo com o comprimento de onda que encontrado com base nas cores observadas. Calculou-se a energia radiante atravs da frmula:
Onde
a energia radiante, em joules,
a constante de Planck e
frequncia da onda eletromagntica, em hertz. Os valores encontrados esto descritos na tabela abaixo: Sal KCl CuCl2 BaCl2 NaCl CaCl2 SrCl2 LiCl Energia radiante (J) 4,7. 10-48 4,24. 10-47 3,49. 10-47 3,44. 10-47 3,18. 10-47 1,98. 10-47 1,98. 10-47
Tabela D - Energia radiante E (joule J) dos diferentes sais
Concluses Atravs deste experimento pode-se concluir que a cor observada a dos ctions, porque o nion de todos os sais igual e provavelmente no emite luz no visvel. Aprendeu-se a colocar em prtica o modelo atmico de Bohr para explicar diferentes
15
ctions metlicos que emitem cores diferentes e seus respectivos motivos emitirem tais cores. Entendeu-se como funcionam as camadas e subcamadas no espectro de emitir e absorver energia. Calculou-se tambm a energia atravs do comprimento de onda do espectro eletromagntico.
Referncias
1
ATKINS, P. JONES, L. Chemistry: Molecules, Matter and Change. 4 ed. 2000. BROWN, T. L; LEMAY, H. E.; BURSTEN, B. E. Qumica: a cincia central.
Traduo de Robson Matos. So Paulo: Pearson Prentice Hall, 2005. ATKINS, P.; JONES, L. Princpios de Qumica: Questionando a Vida Moderna e o Meio Ambiente. Traduo de Ricardo Bicca de Alencastro. 3 ed. Porto Alegre: Bookman, 2006.
Distribuio
de
energia
linhas
espectrais.
Disponvel
em
http://www.astro.iag.usp.br/~jane/aga215/aula05/cap5b.htm, acesso em 05/03/10.
Você também pode gostar
- Principios Da Cincia e Engenharia Dos Materiais Smith Willian SebentaDocumento134 páginasPrincipios Da Cincia e Engenharia Dos Materiais Smith Willian SebentaJosé Macedo100% (3)
- Espiritualidade Quântica (Amit Goswami Valentina R. Onisor)Documento253 páginasEspiritualidade Quântica (Amit Goswami Valentina R. Onisor)Wagner Coelho Henriques100% (8)
- Exercícios Mecanica QuanticaDocumento7 páginasExercícios Mecanica Quanticadario frota0% (1)
- Lista de Exercícios - P1Documento7 páginasLista de Exercícios - P1malhenasmAinda não há avaliações
- Espectroscopia EletrônicaDocumento15 páginasEspectroscopia EletrônicaWagner MirandaAinda não há avaliações
- Apostila de Espectrofotometria Uv-VisDocumento50 páginasApostila de Espectrofotometria Uv-VisLuana Pacheco50% (2)
- Ondas Luminosas - Notas de AulaDocumento9 páginasOndas Luminosas - Notas de AulaCRgamer 1Ainda não há avaliações
- Aula Espectrofotometria Uvvis MarliDocumento88 páginasAula Espectrofotometria Uvvis MarliGraziela Dantas100% (1)
- Espectro EletromagnéticoDocumento5 páginasEspectro EletromagnéticoIsrael AlvesAinda não há avaliações
- Aplicação Da Cromopuntura Como Forma de Terapia AlternativaDocumento7 páginasAplicação Da Cromopuntura Como Forma de Terapia AlternativaAesthesisAinda não há avaliações
- Artigo 1-3 - Espectro VisivelDocumento3 páginasArtigo 1-3 - Espectro VisivelcavoulerAinda não há avaliações
- Quântica - Lista 1Documento3 páginasQuântica - Lista 1Kelly Oliveira de SouzaAinda não há avaliações
- Apostila de Cromoterapia E CristaisDocumento26 páginasApostila de Cromoterapia E CristaisPNicacioAinda não há avaliações
- Apostila de Cromoterapia E CristaisDocumento27 páginasApostila de Cromoterapia E CristaisCarlo DamiãoAinda não há avaliações
- Relatório Transição Eletrônica e CoresDocumento4 páginasRelatório Transição Eletrônica e CoresFelippe NevesAinda não há avaliações
- Fotometria para BiologistasDocumento9 páginasFotometria para BiologistasEveraldo Borges da CostaAinda não há avaliações
- ABSORCIOMETRIA S PDFDocumento37 páginasABSORCIOMETRIA S PDFRafael TorreAinda não há avaliações
- Absorciometria SDocumento37 páginasAbsorciometria SJoão Paulo de MenezesAinda não há avaliações
- Apostila de Espectrofotometria Uv-Vis 2004Documento50 páginasApostila de Espectrofotometria Uv-Vis 2004Marquin veloxAinda não há avaliações
- Carac Da LuzDocumento43 páginasCarac Da LuzsamyrsundfeldAinda não há avaliações
- Espectro PDFDocumento64 páginasEspectro PDFLuis SantanaAinda não há avaliações
- Ondas ElectromagneticasDocumento35 páginasOndas ElectromagneticasItalian4Ainda não há avaliações
- EspectrofotometriaDocumento15 páginasEspectrofotometriaFláviaAinda não há avaliações
- 03 - Luz e EspectrosDocumento5 páginas03 - Luz e EspectrosDiogo ClementinoAinda não há avaliações
- Aula 2Documento26 páginasAula 2Sem futuro animeAinda não há avaliações
- Unidade 1 Ondas Electromagneticas Radiacao Do Corpo NegroDocumento16 páginasUnidade 1 Ondas Electromagneticas Radiacao Do Corpo NegroGenito John0% (1)
- Aplicações Tecnológicas Da RadiaçãoDocumento17 páginasAplicações Tecnológicas Da RadiaçãoesmeraldarangelpedrosaAinda não há avaliações
- Espectro de Emissão Do Átomo de HidrogénioDocumento6 páginasEspectro de Emissão Do Átomo de HidrogénioStephane Azevedo100% (2)
- Apostila LASERDocumento27 páginasApostila LASERMarcelo MeloAinda não há avaliações
- Física Quântica - ResumoDocumento8 páginasFísica Quântica - Resumoroger_meloAinda não há avaliações
- Ondas EletromagnéticasDocumento40 páginasOndas EletromagnéticasSamuel SenaAinda não há avaliações
- Absorção AtômicaDocumento17 páginasAbsorção AtômicaAramís PereiraAinda não há avaliações
- CEF Aula9 Óptica Geométrica PDFDocumento52 páginasCEF Aula9 Óptica Geométrica PDFRosiane MartinsAinda não há avaliações
- QuimicaDocumento37 páginasQuimicaGlória BentoAinda não há avaliações
- Apostila de Lab. de Física Moderna IIDocumento31 páginasApostila de Lab. de Física Moderna IIMarco Aurélio Da SilvaAinda não há avaliações
- Comprimento de OndaDocumento4 páginasComprimento de OndadrjppclientAinda não há avaliações
- InfravermelhoDocumento12 páginasInfravermelhoAnayla SousaAinda não há avaliações
- EspectofotometriaDocumento36 páginasEspectofotometriaGraciela CentenaroAinda não há avaliações
- Comprimento de Onda - Wikipédia, A Enciclopédia LivreDocumento16 páginasComprimento de Onda - Wikipédia, A Enciclopédia LivreDaniel CumbeAinda não há avaliações
- APOSTILA TNA 5795 Detectores Semicondutores de RadiaçãoDocumento52 páginasAPOSTILA TNA 5795 Detectores Semicondutores de RadiaçãoEzequiel José de MoraisAinda não há avaliações
- Interações Entre A Energia e A MatériaDocumento15 páginasInterações Entre A Energia e A MatériaCarlos CruzAinda não há avaliações
- Cap 04 CorDocumento9 páginasCap 04 CorLays MarquesAinda não há avaliações
- Propriedades Ópticas Da MatériaDocumento30 páginasPropriedades Ópticas Da MatériaStefania OliveiraAinda não há avaliações
- Ondas Eletro. e RadioatividadeDocumento58 páginasOndas Eletro. e RadioatividadeFilipe AraujoAinda não há avaliações
- Apostila EspectrofotometriaDocumento21 páginasApostila EspectrofotometriaVenancio Rabissone MissomaliAinda não há avaliações
- Exp01 (Transições Eletrônicas)Documento8 páginasExp01 (Transições Eletrônicas)Isaac RosaAinda não há avaliações
- Optica GeometricaDocumento6 páginasOptica GeometricaAntonio LinoAinda não há avaliações
- Ondas Electromagnéticas - CorrigidoDocumento21 páginasOndas Electromagnéticas - CorrigidoMabikane.C. Arnaldo100% (1)
- ESPECTROSCOPIA rfc-2Documento84 páginasESPECTROSCOPIA rfc-2johnpresesAinda não há avaliações
- Espectrometria e Espectro MagnéticoDocumento15 páginasEspectrometria e Espectro Magnéticozeqs9Ainda não há avaliações
- CEF Aula9 Óptica Geométrica HeloiseDocumento47 páginasCEF Aula9 Óptica Geométrica Heloisetaynah mayaraAinda não há avaliações
- Slides BohrDocumento35 páginasSlides BohrPorto Gee50% (2)
- Aula - Topico05 - Introdução À Mecânica QuânticaDocumento30 páginasAula - Topico05 - Introdução À Mecânica Quânticagiovana bechelliAinda não há avaliações
- Texto para LeituraDocumento17 páginasTexto para LeiturachristianAinda não há avaliações
- LuzecorDocumento10 páginasLuzecorAmanda BalmanteAinda não há avaliações
- Trabalho de FísicaDocumento9 páginasTrabalho de FísicaFlora Stela DiogoAinda não há avaliações
- ANALITICADocumento23 páginasANALITICANatasha CabralAinda não há avaliações
- Aula 2 Espectrofotometria de Absorção Molecular Na Região Do Uv Vis. Elisangela de Andrade PassosDocumento16 páginasAula 2 Espectrofotometria de Absorção Molecular Na Região Do Uv Vis. Elisangela de Andrade PassosLis GonçalvesAinda não há avaliações
- Tomografia Computadorizada: Bases Físico - MatemáticasNo EverandTomografia Computadorizada: Bases Físico - MatemáticasAinda não há avaliações
- David Bohm e As Controversias Do Mundo Dos QuantaDocumento6 páginasDavid Bohm e As Controversias Do Mundo Dos QuantaLuanda de OliveiraAinda não há avaliações
- Química InôrganicaDocumento5 páginasQuímica InôrganicaAdrianaAinda não há avaliações
- AULADocumento9 páginasAULAThiago Vasconcelos100% (1)
- Eq10 Dossie Prof Teste Avaliacao 1 CorrecaoDocumento1 páginaEq10 Dossie Prof Teste Avaliacao 1 CorrecaoTeresaVaraoAinda não há avaliações
- Aula 6Documento19 páginasAula 6erickpivete38Ainda não há avaliações
- Eduardo C.G, 211. Iniciação Científica Completa 2021Documento25 páginasEduardo C.G, 211. Iniciação Científica Completa 2021Eduardo C.GAinda não há avaliações
- Aula 02 - Evolução Dos Modelos AtômicosDocumento3 páginasAula 02 - Evolução Dos Modelos AtômicosFelipe Moraes Dos SantosAinda não há avaliações
- 1 Prova de Fisica QuanticaDocumento3 páginas1 Prova de Fisica Quanticaterezinha alencarAinda não há avaliações
- O Fluido Cósmico Universal e As Teorias CosmológicasDocumento4 páginasO Fluido Cósmico Universal e As Teorias CosmológicasAndré Luís Mattedi Dias100% (1)
- Ficha Formativa - Modelo de Bohr e Modelo Nuvem Eletronica PDFDocumento3 páginasFicha Formativa - Modelo de Bohr e Modelo Nuvem Eletronica PDFLaura SantosAinda não há avaliações
- Configuração Eletrônica em Subníveis de EnergiaDocumento34 páginasConfiguração Eletrônica em Subníveis de EnergiaEmerson BechlerAinda não há avaliações
- Massa Isotópica e Massa Atómica Relativa MédiaDocumento24 páginasMassa Isotópica e Massa Atómica Relativa MédiaGonçaloFerreiraAinda não há avaliações
- QuimicaDocumento5 páginasQuimicaAngela Cristina SchneiderAinda não há avaliações
- Aula Nº. 7 e 8 Da 10 Classe PDFDocumento4 páginasAula Nº. 7 e 8 Da 10 Classe PDFJakendry 12Ainda não há avaliações
- Resumo. Módulo 1-Estrutura AtómicaDocumento10 páginasResumo. Módulo 1-Estrutura AtómicaL0prsAinda não há avaliações
- Tarcísia Da Silva Almeida: Questão 001Documento2 páginasTarcísia Da Silva Almeida: Questão 001Mario Damião R. Domingos100% (1)
- QO 01 Química Organica CompletaDocumento72 páginasQO 01 Química Organica CompletaAmedeo PetrucciAinda não há avaliações
- Ondas Microvibratórias e Forças InvisíveisDocumento4 páginasOndas Microvibratórias e Forças InvisíveisBenhur NunesAinda não há avaliações
- Exercicio Sobre Tabela Periodica 1Documento4 páginasExercicio Sobre Tabela Periodica 1Alcidio VazlinoAinda não há avaliações
- Estrutura Atômica-ProfDocumento73 páginasEstrutura Atômica-ProfFernando HenriqueAinda não há avaliações
- Simulado 02Documento3 páginasSimulado 02Renata PeresAinda não há avaliações
- Quantização de EnergiaDocumento8 páginasQuantização de EnergiaTiago FerreiraAinda não há avaliações
- Ciência e Engenharia Dos Materiais - Introdução e RevisãoDocumento56 páginasCiência e Engenharia Dos Materiais - Introdução e RevisãoPedro LealAinda não há avaliações
- Momento AngularDocumento17 páginasMomento AngularNatane IsabelAinda não há avaliações
- Lista Nc3bameros Quc3a2nticos Quc3admicacnsDocumento3 páginasLista Nc3bameros Quc3a2nticos Quc3admicacnsIgor SousaAinda não há avaliações
- Cap. 6 McQuarrie (Tradução)Documento32 páginasCap. 6 McQuarrie (Tradução)karinaAinda não há avaliações
- Mód 3 - Tabela Periódica e PropriedadesDocumento16 páginasMód 3 - Tabela Periódica e PropriedadesAline F da CostaAinda não há avaliações