Escolar Documentos
Profissional Documentos
Cultura Documentos
Resultados e Discussões Relatorio Cristalização
Enviado por
Helouyze OliveiraDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Resultados e Discussões Relatorio Cristalização
Enviado por
Helouyze OliveiraDireitos autorais:
Formatos disponíveis
Resultados e discussões
Massa de KCl pesado - 7,503 g
Massa de NaNO3 pesado - 8,513g
A solubilização dos sais em água destilada gerou os seguintes íons:
KCl K+ + Cl-
Água
NaNO3 Na+ + NO3-
Água
Molaridade dos íons em solução:
K+ - 3,935 g em solução 4,024 mol.L-1
Cl- - 3,566 g em solução 4,024 mol.L-1
Na+ - 2,305 g em solução 4,008 mol.L-1
NO3- - 6,212 g em solução 4,008 mol.L-1
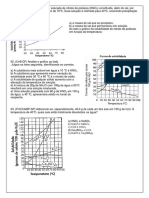
Gráfico de solubilidade de sais:
300
Solubilidade (g/100 mL de água)
250
200
KNO3
150
NaNO3
100 KCl
NaCl
50
0
0 20 40 60 80 100
Temperatura (°C)
Analisando o gráfico vemos que à temperatura de 20°C a solubilidade dos sais
KNO3, NaCl e KCl são muito próximos e o composto mais solúvel é o NaNO3, sendo o
menos solúvel à temperatura de 100°C o NaCl.
Durante o procedimento houve a formação de dois cristais com características
diferentes, apesar de ambos terem a coloração branca, o primeiro a ser obtido foi com
temperaturas mais baixas foi o KNO3, que durante a cristalização formou cristais com
longas hastes pontudas que foram observadas com auxílio do microscópio.
Já o segundo cristal obtido nessa reação de dupla troca foi o NaCl que é o
menos solúvel em temperaturas mais elevadas. Os cristais tendo forma de pequenos
grãos arredondados, que também foram observados com auxílio do microscópio
apesar de mesmo a olho nu ser possível notar as diferenças entre os dois.
Conclusão
Os dois cristais obtidos foram KNO3 e NaCl, e com mais alguns processos eles
poderiam ter sido purificados e reutilizados em outros procedimentos, economizando
assim recursos ao invés de serem descartados.
Você também pode gostar
- Exercícios Resolvidos Envolvendo Volumetria de PrecipitacaoDocumento38 páginasExercícios Resolvidos Envolvendo Volumetria de PrecipitacaoIlzonRamos79% (24)
- Lista de Exercícios 6Documento3 páginasLista de Exercícios 6Talita Dantas de OliveiraAinda não há avaliações
- Estudos Dirigidos e Problemas Resolvidos de Bioquimica IDocumento125 páginasEstudos Dirigidos e Problemas Resolvidos de Bioquimica ILucas Ricardo100% (8)
- Gabarito Da Tarefa 4 Revisada 2Documento13 páginasGabarito Da Tarefa 4 Revisada 2Eduarda PereiraAinda não há avaliações
- Atividade Propriedades ColigativasDocumento12 páginasAtividade Propriedades ColigativasOtoazevedo OtoazevedoAinda não há avaliações
- Físico Química SoluÇÕesDocumento4 páginasFísico Química SoluÇÕesanon-229665100% (2)
- Solubilidade Das Soluções PDFDocumento10 páginasSolubilidade Das Soluções PDFreykonpalAinda não há avaliações
- Fisico Quimica Solubilidade Exercicios Gabarito PDFDocumento10 páginasFisico Quimica Solubilidade Exercicios Gabarito PDFEmerson JuniorAinda não há avaliações
- 11FQ SolubilidadeDocumento9 páginas11FQ SolubilidadeJoana GulamhussenAinda não há avaliações
- Ficha-Exercicio 3 SolubilidadeDocumento2 páginasFicha-Exercicio 3 SolubilidadeDuarteAinda não há avaliações
- Experimento de QuímicaDocumento4 páginasExperimento de QuímicaAntonio JuniorAinda não há avaliações
- 12 - Soluções Curvas de SolubilidadeDocumento4 páginas12 - Soluções Curvas de SolubilidadeRodrigo MetteAinda não há avaliações
- 36 20solubilidade 20 - 20conceitos 20e 20curvas PDFDocumento12 páginas36 20solubilidade 20 - 20conceitos 20e 20curvas PDFCarolynne MourãoAinda não há avaliações
- Lista+de+exercícios+para+1 +prova+Quimica+AnalíticaDocumento5 páginasLista+de+exercícios+para+1 +prova+Quimica+Analíticabenedito.nasaAinda não há avaliações
- Soluções 321 QuestõesDocumento83 páginasSoluções 321 QuestõesThiago Alonso Rodrigues da Hora67% (3)
- Aula 5 PrecipitaçãoDocumento40 páginasAula 5 PrecipitaçãoNaailma MartinsAinda não há avaliações
- Quimica 2 Ano 2 ParteDocumento19 páginasQuimica 2 Ano 2 ParteJoão PauloAinda não há avaliações
- Lista2-Eletrólitos EquilíbrioSólidoLíquidoDocumento3 páginasLista2-Eletrólitos EquilíbrioSólidoLíquidoGabriela BuenoAinda não há avaliações
- Documento QuestõesDocumento83 páginasDocumento QuestõesJoão Mineiro Viana0% (1)
- Lista de Exerc DensidadeDocumento6 páginasLista de Exerc DensidadeRtyu IuytAinda não há avaliações
- Apontament - Quimic ResumoDocumento7 páginasApontament - Quimic ResumoAnaniasTitosChongoAinda não há avaliações
- Solucoes PDFDocumento15 páginasSolucoes PDFThiago Magno Tavares Machado100% (1)
- 56 20produto 20de 20solubilidade 20 - 20KpsDocumento32 páginas56 20produto 20de 20solubilidade 20 - 20KpsBelucio PedroAinda não há avaliações
- Coeficiente de SolubilidadeDocumento5 páginasCoeficiente de SolubilidadeRubia MariathAinda não há avaliações
- Fisico Quimica Solubilidade ExerciciosDocumento10 páginasFisico Quimica Solubilidade ExerciciosRubia MariathAinda não há avaliações
- 11FQA Ficha Trab Ini Q2.3 - N.º 1Documento3 páginas11FQA Ficha Trab Ini Q2.3 - N.º 1Andrei GalanAinda não há avaliações
- Relatorio 2Documento8 páginasRelatorio 2MilenaAinda não há avaliações
- A) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Documento5 páginasA) 35 B) 34 C) 33 D) 32 E) 31: Atividade de Química 2 1º TRIMESTRE/2023Ágata Ferreira S.1.T.10Ainda não há avaliações
- Exerc Coef SolubilidadeDocumento2 páginasExerc Coef Solubilidadelopesqui1766Ainda não há avaliações
- Manual de Preparo de SoluçôesDocumento38 páginasManual de Preparo de SoluçôesLairton100% (1)
- Lista 03 - Equilibrio e Volumetria de OxirreduçãoDocumento2 páginasLista 03 - Equilibrio e Volumetria de OxirreduçãoAna Raquel MartinsAinda não há avaliações
- 5 Lista de Exercícios QA IIDocumento2 páginas5 Lista de Exercícios QA IIliviasavignonAinda não há avaliações
- Atv. 4 - Volumetria de PrecipitaçãoDocumento5 páginasAtv. 4 - Volumetria de PrecipitaçãoDaniel FreitasAinda não há avaliações
- Fisico Quimica Solubilidade Exercicios GabaritoDocumento10 páginasFisico Quimica Solubilidade Exercicios GabaritoLuana GregórioAinda não há avaliações
- Aula01 Quimica2 ExercíciosDocumento4 páginasAula01 Quimica2 ExercíciosMarko Aurelio Ferreira Da CostaAinda não há avaliações
- Água TC EaD Parte 2Documento11 páginasÁgua TC EaD Parte 2jintkdAinda não há avaliações
- Capítulo 1 - SoluçõesDocumento18 páginasCapítulo 1 - SoluçõesGerson LimaAinda não há avaliações
- Equilibrios de PrecipitaçãoDocumento32 páginasEquilibrios de PrecipitaçãoAnne TremontiAinda não há avaliações
- Volumetria de PrecipitaçãoDocumento38 páginasVolumetria de PrecipitaçãoRenata G.Ainda não há avaliações
- Apostila - Eq em Reações de PrecipitaçãoDocumento11 páginasApostila - Eq em Reações de PrecipitaçãoAna Carolina LageAinda não há avaliações
- Atividade Sobre Coeficiente de SolubilidadeDocumento13 páginasAtividade Sobre Coeficiente de SolubilidadePedro HélioxAinda não há avaliações
- DispersõeDocumento5 páginasDispersõeHelton ClistenesAinda não há avaliações
- QUIMICA GERAL E CIENCIA DOS MATERIAIS - Ensaio de Dureza-Pilhas de Daniel-EletroliseDocumento6 páginasQUIMICA GERAL E CIENCIA DOS MATERIAIS - Ensaio de Dureza-Pilhas de Daniel-EletroliseFrancisco JacksonAinda não há avaliações
- Solubilidade e KPSDocumento4 páginasSolubilidade e KPSDirceu Lupiano DiasAinda não há avaliações
- Equilibrio de SolubiliadeDocumento41 páginasEquilibrio de SolubiliadeRômulo CampiAinda não há avaliações
- Relatório Ino1 Prática4Documento10 páginasRelatório Ino1 Prática4CBA CREDAinda não há avaliações
- Lista 1 - Tampão - KpsDocumento2 páginasLista 1 - Tampão - KpsNádila Lucarelli50% (2)
- PROVA FINAL - Quím. Anal. QuantitativaDocumento2 páginasPROVA FINAL - Quím. Anal. QuantitativaAlielson BotelhoAinda não há avaliações
- Aula 9 QA Classica KMBDocumento36 páginasAula 9 QA Classica KMBMuniz Ygor0% (1)
- Ficha de Trabalho PrecipitaçãoDocumento2 páginasFicha de Trabalho PrecipitaçãoAntonia MariaAinda não há avaliações
- Diluição de Soluções 2Documento24 páginasDiluição de Soluções 2Sandro BaldezAinda não há avaliações
- Respostas 13 Ao 17 Skoog PDFDocumento4 páginasRespostas 13 Ao 17 Skoog PDFDarcio ArthurAinda não há avaliações
- Exercicios de SolubilidadeDocumento6 páginasExercicios de Solubilidadesua mae de 4Ainda não há avaliações
- Relatorio Do Grupo 5Documento6 páginasRelatorio Do Grupo 5Kayque RangelAinda não há avaliações
- LAB 08 - Determinação Do Cloro Livre Numa Lexívia ComercialDocumento3 páginasLAB 08 - Determinação Do Cloro Livre Numa Lexívia Comercialaamorim2Ainda não há avaliações
- Roteiros de Práticas 2023-1Documento11 páginasRoteiros de Práticas 2023-1Danny CirqueiraAinda não há avaliações
- Lista de Química - Mol, Massa Molar e Concentração de Soluções 2º AnoDocumento1 páginaLista de Química - Mol, Massa Molar e Concentração de Soluções 2º AnoKAUA DE ARAUJO TEIXEIRAAinda não há avaliações
- Lista de Exercícios 7 - Propriedades ColigativasDocumento2 páginasLista de Exercícios 7 - Propriedades ColigativasThuyline DyandraAinda não há avaliações
- Alex 04 - Soluções - Coeficiente de SolubilidadeDocumento2 páginasAlex 04 - Soluções - Coeficiente de Solubilidaderomezioh7716Ainda não há avaliações
- Estudo de Algumas Propriedades Dos Metais Alcalinos-TerrososDocumento4 páginasEstudo de Algumas Propriedades Dos Metais Alcalinos-TerrososRodrigo da Silva MartinsAinda não há avaliações
- Química PPT - SoluçõesDocumento15 páginasQuímica PPT - SoluçõesQuímica PPT100% (1)
- AULA Defeitos em Cristais - Parte 2Documento36 páginasAULA Defeitos em Cristais - Parte 2jose.louzadaAinda não há avaliações
- Trabalho Final de Patologia em Elementos EstruturaisDocumento41 páginasTrabalho Final de Patologia em Elementos EstruturaisInacio Mauricio TomasAinda não há avaliações
- Cálculo Detalhado para Determinação Da Zona Livre de Queda (ZLQ)Documento9 páginasCálculo Detalhado para Determinação Da Zona Livre de Queda (ZLQ)maburdaAinda não há avaliações
- Lista de Massa MolarDocumento1 páginaLista de Massa MolarEmerson RochaAinda não há avaliações
- Apostila Física - Aula 02 - CalorimetriaDocumento7 páginasApostila Física - Aula 02 - CalorimetriaFísica Concurso Vestibular100% (5)
- DETERGENTES INDUSTRIAIS SorvetesDocumento5 páginasDETERGENTES INDUSTRIAIS SorvetesANTONIO CARLOSAinda não há avaliações
- CRE001 SG PE DWG 005 01 Planta Baixa 1 PavimentoDocumento1 páginaCRE001 SG PE DWG 005 01 Planta Baixa 1 PavimentoArthur AndradeAinda não há avaliações
- Diagrama de Ferro CarbonoDocumento25 páginasDiagrama de Ferro CarbonoToninho PorpinoAinda não há avaliações
- Rochas 2012Documento26 páginasRochas 2012Fabricio SantanaAinda não há avaliações
- 150 260Documento13 páginas150 260JailsondaSilvaAinda não há avaliações
- Eletroima Circular EletrocircularDocumento2 páginasEletroima Circular EletrocirculardanieleAinda não há avaliações
- Adensamento DNER IE005 94Documento170 páginasAdensamento DNER IE005 94Anonymous IabqZQ1tkAinda não há avaliações
- Aula 5 Volumetria de Complexacao PDFDocumento40 páginasAula 5 Volumetria de Complexacao PDFElaine FerreiraAinda não há avaliações
- Determinacao Da Dureza de Uma AguaDocumento3 páginasDeterminacao Da Dureza de Uma AguacamiludaAinda não há avaliações
- CAPÍTULO V. Introdução Ao Estudo Dos LigantesDocumento25 páginasCAPÍTULO V. Introdução Ao Estudo Dos LigantesAntónio MorelaAinda não há avaliações
- Universidade de BrasíliaDocumento99 páginasUniversidade de BrasíliaJohn Kennedy Fonseca SilvaAinda não há avaliações
- Catalogos de Rieles ASCEDocumento11 páginasCatalogos de Rieles ASCEJhonatan Diaz100% (2)
- Prova 8Documento3 páginasProva 8Marcos Henrique QuerinAinda não há avaliações
- DIAGRAMA DE FASES Aula1Documento35 páginasDIAGRAMA DE FASES Aula1Gabriella BalisaAinda não há avaliações
- As Aplicações e o Funcionamento de Um TermoparDocumento1 páginaAs Aplicações e o Funcionamento de Um Termoparfeira carreirasAinda não há avaliações
- Materiais Autolimpantes Conceitos, Propriedades e AplicaçõesDocumento11 páginasMateriais Autolimpantes Conceitos, Propriedades e AplicaçõesRenan Guilherme de Oliveira GuihAinda não há avaliações
- Arjo TornadoDocumento20 páginasArjo TornadoJose MoreiraAinda não há avaliações
- Fispq AlvaniaDocumento5 páginasFispq AlvaniaMatheus da Silva PintoAinda não há avaliações
- Rotulas, Terminais, Ponteiras e Buchas 20190408 140844 RottermDocumento72 páginasRotulas, Terminais, Ponteiras e Buchas 20190408 140844 RottermmaiquelernAinda não há avaliações
- Processos de Obtenção Do Ferro GusaDocumento22 páginasProcessos de Obtenção Do Ferro GusaGabriel HenriqueAinda não há avaliações
- Apostila Caldeiras Aquatubulares - SENAIDocumento31 páginasApostila Caldeiras Aquatubulares - SENAIMarcos Grisi100% (2)
- Slides Gases Ideais, Reais e Teoria Cinética Dos GasesDocumento61 páginasSlides Gases Ideais, Reais e Teoria Cinética Dos GasesLeonardo JuniorAinda não há avaliações