Escolar Documentos
Profissional Documentos
Cultura Documentos
Experimento: Medida Da Massa Molecular de Um Vapor: Método de Victor Meyer
Enviado por
Rebeca Maciel MoreiraDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Experimento: Medida Da Massa Molecular de Um Vapor: Método de Victor Meyer
Enviado por
Rebeca Maciel MoreiraDireitos autorais:
Formatos disponíveis
UNIVERSIDADE FEDERAL DA BAHIA - INSTITUTO DE QUÍMICA-
DEPARTAMENTO DE FÍSICO-QUÍMICA
DISCIPLINA: FISICO-QUÍMICA A, QUIA15_2022.1
EXPERIMENTO: MEDIDA DA MASSA MOLECULAR DE UM VAPOR:
MÉTODO DE VICTOR MEYER.
1. OBJETIVO:
Determinar a massa molecular de uma substância vaporizável, pelo método
idealizado por Victor Meyer usando a lei do gás ideal, a equação de van der Waals e o diagrama
generalizado do fator de compressibilidade.
2. INTRODUÇÃO:
No método de Victor Meyer, a massa molecular é obtida através da determinação
da massa específica () de um vapor, em condições conhecidas de temperatura (T) e de pressão
(P).
A partir da equação de estado do gás ideal, obtém-se a seguinte expressão:
RT
M =
p
Em que M = massa molecular
= massa específica ( = m V )
R = constante universal dos gases, em que o valor depende das unidades utilizadas
A massa específica () é determinada em 2 etapas:
Na primeira, determina-se a massa (m) da substância, sob forma líquida. Na segunda, vaporiza-
se esta massa e mede-se o volume (V) de ar deslocado que corresponde ao seu volume gasoso
em condições conhecidas de temperatura (T) e de pressão (p).O aparelho utilizado está
esquematizado na Figura 1.
Figura 1. Esquema da aparelhagem a ser utilizada
Como o ar é recolhido sobre a água dentro da bureta de gás, a pressão acima do nível da
água da bureta (Patm) é devida à pressão do ar (Par) mais a pressão do vapor d’água (Págua), na
temperatura (T).
Patm = Par + Págua
Então, a pressão do ar é:
Par = Patm - Págua
3. PROCEDIMENTO EXPERIMENTAL
a) Montagem do aparelho
Verifique se o tubo de vaporização está seco, introduza-o no banho de água 1, como
mostra a Figura 1, e prenda-o a um suporte universal. Inicie o aquecimento tendo o cuidado de
manter o tubo de vaporização sem a tampa. Encha o banho 2 com água e mergulhe a
extremidade inferior do tubo de saída no banho. Encha a bureta com água, em seguida, inverta
dentro do banho 2 de modo que o volume de água esteja entre 48 e 50 mL, de forma que,
posteriormente, o tubo de saída possa ser conectado e preso à bureta, como mostra a Figura 1.
Espere a água entrar em ebulição.
b) Preparação da amostra
Nesta experiência, a substância problema é fornecida pelo professor dentro de uma
ampola de vidro selada. Anote a massa da amostra contida na ampola que é indicada no
envelope. Verifique se ela está devidamente selada e sem possibilidade de vazamento de
amostra.
c) Preparação final
Quando a água estiver em ebulição, tampe o tubo de vaporização. Observe se sai bolhas
de ar pelo tubo de saída. Verifique se não há condensação de alguma substância na saída do tubo
de vaporização e se todas as bolhas de ar já escaparam pelo tubo de saída. Cheque se a água está
em ebulição.
Conecte o tubo de saída à bureta. Faça a leitura do volume na bureta. O aparelho
encontra-se em condições de operação.
d) Determinação
O procedimento a seguir deve ser realizado com a máxima rapidez.
Retire a tampa esmerilhada do tubo de vaporização. Quebre a ponta do capilar da ampola
contendo a amostra e jogue a ampola, com o seu capilar invertido para baixo, imediatamente
dentro do tubo de vaporização. Feche rapidamente o tubo introduzindo a tampa com firmeza e
girando-a em 45 graus, aproximadamente para melhor vedação.
Observe as bolhas de ar na bureta de gás. Quando todas as bolhas houverem escapado, o
fluxo de ar vai parar e o volume na bureta ficará constante. Anote o volume (V) de ar. Logo
após, o fluxo de água inverte no sentido do banho 2, para dentro do tubo de saída e do tubo de
vaporização. Abra o tubo de vaporização para evitar que a água entre no mesmo. Desligue o
aquecedor do banho 1. Anote a temperatura (T) da água do banho 2 e a pressão barométrica.
e) Repita o procedimento b, c, d duas ou três vezes.
4. TRATAMENTO DE DADOS
No relatório deve-se apresentar o objetivo, introdução, breve revisão da literatura,
descrição da parte experimental, o tratamento de dados dos seguintes resultados:
1. Calcule a massa molecular da substância, usando as seguintes equações:
a) pV = nRT
b) pV = znRT
n
2
c) p + a (V − nb ) = nRT
V
Procure na literatura os valores das constantes a e b de van der Waals da substância e os
valores das constantes críticas. Qual das três equações melhor representa o comportamento do
vapor? Justifique.
2. Calcule o erro relativo e enumere as possíveis causas de erro, sempre comparando seus
resultados com valores indicados na literatura.
3- Explique porque o fluxo de água na bureta pode inverter após a vaporização de toda a
amostra.
5. DISCUSSÃO DO TRATAMENTO DE DADOS
6. CONCLUSÕES
REFERÊNCIAS BIBLIOGRÁFICAS
1. RANGEL, R.N. - Práticas de Físico Química – 3 ª Edição, 2006. São Paulo.
2. DANIELS, F. et alli - Practicas de Química - Física - McGraw-Hill Book
Company, Inc. - 4a. ed. - Barcelona - pag. 8.
3. MACEDO, H. et alli - Manual de Laboratório - 1971 - UFRJ.
4, LIVROS TEXTOS DE FISICIQUIMICA ver bibliografia do curso.
Você também pode gostar
- Roteiro Victor Meyer Fisico-QuímicaDocumento3 páginasRoteiro Victor Meyer Fisico-QuímicaIsabela HeineAinda não há avaliações
- Rot - Vitor MeyerDocumento3 páginasRot - Vitor MeyerAdelmo FilhoAinda não há avaliações
- Apostila cq050Documento35 páginasApostila cq050Mari Maynardes AraujoAinda não há avaliações
- Apostila 2019 2Documento38 páginasApostila 2019 2Danilo Rodrigues de SouzaAinda não há avaliações
- Relatorio Gases 1Documento16 páginasRelatorio Gases 1Marcos VidalAinda não há avaliações
- Pratica 12 - Lei de Boyle-MariotteDocumento3 páginasPratica 12 - Lei de Boyle-MariotteVítor Dionizio SantosAinda não há avaliações
- DETERMINAÇÃO DE PONTO DE FUSÃO, EBULIÇÃO E DENSIDADE - Química - UTFPR - 2010Documento10 páginasDETERMINAÇÃO DE PONTO DE FUSÃO, EBULIÇÃO E DENSIDADE - Química - UTFPR - 2010joaomarcosls100% (1)
- CQ239 - Roteiros Dos ExperimentosDocumento25 páginasCQ239 - Roteiros Dos ExperimentosMarcella MantovaniAinda não há avaliações
- Exp 3 - PressaoVapDocumento13 páginasExp 3 - PressaoVapwalas joãoAinda não há avaliações
- Lista de Exercicios - Fenomenos de Transporte (Mecanica Dos Fluidos)Documento52 páginasLista de Exercicios - Fenomenos de Transporte (Mecanica Dos Fluidos)AndréVitorino60% (10)
- 02.experimento Pressão de Vapor - ArleyDocumento14 páginas02.experimento Pressão de Vapor - ArleyKarla Correia Alves100% (1)
- Experimento 3: Determinação Experimental Da Massa Molar Do Gás ButanoDocumento10 páginasExperimento 3: Determinação Experimental Da Massa Molar Do Gás ButanoJoelson Kalil Coelho100% (1)
- Pressão de Vapor Pelo Método DFQDocumento4 páginasPressão de Vapor Pelo Método DFQjulianadias91Ainda não há avaliações
- LEQ 1 - UFPE Roteiro Prática Pressão de Vapor 2023Documento4 páginasLEQ 1 - UFPE Roteiro Prática Pressão de Vapor 2023Alexandre HenriqueAinda não há avaliações
- Aula 02 - Estática Dos FluidosDocumento20 páginasAula 02 - Estática Dos FluidosBiancaAinda não há avaliações
- Relatório - Pressão de Vapor - FEQ EQ801 - UNICAMP - Grupo 2Documento19 páginasRelatório - Pressão de Vapor - FEQ EQ801 - UNICAMP - Grupo 2Gabriel S. Gusmão (Freddie)100% (1)
- Manual Praticas FQI 2016.1 PDFDocumento59 páginasManual Praticas FQI 2016.1 PDFMateus RamosAinda não há avaliações
- Relatório Lei de BoyleDocumento13 páginasRelatório Lei de BoyleJessica Lemos100% (1)
- Módulo 7 - Medidores de Pressão - Parte 1Documento13 páginasMódulo 7 - Medidores de Pressão - Parte 1Patrick LudsonAinda não há avaliações
- Determinação Da Massa MolarDocumento6 páginasDeterminação Da Massa MolarHenriquekalelAinda não há avaliações
- Relatório 4 - Tubo de VenturiDocumento9 páginasRelatório 4 - Tubo de VenturiJuniorAinda não há avaliações
- Relatorio Lei de BoyleDocumento13 páginasRelatorio Lei de BoyleLETICIA NUNES DOS SANTOSAinda não há avaliações
- 12 - Lei de Boyle-MariotteDocumento3 páginas12 - Lei de Boyle-MariotteMaria Eduarda MassenaAinda não há avaliações
- 9 - Lei de Boyle-MariotteDocumento3 páginas9 - Lei de Boyle-Mariottenobregagabriel9Ainda não há avaliações
- Relatório Eq GPDocumento19 páginasRelatório Eq GP1Tap UAinda não há avaliações
- Processo de Esvaziamento em Regime Estacionario PDFDocumento12 páginasProcesso de Esvaziamento em Regime Estacionario PDFCarol InfanteAinda não há avaliações
- Protocolos QA 2023-2024Documento29 páginasProtocolos QA 2023-2024dalpkh938Ainda não há avaliações
- 12 - Lei de Boyle-MariotteDocumento3 páginas12 - Lei de Boyle-MariotteALINE CRISTIANE DE MORAISAinda não há avaliações
- Gases IdeaisDocumento5 páginasGases IdeaisLeonardo MeloAinda não há avaliações
- Apostila - QUI - 153Documento69 páginasApostila - QUI - 153Lua GomesAinda não há avaliações
- Razao Entre As Capacidades Calorificas para GasesDocumento13 páginasRazao Entre As Capacidades Calorificas para GasesMariana GonçalvesAinda não há avaliações
- QUI 029 GasesDocumento7 páginasQUI 029 Gasesemanuelcnn38Ainda não há avaliações
- Experimento - Tenso SuperficialDocumento5 páginasExperimento - Tenso SuperficialbarbaraAinda não há avaliações
- Relatório Experimento 2Documento6 páginasRelatório Experimento 2Mariane Borges100% (2)
- Determinação Das Constantes Físicas de Compostos OrgânicosDocumento15 páginasDeterminação Das Constantes Físicas de Compostos OrgânicosDebora_ufalAinda não há avaliações
- Gases Idea IsDocumento5 páginasGases Idea Isjessica.m.pereiraAinda não há avaliações
- Exercício 1 - Gases e Mudança de FasesDocumento7 páginasExercício 1 - Gases e Mudança de FasesEvandro CoelhoAinda não há avaliações
- Lista 2 Fixação 2017 1Documento4 páginasLista 2 Fixação 2017 1Fabiano VitorAinda não há avaliações
- Relatório IX - Pressão de VaporDocumento9 páginasRelatório IX - Pressão de VaporJeiel FrancisAinda não há avaliações
- DSDDSSDSDDocumento3 páginasDSDDSSDSDMAx BoscoAinda não há avaliações
- Leis Dos Gases IdeaisDocumento7 páginasLeis Dos Gases IdeaishorbiteAinda não há avaliações
- Relatório 1 de Físico-Quimica (Corr2)Documento8 páginasRelatório 1 de Físico-Quimica (Corr2)evellynsop90Ainda não há avaliações
- Exer. Resol. Propriedades TermodinamicasDocumento11 páginasExer. Resol. Propriedades TermodinamicasĘdįnęł Máriö ÅdęłšoAinda não há avaliações
- Camila Emily RafaelaDocumento9 páginasCamila Emily Rafaelaco947743Ainda não há avaliações
- Relatório 2 FQ ExpDocumento15 páginasRelatório 2 FQ ExpRenan Faria GuerraAinda não há avaliações
- Relatório 1 - Fisqu1 - FranciscoCarlosDocumento7 páginasRelatório 1 - Fisqu1 - FranciscoCarlosbrazukajr91Ainda não há avaliações
- Apostila - Práticas - quimicaII FASARDocumento12 páginasApostila - Práticas - quimicaII FASARLuciano BatistaAinda não há avaliações
- Perguntas TermodinamicaDocumento7 páginasPerguntas TermodinamicaMarisa CardosoAinda não há avaliações
- Operações Unitárias III - PsicrometriaDocumento33 páginasOperações Unitárias III - PsicrometriaNazareno BragaAinda não há avaliações
- Determinação Do Volume Molar Co2Documento10 páginasDeterminação Do Volume Molar Co2Katy AzalimAinda não há avaliações
- Relatório de Físico Química - Calor de VaporizaçãoDocumento8 páginasRelatório de Físico Química - Calor de VaporizaçãoKarine SilvaAinda não há avaliações
- Relatório Medida de PressãoDocumento6 páginasRelatório Medida de PressãoLucas CostaAinda não há avaliações
- Relatório Boyle MariotteDocumento6 páginasRelatório Boyle MariotteMário Henrique CavalcanteAinda não há avaliações
- Aula 4 - ExercíciosDocumento8 páginasAula 4 - ExercíciosFelipe BeniniAinda não há avaliações
- Operações Unitárias III - PsicrometriaDocumento33 páginasOperações Unitárias III - PsicrometriaGabrielMattosdeOliveiraAinda não há avaliações
- Lista 3Documento4 páginasLista 3ghdfgAinda não há avaliações
- Gases Ideais PDFDocumento4 páginasGases Ideais PDFDaniel FerreiraAinda não há avaliações
- YAula6 FQIDocumento35 páginasYAula6 FQIChristina CarterAinda não há avaliações
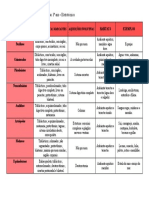
- Invertebrados: Tabela ComparativaDocumento1 páginaInvertebrados: Tabela ComparativaRebeca Maciel MoreiraAinda não há avaliações
- Lista - Equações Algébricas - AvaliativaDocumento3 páginasLista - Equações Algébricas - AvaliativaRebeca Maciel MoreiraAinda não há avaliações
- OrbitaisDocumento1 páginaOrbitaisRebeca Maciel MoreiraAinda não há avaliações
- MANUAL TCC 12a CLASSE PDFDocumento58 páginasMANUAL TCC 12a CLASSE PDFJohn Silva Silva100% (1)
- Resistência Dos Materiais IDocumento165 páginasResistência Dos Materiais Irafaelchiaradia100% (2)
- Reiki Do Raio Amarelo: Nível: Mestre Facilitadora: Patrícia AuxiliadoraDocumento33 páginasReiki Do Raio Amarelo: Nível: Mestre Facilitadora: Patrícia AuxiliadoraRoberto Júnior100% (1)
- Exercícios - Aceleração Escalar MédiaDocumento2 páginasExercícios - Aceleração Escalar MédiaLeandro MoritoAinda não há avaliações
- NR 35 Procedimento Operacional Seguranca Do Trabalho em AlturaDocumento25 páginasNR 35 Procedimento Operacional Seguranca Do Trabalho em AlturaCPSSTAinda não há avaliações
- NR 33 - Procedimento Entrada Espaço ConfinadoDocumento26 páginasNR 33 - Procedimento Entrada Espaço ConfinadoCPSSTAinda não há avaliações
- Rolamento Autocompensador de Rolos: ID Da SchaefflerDocumento2 páginasRolamento Autocompensador de Rolos: ID Da SchaefflerElder FreitasAinda não há avaliações
- TMF - 5110 (290.01.976)Documento12 páginasTMF - 5110 (290.01.976)TIAGO LAZAROAinda não há avaliações
- Matematica Poligonos Regulares v01Documento3 páginasMatematica Poligonos Regulares v01Marcela AzevedoAinda não há avaliações
- Lista Unicamp Trigonometria e Geometria PlanaDocumento13 páginasLista Unicamp Trigonometria e Geometria PlanaBruno Sozza TeixeiraAinda não há avaliações
- Relatorio Final Alpicenter 209 Bloco J - 231107 - 092745Documento10 páginasRelatorio Final Alpicenter 209 Bloco J - 231107 - 092745Samuel JunioAinda não há avaliações
- Avaliação de CIETEC - 8º Ano - I UnidadeDocumento3 páginasAvaliação de CIETEC - 8º Ano - I UnidadeETEVALDO OLIVEIRA LIMAAinda não há avaliações
- APR-AMBV-05-05-23-Analise de Risco e Declaracao de MetodoDocumento4 páginasAPR-AMBV-05-05-23-Analise de Risco e Declaracao de MetodoCristianeAinda não há avaliações
- Areia Natural Fina - CG - ATUALDocumento4 páginasAreia Natural Fina - CG - ATUALEdson Ferreira do NascimentoAinda não há avaliações
- Albarus Catalogo Cruzetas 2020Documento29 páginasAlbarus Catalogo Cruzetas 2020LEODECIO BELO DE OLIVEIRAAinda não há avaliações
- Dos-600 - 2792 CRS3252Documento2 páginasDos-600 - 2792 CRS3252Marcelo FaustinoAinda não há avaliações
- Manual Técnico SansPrayDocumento8 páginasManual Técnico SansPrayDeni VPaulaAinda não há avaliações
- 6 - Datasheet e InmetroDocumento7 páginas6 - Datasheet e Inmetroengenharia3.solarneAinda não há avaliações
- Beamlite CatalogDocumento2 páginasBeamlite CatalogBruno HugolineAinda não há avaliações
- Trabalho1 Estruturas MetalicasDocumento5 páginasTrabalho1 Estruturas MetalicasSérgio AlexAinda não há avaliações
- Capítulo III - Vibração Excitada HarmonicamenteDocumento30 páginasCapítulo III - Vibração Excitada HarmonicamenteJefferson R. MeloAinda não há avaliações
- Procedimento Retifica de Corpo de ProvaDocumento1 páginaProcedimento Retifica de Corpo de Provaemerson vinicius ferroAinda não há avaliações
- Prova Tecnico Integrado Concomitante 2019 1 10 15Documento6 páginasProva Tecnico Integrado Concomitante 2019 1 10 15Rodolfo AreiasAinda não há avaliações
- Caderno Do Estudante - MAT - 3º Ano - 2º BiDocumento9 páginasCaderno Do Estudante - MAT - 3º Ano - 2º BiESCOLA DE REFERENCIA EM ENSINO MEDIO VIRGEM DO SOCORROAinda não há avaliações
- Manual MCADocumento166 páginasManual MCAAhmadfakhroii AhmadfakroiiiAinda não há avaliações
- Atividade 2 - Análise de Sistemas de Potência - 54 2023Documento4 páginasAtividade 2 - Análise de Sistemas de Potência - 54 2023Fabio GuimaraesAinda não há avaliações
- Novas Tecnologias Analise Documental-Artigo CompletoDocumento7 páginasNovas Tecnologias Analise Documental-Artigo CompletoDavidson Leandro Silva dos SantosAinda não há avaliações
- Trabalho de AgroclimatologiaDocumento14 páginasTrabalho de AgroclimatologiaRenata SantosAinda não há avaliações
- Projeto Japonês 2024 - Material Extra (Aula 1)Documento23 páginasProjeto Japonês 2024 - Material Extra (Aula 1)jenifersaid51Ainda não há avaliações
- Oexp12 Ficha Gramatica Funcoes SintaticasDocumento3 páginasOexp12 Ficha Gramatica Funcoes SintaticasIsabel MartinsAinda não há avaliações
- O psicólogo clínico em hospitais: Contribuição para o aperfeiçoamento da arte no BrasilNo EverandO psicólogo clínico em hospitais: Contribuição para o aperfeiçoamento da arte no BrasilAinda não há avaliações
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisNo EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisNota: 4.5 de 5 estrelas4.5/5 (169)
- Inteligência artificial: Como aprendizado de máquina, robótica e automação moldaram nossa sociedadeNo EverandInteligência artificial: Como aprendizado de máquina, robótica e automação moldaram nossa sociedadeNota: 5 de 5 estrelas5/5 (3)
- Uma voz sem palavras: Como o corpo libera o trauma e restaura o bem-estarNo EverandUma voz sem palavras: Como o corpo libera o trauma e restaura o bem-estarNota: 4.5 de 5 estrelas4.5/5 (9)
- S.O.S. Autismo: Guia completo para entender o transtorno do espectro autistaNo EverandS.O.S. Autismo: Guia completo para entender o transtorno do espectro autistaNota: 4.5 de 5 estrelas4.5/5 (11)
- MANUAL INTERNACIONAL DE TRICOLOGIA AVANÇADA: Um guia completo sobre cabelo, couro cabeludo e doenças capilaresNo EverandMANUAL INTERNACIONAL DE TRICOLOGIA AVANÇADA: Um guia completo sobre cabelo, couro cabeludo e doenças capilaresNota: 4.5 de 5 estrelas4.5/5 (6)
- Dieta Anti-inflamatória EstratégicaNo EverandDieta Anti-inflamatória EstratégicaNota: 5 de 5 estrelas5/5 (2)
- Matemática na educação infantil: Reflexões e proposições a partir teoria histórico-culturalNo EverandMatemática na educação infantil: Reflexões e proposições a partir teoria histórico-culturalAinda não há avaliações
- Inteligência artificial: O guia completo para iniciantes sobre o futuro da IANo EverandInteligência artificial: O guia completo para iniciantes sobre o futuro da IANota: 5 de 5 estrelas5/5 (6)
- O Poder Energético E Curativo Das Pedras E Dos CristaisNo EverandO Poder Energético E Curativo Das Pedras E Dos CristaisAinda não há avaliações
- Introdução Às Redes De Computadores: Modelos Osi E Tcp/ipNo EverandIntrodução Às Redes De Computadores: Modelos Osi E Tcp/ipAinda não há avaliações