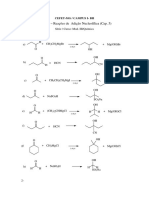
Escolar Documentos
Profissional Documentos
Cultura Documentos
Tabela de Ânions
Enviado por
Renan Braga GonçalvesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Tabela de Ânions
Enviado por
Renan Braga GonçalvesDireitos autorais:
Formatos disponíveis
Tabela de ions e nomenclatura
Química
1 pag.
Document shared on www.docsity.com
Downloaded by: Renanbg04 (renan_braga93@hotmail.com)
TABELA DE ÂNIONS TABELA DE CÁTIONS PRINCIPAIS OXIDANTES REGRAS DE SOLUBILIDADE GEOMETRIA MOLECULAR
HALOGÊNIOS - - -
MONOVALENTES + Todos os sais contendo os ânions NO3 , ClO3 , ClO4
F
-
Fluoreto K2Cr2O7 H K2O + Cr2O3 + 3 [O] Tipo de
- -
e C2H3O2 são solúveis; (AgC2H3O2 e KClO4 são Forma Hibridização
Cl Cloreto Li
+
Lítio Molécula
Br
-
Brometo + 2KMnO4 H +
K2O + 2MnO + 5 [O] pouco solúveis); Geométrica Associada
-
Na Sódio ou Íon
I Iodeto K
+
Potássio
- OH-
ClO Hipoclorito +
ClO2 -
Clorito
Rb
Cs
+
Rubídio
Césio
2KMnO4 K2O + 2MnO2 + 3 [O] Todos os sais de metais alcalinos e de Amônio são
solúveis; AX2 Linear
sp
ClO3 - Clorato Fr+ Frâncio 2HNO3 (dil) → H2O + 2NO + 3 [O]
- +
ClO4 Perclorato Ag Prata
+ 2HNO3 (conc.) → H2O + 2NO2 + [O] Todos os cloretos, brometos e iodetos são solúveis
BrO - Hipobromito Cu Cobre
exceto os de Ag+, Hg22+ Pb2+.
BrO3
-
Bromato Au
+
Ouro HNO3 + H2O (dil.) → NH3 + 4[O] AX3 Triangular
+
IO - NH4 Amônio
IO3
-
Hipoiodito
Iodato H2SO4 (conc.) → H2O + SO2 + [O] Todos os sulfatos são solúveis, exceto os de PB2+, sp2
IO4 - Periodato Sr2+ e Ba2+. Os de Ca2+ e Ag+ são pouco solúveis.
BIVALENTES H2O2 → H2O + [O] Angular
AX2E (curva)
CARBONO 2+ O3 → O2 + [O]
CN - Cianeto Be Berílio Todos os sulfetos, sulfitos, carbonatos e fosfatos são
CNO - Cianato Mg2+ Magnésio MnO2 → MnO + [O] insolúveis, exceto os de metais alcalinos e amônio.
2+
CNS - Ca Cálcio
Tiocianato
Sr
2+
Estrôncio KClO3 → KCl + 3[O] AX4 Tetraédrica
C2H3O2 - Acetato 2+
Todos os hidróxidos são insolúveis, exceto os de
CO3 2- Carbonato Ba Bário metais alcalinos, Sr2+ e Ba2+. O Ca(OH)2 é pouco
2+ NaClO → NaCl + [O]
HCO
-
Formiato Ra Rádio solúvel,
C2O4
2-
Oxalato Zn
2+
Cd2+
Zinco
Cádmio
NaNO3 → NaNO2 + [O]
AX3E Piramidal sp3
[Fe(CN)6 ] 3- Ferricianeto
Cu2+ Cobre II (cúprico) NaClO3 → NaCl + 3[O] Todos os óxidos metálicos são insolúveis, exceto os
[Fe(CN)6 ] 4- Ferrocianeto
Hg
2+
Mercúrio II(mercúrico) dos metais alcalinos e de Ca2+, Sr2+ e Ba2+.
C 4- Carbeto / Metaneto HClO → HCl + [O]
2- Fe
2+
Ferro II (ferroso) Angular
C2 Carbeto / Acetileto
Co2+ Cobalto II (cobaltoso) 2Na3BiO4 → 3Na2O + Bi2O3 + 2[O] AX2E2 (curva)
Ni2+ Níquel II (niqueloso)
GRAUS DE IONIZAÇÃO
NITROGÊNIO
PbO2 → PbO + [O]
Cr2+ Cromo II (cromoso)
NO2 - Nitrito Alto grau de ionização: Ácidos fortes
NO3 -
Mn2+ Manganês II (manganoso) Bipiramidal
Nitrato
Sn2+ Estanho II (estanoso)
Observações: HI 95% AX5 trigonal
N3 - Azoteto / Azida HBr 93,5%
Pb2+ Chumbo II (plumboso) 1. H2SO4 só é oxidante quando não há outro
N 3- Nitreto HCl 92%
Ti2+ Titânio II ( titanoso) oxidante, e mesmo assim, somente concentrado e HNO3 92%
Pt2+ Platina II (platinoso) quente. Tetraédrica
FÓSFORO H2SO4 61%
-
AX4E irregular
PO3 Metafosfato 2. H2O2 pode ser oxidante ou redutor: só será
(gangorra)
H2PO2 -
2-
Hipofosfito TRIVALENTES
oxidante se não houver outro oxidante.
Moderado grau de ionização: Ácidos semifortes
H2C2O4 50% sp3d
HPO3 Fosfito H2SO3 30 %
PO4 3- Al3+
PRINCIPAIS REDUTORES
Ortofosfato Alumínio H3PO4
HF
27%
8,5%
AX3E2 Forma de T
P 3- Fosfeto Bi3+ Bismuto H2O2 + [O] → H2O + O2
P2O7 4- Pirofosfato Au3+ Ouro III (áurico)
Baixo grau de ionização: Ácidos fracos
P2O 4- Hipofosfato Fe3+ Ferro III (férrico) H2S + [O] → H2O + S
H4C2O2 1,34 %
Co3+ Cobalto III (cobáltico) H2CO3 0,18 % AX2E3 Linear
ENXOFRE H2SO3 + [O] → H2SO4
Ni3+ Níquel III (niquélico) H2S 0,076%
S 2- Sulfeto Cr3+ Cromo III (crômico) SO2 + [O] → SO3 H3BO3 0,075%
SO4 2- Sulfato HCN 0,008 %
SO3 2- 2HX + [O] → H2O + X2
Sulfito AX6 Octaédrica
S2O3 2- Tiossulfato
TETRAVALENTES 2MeX + [O] → Me2O + X2 GASES PARCIALMENTE SOLÚVEIS
S2O4 2- Hipossulfito
S2O8 2- Persulfato Sn4+ Estanho IV (estânico) x Me + y [O] → MexOy EM ÁGUA Piramidal
S4O6 2- Tetrationato Pb4+ Chumbo IV (plúmbico)
H2C2O4 + [O]→ H2O + 2CO2 Por decomposição:
AX5E de base sp3d2
Ti4+ Titânio IV (titânico) quadrada
OUTROS ÂNIONS
Pt4+ Platina IV (platínico) (MeAlc)2C2O4 + [O] → (MeAlc)2O + 2CO2 CO2 ( H2CO3 → CO2 + H2O )
MnO4 - Permanganato
Mn4+ Manganês IV (mangânico) Quadrado-
MnO4 2- 2FeSO4 + [O] + H2SO4 → Fe2(SO4)3+ H2O
Manganato SO2 ( H2SO3 → SO2 + H2O ) AX4E2 planar
MnO3 2- Manganito
PbCl2 + [O] + 2 HCl → PbCl4 + H2O NH3 ( NH4OH → NH3 + H2O )
OH - Hidróxido
H- Hidreto SnCl2 + [O] + 2 HCl → SnCl4 + H2O
NO e NO2 ( 2HNO2 → NO + NO2 + H2O ) EEL - USP
O 2- Óxido
HNO2 + [O] → HNO3 Escola de Engenharia de Lorena
CrO4 2- Cromato Por formação direta: H2S Estrada Municipal do Campinho, s/n
Cr2O7 2- Dicromato LEGENDA: X – Halogênio 12602-810 - Lorena - SP
AsO3 3- Arsenito Me – Metal Tel. (12) 31.59.50.00
AsO4 3- Arsenato MeAlc – Metal Alcalino
BO3 3- Borato
B4O7 2- Tetraborato
Document shared on www.docsity.com
Downloaded by: Renanbg04 (renan_braga93@hotmail.com)
Você também pode gostar
- Óxidos: propriedades e reaçõesDocumento38 páginasÓxidos: propriedades e reaçõesjparatyAinda não há avaliações
- Estudo Dirigido - NomenclaturaDocumento5 páginasEstudo Dirigido - NomenclaturaCamila GuenkaAinda não há avaliações
- Oficina Lauro SodreDocumento28 páginasOficina Lauro Sodreneyzanata5043Ainda não há avaliações
- Apostila Adubos e AdubaçãoDocumento88 páginasApostila Adubos e AdubaçãoRafael_A_Swaro_810580% (5)
- Tabela Dos IonsDocumento1 páginaTabela Dos IonsMatheus AlvesAinda não há avaliações
- Tabela de AnionsDocumento1 páginaTabela de AnionsdetonatomAinda não há avaliações
- Livro - Gerenciamento e Controle de Poluicao Da Agua e Do SoloDocumento29 páginasLivro - Gerenciamento e Controle de Poluicao Da Agua e Do SoloLuciano SáAinda não há avaliações
- Tabela IõesDocumento1 páginaTabela IõesAnna CostaAinda não há avaliações
- Fórmulas químicas e estruturas iônicasDocumento7 páginasFórmulas químicas e estruturas iônicasClauciane Dias de LimaAinda não há avaliações
- Íons e radicais químicos mais comunsDocumento8 páginasÍons e radicais químicos mais comunsRBWellingtonAinda não há avaliações
- Acidez Do Solo e CalagemDocumento42 páginasAcidez Do Solo e CalagemWanessa AmaralAinda não há avaliações
- Corrosão: Causas, Tipos e PrevençãoDocumento82 páginasCorrosão: Causas, Tipos e PrevençãoPatrick SpencerAinda não há avaliações
- Funções Inorgânicas IiDocumento8 páginasFunções Inorgânicas IiRayanne SilvaAinda não há avaliações
- N C N C: Scola Ecundária Da AmadaDocumento1 páginaN C N C: Scola Ecundária Da Amadamarina lopesAinda não há avaliações
- Tabela de IoesDocumento3 páginasTabela de IoesFlávia SousaAinda não há avaliações
- 05 V2 - Colunas - Ficha - de - Apontamentos - 11a - ClasseDocumento25 páginas05 V2 - Colunas - Ficha - de - Apontamentos - 11a - ClasseJoao Dique Maguichire PkayAinda não há avaliações
- TRAB InorganicaDocumento15 páginasTRAB Inorganicabacar luis bacarAinda não há avaliações
- Nomenclatura de sais inorgânicosDocumento9 páginasNomenclatura de sais inorgânicosHugo AraujoAinda não há avaliações
- Química I - Funções InorgânicasDocumento4 páginasQuímica I - Funções InorgânicasVanessa VieiraAinda não há avaliações
- ProvaDocumento1 páginaProvabotinha fodaAinda não há avaliações
- Tabela de ânions e cátionsDocumento3 páginasTabela de ânions e cátionsVitor SantosAinda não há avaliações
- Mod 07 Aula 07Documento32 páginasMod 07 Aula 07Mariana SoutoAinda não há avaliações
- Resoluções: QuímicaDocumento4 páginasResoluções: Químicaasla ִֶָ 'Ainda não há avaliações
- Aula - 3 PMT3130 2017 NeivaDocumento21 páginasAula - 3 PMT3130 2017 NeivaKalipse FerreiraAinda não há avaliações
- 00 - QA - Flow ChartsDocumento11 páginas00 - QA - Flow Chartsbansal.nik074Ainda não há avaliações
- Reações de óxido-redução em processos industriaisDocumento7 páginasReações de óxido-redução em processos industriaiscsgbb9031Ainda não há avaliações
- RespostasDocumento7 páginasRespostasbaraunagabrielly40Ainda não há avaliações
- Ácidos e BasesDocumento2 páginasÁcidos e Basesrosimeri.batistaAinda não há avaliações
- Funções Químicas InorgânicasDocumento26 páginasFunções Químicas InorgânicasSandro Natal DanielAinda não há avaliações
- Reações Químicas e Estequiometria QFL0130 2020Documento57 páginasReações Químicas e Estequiometria QFL0130 2020Luthi Gama CavalcanteAinda não há avaliações
- Tabela de Íons 2019 Final para ImpressãoDocumento3 páginasTabela de Íons 2019 Final para ImpressãoMaria Eduarda Medeiros de PaulaAinda não há avaliações
- Ânions e CátionsDocumento6 páginasÂnions e Cátionsfabio angelicoAinda não há avaliações
- Tabela Anios Ios CationsDocumento1 páginaTabela Anios Ios CationsJesiel Vieira LinoAinda não há avaliações
- Número de Oxidação - NoxDocumento2 páginasNúmero de Oxidação - NoxJuliane Froncheti de MouraAinda não há avaliações
- Análise GravimétricaDocumento14 páginasAnálise GravimétricaCesarAinda não há avaliações
- Algumas Reacoes Aldeidos CetonasDocumento3 páginasAlgumas Reacoes Aldeidos CetonasGabriel PinheiroAinda não há avaliações
- Fluxograma Anions - P7Documento1 páginaFluxograma Anions - P7hua lianAinda não há avaliações
- Número de OxidaçãoDocumento5 páginasNúmero de OxidaçãopmarcelopontesAinda não há avaliações
- Relatório de Analise Do Grupo Da PrataDocumento7 páginasRelatório de Analise Do Grupo Da PrataHeliane SerraoAinda não há avaliações
- Balanceamento de reações redox por método das tentativasDocumento2 páginasBalanceamento de reações redox por método das tentativasrachelsamilly12100% (1)
- Óxidos na Química 9a ClasseDocumento2 páginasÓxidos na Química 9a ClasseBenedito100% (1)
- Tabel AsamDocumento3 páginasTabel AsamFatih UmiariskyAinda não há avaliações
- Preparação e propriedades do H2, O2 e H2O2Documento10 páginasPreparação e propriedades do H2, O2 e H2O2Isabele DuarteAinda não há avaliações
- Preparação e propriedades do H2, O2 e H2O2Documento10 páginasPreparação e propriedades do H2, O2 e H2O2Isabele DuarteAinda não há avaliações
- Aula 9 - Metais - AluminotermiaDocumento70 páginasAula 9 - Metais - AluminotermiaJulio Magalhaes de FreitasAinda não há avaliações
- Sais e ÓxidosDocumento12 páginasSais e ÓxidosPatricia LindenAinda não há avaliações
- QualitativaDocumento12 páginasQualitativaGLALSON TEMOTEO PEREIRAAinda não há avaliações
- Aula Formulas Mol FMUDocumento34 páginasAula Formulas Mol FMUmauoscuroAinda não há avaliações
- Fertilidade do solo e ciclagem de nutrientes UNESP 2017Documento172 páginasFertilidade do solo e ciclagem de nutrientes UNESP 2017Leyser R. OliveiraAinda não há avaliações
- Análise de água de alimentaçãoDocumento1 páginaAnálise de água de alimentaçãoEverton VolpatoAinda não há avaliações
- Processo de Ostwald para produção de ácido nítricoDocumento3 páginasProcesso de Ostwald para produção de ácido nítricobispojjosAinda não há avaliações
- Química - Pré-Vestibular Impacto - Bases - Classificação e Nomenclatura IIDocumento2 páginasQuímica - Pré-Vestibular Impacto - Bases - Classificação e Nomenclatura IIQuímica Qui100% (2)
- Reações de adição nucleofílica CEFET-MGDocumento3 páginasReações de adição nucleofílica CEFET-MGlucas henriqueAinda não há avaliações
- Capitulo Vi.2019Documento16 páginasCapitulo Vi.2019José RiadroAinda não há avaliações
- Tabela de química inorgânicaDocumento7 páginasTabela de química inorgânicarpovilsAinda não há avaliações
- Tabela de Cations e AnionsDocumento1 páginaTabela de Cations e AnionsFabio de AbreuAinda não há avaliações
- Funções Inorgânicas: Ácidos, Bases, Sais e ÓxidosDocumento62 páginasFunções Inorgânicas: Ácidos, Bases, Sais e ÓxidosJose NevesAinda não há avaliações
- Equilíbrio de Precipitação QAG1 20212022Documento12 páginasEquilíbrio de Precipitação QAG1 20212022JULIANE CAMILE DE JESUS NOGUEIRA AVILAAinda não há avaliações
- Tabela IónicaDocumento2 páginasTabela IónicaIsaneth ManuelAinda não há avaliações
- Instalação de Filetes MetálicosDocumento16 páginasInstalação de Filetes MetálicosValdir KoxinhaprAinda não há avaliações
- Talco: propriedades, usos e produção brasileiraDocumento36 páginasTalco: propriedades, usos e produção brasileiraSamuel CamposAinda não há avaliações
- Check List de Limpeza e LubrificaçãoDocumento11 páginasCheck List de Limpeza e LubrificaçãoPedro PyrroAinda não há avaliações
- Workshop soldagem segurança chapisco moendasDocumento37 páginasWorkshop soldagem segurança chapisco moendasRicardo Guilherme FreitasAinda não há avaliações
- Argamil MultiusoDocumento2 páginasArgamil MultiusoPedro Paulo de OliveiraAinda não há avaliações
- Barramento Eletrico Blindado P40Documento25 páginasBarramento Eletrico Blindado P40Mauro MiguelAinda não há avaliações
- 01 Classes de Metais DurosDocumento1 página01 Classes de Metais DurosGuilherme AugustoAinda não há avaliações
- ProfessorAutor/Ciências/Ciências I 9º Ano I Fundamental/Ligações QuímicasDocumento29 páginasProfessorAutor/Ciências/Ciências I 9º Ano I Fundamental/Ligações QuímicaspamellassAinda não há avaliações
- CRH Lista 1Documento2 páginasCRH Lista 1Dan DanAinda não há avaliações
- Controle de nível bóia eletromagnéticaDocumento1 páginaControle de nível bóia eletromagnéticaEverton Santos100% (1)
- Mapa Mental ArgamassaDocumento5 páginasMapa Mental ArgamassaSuelen C. LimaAinda não há avaliações
- Cálculos Estequiométricos (Nota de Aula e Exercícios)Documento6 páginasCálculos Estequiométricos (Nota de Aula e Exercícios)Sidney ChristAinda não há avaliações
- Celulose e PapelDocumento32 páginasCelulose e PapelDouglas Liberace de MatosAinda não há avaliações
- Ficha Técnica 13 - Jato Plus - Rev07Documento3 páginasFicha Técnica 13 - Jato Plus - Rev07FABIO LUIS PEREIRA FRANCOAinda não há avaliações
- Lista de Exercícios de Soluções PDFDocumento1 páginaLista de Exercícios de Soluções PDFAnonymous ouzYGW8yAinda não há avaliações
- Ficha TECSOL - ANTI RAIZESDocumento2 páginasFicha TECSOL - ANTI RAIZESFausto RosaAinda não há avaliações
- Teorias de Ácidos e BasesDocumento4 páginasTeorias de Ácidos e BasesJoanna SouzaAinda não há avaliações
- Processos de usinagem, tratamentos térmicos e superficiais para aços e inoxDocumento5 páginasProcessos de usinagem, tratamentos térmicos e superficiais para aços e inoxLuis FornazieroAinda não há avaliações
- Classes Dos MineraisDocumento10 páginasClasses Dos MineraisJose AbrantesAinda não há avaliações
- Dissertação - Sandra Kurotusch de Melo - 2010 PDFDocumento136 páginasDissertação - Sandra Kurotusch de Melo - 2010 PDFYane CoutinhoAinda não há avaliações
- Lista de Exercícios - Mol, Massa Molar, Número de AvogadroDocumento3 páginasLista de Exercícios - Mol, Massa Molar, Número de AvogadroAndré Mauricio De OliveiraAinda não há avaliações
- GuiaGGDMetals Aluminios PDFDocumento13 páginasGuiaGGDMetals Aluminios PDFAdalberto G MirandaAinda não há avaliações
- Ficha Técnica - Abobadilha EPS S (D.10) 2Documento2 páginasFicha Técnica - Abobadilha EPS S (D.10) 2David Alexandre Reis FerreiraAinda não há avaliações
- Atividade Sobre LIGAÇÕES QUIMICASDocumento2 páginasAtividade Sobre LIGAÇÕES QUIMICASLAECIO CARLOSAinda não há avaliações
- Atividade avaliativa de químicaDocumento3 páginasAtividade avaliativa de químicarodrigo barretoAinda não há avaliações
- O Incêndio Começa Onde A Prevenção FalhaDocumento8 páginasO Incêndio Começa Onde A Prevenção FalhaSymonninhaaAinda não há avaliações
- Fibras têxteis: origens e classificaçãoDocumento27 páginasFibras têxteis: origens e classificaçãoHelfilcopeAinda não há avaliações