Escolar Documentos
Profissional Documentos
Cultura Documentos
Soluções
Enviado por
Júlio MontanhaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Soluções
Enviado por
Júlio MontanhaDireitos autorais:
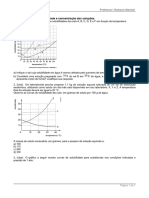
Formatos disponíveis
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
1.(CESGRANRIO) Considere o quadro a seguir:
Logo, podemos afirmar que:
a) A = solução verdadeira; B = suspensão; C = solução coloidal.
b) A = suspensão; B = solução coloidal; C = solução verdadeira.
c) A = solução coloidal; B = solução verdadeira; C = suspensão.
d) A = solução coloidal; B = suspensão; C = solução verdadeira.
e) A = solução verdadeira; B = solução coloidal; C = suspensão.
2.A popular maionese caseira é formada pela mistura de óleo, limão (ou
vinagre) e gema de ovo; este último componente tem a função de estabilizar a
referida mistura. Esta mistura é um exemplo de:
a) solução verdadeira concentrada;
b) solução verdadeira diluída;
c) uma dispersão coloidal do tipo gel;
d) uma dispersão coloidal do tipo emulsão;
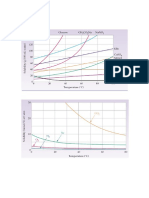
e) um gel que sofreu uma peptização.
3. Qual das misturas abaixo exemplifica uma dispersão coloidal?
a) Soro fisiológico. d) Água sanitária.
b) Ácido muriático. e) Álcool hidratado.
c) Leite pasteurizado.
1 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
4. Alguns medicamentos trazem no rótulo “agite antes de usar”. Esse
procedimento é necessário se o medicamento for uma:
a) mistura homogênea. b) suspensão.
c) solução. d) dispersão coloidal.
5. Dentre os seguintes materiais:
I. maionese; II. iogurte; III. azeite de oliva;
IV. refrigerante.
Podem ser classificados como dispersões coloidais:
a) I e II b) I e III c) II e III d) II e IV e) III e IV
6. Uma mistura homogênea, que não pode ser separada por filtração,
centrifugação, nem pode ser visualizada, se trata de uma:
a) suspensão b) solução coloidal
c) solução verdadeira d) solução e coloide
e) suspensão ou coloide
7. Classifique cada um dos sistemas abaixo em; suspensão, coloide ou
solução.
2 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
8. (UnB-DF) Julgue os itens a seguir.
(1) Se a luz do farol de uma embarcação que navega pelo oceano no período
noturno atravessa um aerossol marinho, haverá a possibilidade de se observar
o efeito óptico de dispersão da luz pelas partículas que compõem o referido
aerossol, denominado efeito Tyndall.
(2) Os colóides do solo, materiais constituídos por uma fase sólida, podem ser
classificados, quando vistos a olho nu, como materiais homogêneos e são
capazes de provocar o efeito Tyndall.
(3) Do ponto de vista químico, o sangue pode ser corretamente classificado
como uma solução e, para ser analisado de acordo com o procedimento
descrito no texto, a ele devem ser adicionados outros componentes químicos.
9.(UNICID-SP) O gás butano é utilizado como propelente em desodorantes e
em cremes de barbear. O rótulo de um creme de barbear indica a composição
de 4% em massa de butano numa embalagem de 145 g de produto.
Considere as seguintes afirmações sobre as características da espuma do
creme de barbear:
I. é um colóide;
II. pode ser classificada como suspensão;
III. a fase dispersa é um gás;
IV. os seus componentes não sofrem sedimentação.
Está correto o contido em
a) I, II, III e IV. b) I, II e III, apenas.
c) I, II e IV, apenas. d) I, III e IV, apenas.
e) II, III e IV, apenas.
3 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
10.(ITA-SP) Considere os sistemas apresentados a seguir:
I. Creme de leite. II. Maionese comercial.
III. Óleo de soja. IV. Gasolina.
V. Poliestireno expandido (Isopor).
Destes, são classificados como sistemas coloidais:
a) apenas I e II. b) apenas I, II e III. c) apenas II e V.
d) apenas I, II e V. e) apenas III e IV.
11.(UFF-RJ) São dadas as soluções:
- argônio dissolvido em nitrogênio;
- dióxido de carbono dissolvido em água;
- etanol dissolvido em acetona;
- mercúrio dissolvido em ouro.
Estas soluções, à temperatura ambiente, são classificadas de acordo com seu
estado físico em, respectivamente:
a) líquida, líquida, gasosa, líquida b) gasosa, gasosa, líquida, sólida
c) líquida, gasosa, líquida, líquida d) gasosa, líquida, líquida, sólida
e) líquida, gasosa, líquida, sólida
12. Em relação às soluções verdadeiras é correto afirmar que:
a) as partículas dispersas sofrem sedimentação por meio de ultra centrífugas.
b) as partículas dispersas são separadas do dispersante por meio de filtros
comuns.
c) as partículas dispersas são visíveis ao ultramicroscópio.
d) constituem sistema heterogêneo.
e) suas partículas dispersas são, em média, menores que 10 Angstrom.
4 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
13. Sabendo que a solubilidade do brometo de potássio, KBr, a 60° C é 85,5
g/100 g de H2O, calcule a massa de água necessária para dissolver 780 g de
KBr 60° C.
14. O coeficiente de solubilidade de um sal é de 60 g por 100 g de água a 80º
C. Qual a massa desse sal, nessa temperatura, para saturar 80 g de H2O?
15. Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de
MgCℓ2 de concentração 8,0 g/L. Quantos gramas de MgCℓ2 são obtidos?
16. Observe os dados fornecidos a seguir, onde a solubilidade em agua e dada
em gramas de soluto por 100 gramas do solvente, em duas temperaturas
diferentes.
Analisando a tabela, responda ao que se pede.
a) Qual a massa de solvente necessária para solubilizar 122 g de sulfato de
sódio, a uma temperatura de 40 ºC ?
b) Qual a massa do soluto, em gramas, de uma solução de clorato de potássio
que contem 250 mL do solvente, a uma temperatura de 60 ºC ?
17. Quatro tubos contêm 20 mL de água cada um. Coloca-se nesses tubos
dicromato de potássio nas seguintes quantidades: A solubilidade do sal, a
20ºC, é igual a 12,5g por 100 mL de água. Após agitação, em quais dos tubos
coexistem, nessa temperatura, solução saturada e fase sólida?
a) em nenhum. b) apenas em D. c) apenas em C e D.
d) apenas em B, C e D. e) em todos.
5 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
18. Colocando-se 400g de cloreto de sódio (NaCℓ) em 1 litro de água pura, à
temperatura de 25°C, podemos afirmar que: Dado: CS = 360g de NaCℓ/L de
água, a 25°C.
a) O sal se dissolve totalmente. b) O sal não se dissolve.
c) Parte do sal se dissolve e o excesso se deposita, formando uma solução
saturada.
d) O cloreto de sódio, a 25°C, é insolúvel.
e) Precisaríamos de 200g de cloreto de sódio a mais para que ele se
dissolvesse totalmente.
19. Tem-se 540g de uma solução aquosa de sacarose (C12H22O11), saturada,
sem corpo de fundo, a 50°C. Qual a massa de cristais que se separam da
solução, quando ela é resfriada até 30°C? Cs = 220g/100g de água a 30°C;
Cs = 260g/100g de água a 50°C.
a) 20g. b) 30g. c) 40g. d) 50g. e) 60g.
20.(Sigma) O coeficiente de solubilidade pode ser definido como sendo a
quantidade máxima de um soluto capaz de ser dissolvida por uma
determinada quantidade de solvente, sob determinadas condições de
temperatura e pressão. Sabendo-se, então, que o coeficiente de solubilidade
do K2Cr2O7 é de 12,0 gramas em 100 mL de água à T=20°C, que tipo de
sistema será formado quando forem adicionadas 120 gramas de K2Cr2O7 em
600 mL de água à T=20°C ?
a) Um sistema heterogêneo, com 48 gramas de K2Cr2O7 como precipitado
(corpo de fundo).
b) Um sistema homogêneo, com 48 gramas de K2Cr2O7 dissolvidas
completamente.
c) Uma solução insaturada.
d) Um sistema heterogêneo, saturado, com volume final igual a 820 mL.
e) Um sistema homogêneo onde 120 gramas de K2Cr2O7 foram
completamente dissolvidas.
6 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
21.(UNB-DF) Com base nos dados fornecidos a seguir, em que a solubilidade
é dada em gramas do soluto/100 g de H2O e a pressão é 1 atm.
Julgue os itens abaixo (verdadeiro ou falso).
(1) Um decréscimo de temperatura favorece a solubilização de Li 2CO3 e O2.
(2) A solução resultante da adição de 200 g de AgNO3 e 100 g de água, a
20°C será saturada.
(3) Resfriando-se, com agitação, a solução do item 2 até a temperatura de
10°C haverá precipitação de 30 g de soluto.
(4) A uma dada temperatura, a solubilização do oxigênio, em água, poderá ser
aumentada com o aumento de pressão.
(5) A 10°C, uma solução saturada de Li2CO3 conduzirá melhor a corrente
elétrica que uma solução saturada de AgNO3, à mesma temperatura.
(6) A 20 °C, a pressão de 1 atm, a quantidade em mols de O2 que satura um
litro de água (d = 1 g/cm3) é 1,25 . 10–1. Dado: O = 16 g/mol
22.
7 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
23. Considere a tabela
de solubilidade de
quatro substâncias a
duas temperaturas
diferentes: Considere a
tabela de solubilidade
de quatro substâncias a
duas temperaturas diferentes:
Julgue os itens que se seguem.
(1) Uma solução preparada pela adição de 34g de cloreto de potássio em 100g
de água será saturada a 20°C.
(2) A adição de 90g de NaNO3, sob agitação, a 100g de água a 50°C
produzirá uma solução saturada. Caso esta solução seja resfriada até 20°C, ela
continuará sendo saturada, porém com corpo de fundo.
(3) A sacarose, bem como qualquer soluto, tem a sua solubilidade aumentada
com o aumento da temperatura.
(4) A 50°C, a solubilidade do cloreto de potássio é igual a 460g em 1kg de
água.
(5) Duas soluções saturadas a 50°C de cloreto de sódio (M= 58,5 g/mol), e de
cloreto de potássio (M = 74,5 g/mol) apresentam mesma concentração em
quantidade de matéria (mol/L), aproximadamente.
24. Sabe-se que o coeficiente de solubilidade de um sal, a 25 ºC, é
38,6 g/100 g de H2O. Nessa temperatura, foram adicionados 118 g desse sal
em 300 g de água. Em relação a este sistema responda aos itens a seguir.
a) O sistema formado é uma solução ou um sistema heterogêneo ? Mostre,
por meio de cálculos matemáticos, a razão de sua resposta.
b) Caso o sistema encontrado no item anterior seja uma solução insaturada,
determine a massa de soluto que deve ser adicionada a ele para que tenhamos
saturação da solução. Caso o sistema encontrado no item anterior seja um
sistema heterogêneo, determine a massa de água necessária para transformá-
lo em uma solução saturada.
8 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
25. A dissolução de uma quantidade fixa de um composto inorgânico depende
de fatores tais como temperatura e tipo de solvente. Analisando a tabela de
solubilidade do sulfato de potássio (K2SO4) em 100g de H2O abaixo, analise
os itens que se seguem.
I) Trata-se de uma dissolução exotérmica.
II) Quando 236g de uma solução saturada, a 80°C, for devidamente resfriada
até atingir a temperatura de 20°C, a porcentagem em massa do sal K2SO4 que
precipita não ultrapassa 40%.
III) A solução saturada de K2SO4 a 20°C, ao ser aquecida a 40°C, torna-se
supersaturada.
IV) 25g de água a 80°C dissolve menor número de partículas de K2SO4 que
em 50g de água a 20°C.
São corretos:
a) apenas I e II. b) apenas II e IV. c) apenas II.
d) apenas III. e) apenas IV.
26. A 150 g de água adicionamos 40 g de um soluto B. Após agitação,
observa-se um corpo de fundo no recipiente. Filtra-se o sistema obtendo-se
12,3 g de um sólido. Determine o coeficiente de solubilidade desse soluto na
temperatura do experimento, em g/100 g de água.
27. Considere que o coeficiente de solubilidade de um soluto A é de
2,74 g/100 g de H2O a 25 ºC. Determine a massa de água necessária para que
obtenhamos uma solução saturada que contenha 124,6 g desse soluto.
9 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
28.(UFRRJ/99) Observe o gráfico a seguir e responda às questões que se
seguem
a) Qual a menor quantidade de água necessária para dissolver completamente,
a 60°C, 120g de B?
b) Qual a massa de A necessária para preparar, a 0°C, com 100g de água, uma
solução saturada (I) e outra solução insaturada (II)?
29.(Puccamp) Considere o gráfico, representativo da curva de solubilidade do
ácido bórico em água
Adicionando-se 200g de H3BO3 em 1,00kg de água, a 20°C, quantos gramas
do ácido restam na fase sólida?
10 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
30. Dado o gráfico de solubilidade abaixo:
Julgue os itens abaixo corretos ou incorretos e justifique a sua resposta.
(1) A substância mais solúvel em água a 10 ºC é o KNO3.
(2) A substância que apresenta menor variação de solubilidade entre 30 ºC e
80 ºC é o NaCℓ.
(3) A solubilidade de qualquer soluto sólido aumenta com a elevação de
temperatura da solução.
(4) A mistura de 20 g de KCℓ em 100 g de água a 50 ºC resultará em uma
solução insaturada.
(5) Um sistema preparado com 80 g de KNO3 em 100 g de água a 40 ºC
apresentará um corpo de fundo.
11 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
31.(U. Santa Úrsula-RJ) No
gráfico, os pontos assinalados
representam soluções de um
mesmo soluto. De sua análise,
pode-se afirmar que as soluções
saturadas com presença de
precipitado são:
a) A, B, C e D b) E e F
c) H e G d) E e H
e) G e F
32. O gráfico a seguir mostra curvas de solubilidade para substâncias nas
condições indicadas e pressão de 1 atm.
A interpretação dos dados
desse gráfico permite afirmar
CORRETAMENTE que
a) compostos iônicos são
insolúveis em água, na
temperatura de 0ºC.
b) o cloreto de sódio é pouco
solúvel em água à medida que
a temperatura aumenta.
c) sais diferentes podem
apresentar a mesma
solubilidade em uma dada
temperatura.
d) a solubilidade de um sal depende, principalmente, da espécie catiônica
presente no composto.
e) a solubilidade do cloreto de sódio é menor que a dos outros sais para
qualquer temperatura.
12 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
33. No gráfico abaixo, apresentamos a curva de solubilidade do nitrato de
potássio, KNO3, em função da variação da temperatura, expressa em gramas
de solubilidade do KNO3, por 100 g de água.
Em relação ao gráfico, foram feitas as seguintes afirmações:
I. Ao dissolvermos 60 g deste sal em água a 25 ºC, teremos uma solução
insaturada.
II. Ao resfriarmos a solução saturada de 70 ºC a 40 ºC, ocorrerá a precipitação
de 30 g do sal.
III. Ao aquecermos a solução saturada de 10 ºC a 40 ºC, a massa do sal
presente na solução será de 30 g.
IV. Ao dissolvermos 10 g deste sal em água a 25 ºC, teremos uma solução
supersaturada.
V. Ao resfriarmos uma solução saturada de 70 ºC a 40 ºC, a massa do sal que
permanece dissolvido na solução será de 60g.
São corretas as afirmações:
a) I apenas. b) V apenas. c) I, V e IV.
d) II e III apenas. e) I, II, III e IV.
13 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
34. NaCℓ e KCℓ são sólidos brancos
cuja solubilidade em água, a diferentes
temperaturas, é dada pelo gráfico
abaixo. Para distinguir os ais, três
procedimentos foram sugeridos:
I. Colocar num recipiente 2,5 g de um
dos sais e 10,0 mℓ de água e, em outro
recipiente, 2,5 g do outro sal e 10,0 mℓ
de água. Agitar e manter à temperatura de 10 ºC.
II. Colocar num recipiente 3,6 g de uma dos sais e 10,0 mℓ de água e, em
outro recipiente, 3,6 g do outro sal e 10,0 mℓ de água. Agitar e manter à
temperatura de 28 °C.
III. Colocar num recipiente 3,8 g de um dos sais e 10,0 mℓ de água e, em
outro recipiente, 3,8 g do outro sal e 10,0 mℓ de água. Agitar e manter à
temperatura de 45 ºC.
Quando dos procedimentos você considera o mais adequado para distinguir
esses dois sais ? Justifique sua escolha demonstrando os cálculos.
35. Considerando as curvas de
solubilidade dos sais apresentadas
abaixo, determine qual sal apresenta
uma menor sensibilidade na variação
de seu coeficiente de solubilidade, em
função da temperatura, considerando
o intervalo 20 ºC a 80 ºC ?
14 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
36. Sabendo que a densidade absoluta do ferro é de 7,8 g/cm 3 , determine a
massa de uma chapa de ferro de volume igual a 650 cm 3.
37. A densidade absoluta da gasolina é de 0,7 g/ cm 3 . Qual o volume
ocupado por 420 g de gasolina?
38. Calcular a densidade do mercúrio, sabendo que 1360 gramas ocupam o
volume de 100 cm3 .
39. Um béquer contendo 400 cm3 de um líquido com densidade de 1,85 g/
cm3 pesou 884 g. Qual a massa do béquer vazio?
40. Quando se deixa cair uma peça de metal com massa igual a 112,32 g em
um cilindro graduado (proveta) que contém 23,45 mL de água, o nível sobe
para 29,27 mL. Qual a densidade do metal, em g/ cm 3?
41. Qual o volume, em litros, ocupado por 5 g de prata sólida, cuja densidade
é igual a 10,5 g/cm3?
42. Um líquido, com volume de 10,7 mL, tem massa igual a 9,42 g. O líquido
pode ser octano, etanol ou benzeno, cujas densidades são, respectivamente
(em g/cm3), 0.702, 0.789 e 0.879. Qual é o líquido em questão? Justifique sua
resposta através de cálculos.
43.(FMU-SP) Um vidro contém 200 cm3 de mercúrio de densidade
13,6 g/cm3. A massa de mercúrio contido no vidro é:
15 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
44. Um sólido flutuará num líquido que for mais denso que ele. O volume de
uma amostra de calcita, pesando 35,6 g, é 12,9 cm 3.
Em qual dos seguintes líquidos haverá flutuação da calcita:
- tetracloreto de carbono (d = 1,60 g/ cm3);
- brometo de metileno (d = 2,50 g/ cm3);
- tetrabromo-etano (d = 2,96 g/ cm3);
- iodeto de metileno (d = 3,33 g/ cm3).
Justifique sua resposta através de cálculos.
45. Um bloco de ferro (d = 7,6 g/cm3) tem as seguintes dimensões: 20 cm x
30 cm x 15 cm. Determine a massa, em kg, do bloco.
46. Três líquidos (água, benzeno e clorofórmio) foram colocados numa
proveta, originando o seguinte aspecto:
A seguir temos uma tabela com as densidades de cada líquido. Baseando-se
nessas informações e em seus conhecimentos sobre densidade, relacione as
substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta.
16 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
47. Na tabela abaixo temos as densidades de alguns materiais sólidos. Se eles
forem adicionados à água líquida e pura, à temperatura ambiente, qual deles
flutuará?
48. (UFPE) Para identificar três líquidos – de densidades 0,8 ; 1,0 e 1,2 – o
analista dispõe de uma pequena bola de densidade 1,0.
Conforme as posições das bolas apresentadas no desenho a seguir, podemos
afirmar que:
a) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 0,8, 1,0 e
1,2.
b) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 0,8 e
1,0.
c) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 0,8 e
1,2.
d) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 1,0 e
0,8.
e) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e
0,8.
17 CEDAE – Acompanhamento Escolar
Soluções – Classificação, Coeficiente de Solubilidade e Densidade Química
49.(UFG) Uma peça metálica com geometria cúbica foi fabricada com um
dos elementos químicos apresentados na tabela a seguir.
Considerando-se a aresta do cubo igual a 2,5 cm e a massa total da peça igual
a 112,5 g, concluise que o metal utilizado para construção da peça metálica
foi:
a) a Pt b) o Au c) o Pd d) a Ag e) o Cr
50. Em um frasco há 200 cm3 de um líquido de densidade 8,5 g/cm3. Em
outro frasco há 100 cm3 de um líquido de densidade 13,8 g/cm3. Determine,
aproximadamente, a densidade relativa quando misturamos os dois líquidos.
51. A determinação da densidade relativa entre dois líquidos depende do
volume e da massa de cada um dos líquidos da mistura. Em um frasco de
120 cm3 há 600 g de um líquido. Em outro frasco de 80 cm3, há um líquido de
densidade de 6,4 g/cm3. Determine a densidade relativa da mistura dos dois
líquidos.
52. Um objeto flutua em um frasco de 100 mL com um líquido de 21 g/cm3,
mas “afunda” em um frasco de 50 mL com um líquido de 12 g/cm3.
Ao se misturar os dois líquidos, determine se o objeto irá flutuar ou “afundar”
na mistura.
18 CEDAE – Acompanhamento Escolar
Você também pode gostar
- Colóides - Exercícios e conceitos-chaveDocumento3 páginasColóides - Exercícios e conceitos-chaveAdlley KaíqueAinda não há avaliações
- Quim03 Livro Propostos 130920195226 Phpapp01Documento120 páginasQuim03 Livro Propostos 130920195226 Phpapp01Carla Medeiros50% (2)
- Código ProntosDocumento3 páginasCódigo ProntosalexandreAinda não há avaliações
- Soluções São Misturas HomogêneasDocumento6 páginasSoluções São Misturas HomogêneasMabelle Pereira Costa PaivaAinda não há avaliações
- Soluções aquosas e solubilidade de saisDocumento8 páginasSoluções aquosas e solubilidade de saisMichelle LimaAinda não há avaliações
- Lista 1 QG 1-19Documento6 páginasLista 1 QG 1-19schottbpAinda não há avaliações
- Lista de Exercícios sobre Soluções e Concentração (menos deDocumento6 páginasLista de Exercícios sobre Soluções e Concentração (menos deMirela MottaAinda não há avaliações
- LE - Dispersão e SolubilidadeDocumento3 páginasLE - Dispersão e SolubilidadeMatheus PetryAinda não há avaliações
- Revisao Unidade 2 e 3Documento6 páginasRevisao Unidade 2 e 3UEVERTON CARLOS DO CARMO DA SILVAAinda não há avaliações
- Solues 120808142105 Phpapp01Documento9 páginasSolues 120808142105 Phpapp01tissiaraujoAinda não há avaliações
- Coeficientes de solubilidade e concentrações de soluçõesDocumento6 páginasCoeficientes de solubilidade e concentrações de soluçõesÉrica LimaAinda não há avaliações
- Exercícios - Química - Físico QuímicaDocumento51 páginasExercícios - Química - Físico QuímicamariafbellincantaAinda não há avaliações
- Exercicios de SolubilidadeDocumento6 páginasExercicios de Solubilidadesua mae de 4Ainda não há avaliações
- Soluções e solubilidadeDocumento15 páginasSoluções e solubilidadeRaquel Reis Duarte PinheiroAinda não há avaliações
- Química II - Sistemas coloidais e propriedadesDocumento3 páginasQuímica II - Sistemas coloidais e propriedadesLarissa CabralAinda não há avaliações
- Química 2 SérieDocumento2 páginasQuímica 2 SérieLucidio GomesAinda não há avaliações
- Soluções e concentraçõesDocumento4 páginasSoluções e concentraçõesjparatyAinda não há avaliações
- Fisicoquimica II ApostilaDocumento36 páginasFisicoquimica II ApostilaMario SantanaAinda não há avaliações
- 378870-Módulo 01 - Soluções 1 PDFDocumento8 páginas378870-Módulo 01 - Soluções 1 PDFÍtalo SantosAinda não há avaliações
- Aula #01 - SoluçõesDocumento14 páginasAula #01 - SoluçõesAnna Luiza LopesAinda não há avaliações
- 2° AnoDocumento3 páginas2° Anoaline.fernandes.agraAinda não há avaliações
- Lista Solubilidade BásicoDocumento3 páginasLista Solubilidade BásicoProf. Maych Melo QuímicaAinda não há avaliações
- Revisão Quimica 2Documento2 páginasRevisão Quimica 2rubens.costaAinda não há avaliações
- Colóides e suspensões - questões e resoluçõesDocumento5 páginasColóides e suspensões - questões e resoluçõesPedro FloresAinda não há avaliações
- Coeficiente de solubilidade de saisDocumento48 páginasCoeficiente de solubilidade de saisandreik83100% (1)
- 3 - Solucoes AlunoDocumento100 páginas3 - Solucoes AlunoQuimica Mais FrancisAinda não há avaliações
- Atividade Sobre Coeficiente de SolubilidadeDocumento13 páginasAtividade Sobre Coeficiente de SolubilidadePedro HélioxAinda não há avaliações
- Exercicios Coeficiente de SolubilidadeDocumento4 páginasExercicios Coeficiente de SolubilidadeAndré Luís Della VolpeAinda não há avaliações
- Lista Certa Do RobinhoDocumento4 páginasLista Certa Do RobinhogiovanarezendebensiAinda não há avaliações
- Planejamento de Química sobre SoluçõesDocumento7 páginasPlanejamento de Química sobre SoluçõesFernando RisilAinda não há avaliações
- 1 Lista Exerc Cios 2012 EngenhariaDocumento3 páginas1 Lista Exerc Cios 2012 EngenhariaRaphael Catapani0% (1)
- Estudo Das Solucoes Coeficiente de SolubilidadeDocumento13 páginasEstudo Das Solucoes Coeficiente de SolubilidadeGildo Silva100% (1)
- Estudo das SoluçõesDocumento5 páginasEstudo das SoluçõesKyuraKingAinda não há avaliações
- Exercicio 4 QuimicaDocumento5 páginasExercicio 4 QuimicaRichard JoséAinda não há avaliações
- BiomedicinaDocumento56 páginasBiomedicinaDaniela LealAinda não há avaliações
- Solubilidade de saisDocumento4 páginasSolubilidade de saisCleber SerafinAinda não há avaliações
- Simulado SoluçõesDocumento4 páginasSimulado SoluçõesNady ChavesAinda não há avaliações
- Química - Soluções e dispersõesDocumento5 páginasQuímica - Soluções e dispersõesGRAZIELLI SILVAAinda não há avaliações
- Lista 2 - Exercícios de Densidade e SolubilidadeDocumento7 páginasLista 2 - Exercícios de Densidade e SolubilidadeMurilo Silva NevesAinda não há avaliações
- Lista de Exercicios de SolucoesDocumento2 páginasLista de Exercicios de SolucoesGraciano ComboioAinda não há avaliações
- Questões de Química sobre SoluçõesDocumento3 páginasQuestões de Química sobre SoluçõesPatrícia TeixeiraAinda não há avaliações
- Resolução atividades Química soluçõesDocumento24 páginasResolução atividades Química soluçõesluanalvesnetoAinda não há avaliações
- Solucoes PDFDocumento15 páginasSolucoes PDFThiago Magno Tavares Machado100% (1)
- Soluções QuímicasDocumento3 páginasSoluções QuímicasCassio RezendeAinda não há avaliações
- Estudo Das Soluções PDFDocumento47 páginasEstudo Das Soluções PDFRenanEQAinda não há avaliações
- EXERCÍCIOS DE FÍSICO-QUÍMICADocumento2 páginasEXERCÍCIOS DE FÍSICO-QUÍMICALeoFl0resta0% (1)
- Lista 2 - TÍTULO E FRAÇÃO MOLAR - PROF ALAN BORGESDocumento2 páginasLista 2 - TÍTULO E FRAÇÃO MOLAR - PROF ALAN BORGESMaria JoednaAinda não há avaliações
- Apostila de Exercícios 2Documento16 páginasApostila de Exercícios 2abatubaiAinda não há avaliações
- SOLUÇÕESDocumento8 páginasSOLUÇÕESAlineAinda não há avaliações
- Quim 2Documento20 páginasQuim 2Sajin guaxinimAinda não há avaliações
- AT de Quimica 11 Classe-III Trimestre-2023Documento2 páginasAT de Quimica 11 Classe-III Trimestre-2023Cencia Lurdes PauloAinda não há avaliações
- Arquivo de Soluções Do Prof° VieiraDocumento9 páginasArquivo de Soluções Do Prof° VieiravieirasalesAinda não há avaliações
- Lista de exercícios de Química sobre solubilidade e concentraçãoDocumento4 páginasLista de exercícios de Química sobre solubilidade e concentraçãoMichel KaipperAinda não há avaliações
- Química Lista de ExercíciosDocumento4 páginasQuímica Lista de Exercícioshtq87rbdjgAinda não há avaliações
- 16 SolubilidadeDocumento7 páginas16 SolubilidadeFRANKE MERO TESTEAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Biodiesel de Óleo de Babaçu por Destilação ReativaNo EverandBiodiesel de Óleo de Babaçu por Destilação ReativaAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Artigo Permeação Cutânea - Desafios e OportunidadesDocumento12 páginasArtigo Permeação Cutânea - Desafios e OportunidadesCaroline OdaAinda não há avaliações
- Ficha 8 - Preparaçao ExamesDocumento2 páginasFicha 8 - Preparaçao Examestareca0% (1)
- Teste2-Contabilidade de Gestao 1Documento11 páginasTeste2-Contabilidade de Gestao 1Jacinto FaustinoAinda não há avaliações
- Lista1 TBT 3°ano 1°triDocumento4 páginasLista1 TBT 3°ano 1°triGeovany ZuquêtoAinda não há avaliações
- TP2 - BioquimicaDocumento23 páginasTP2 - BioquimicaInes PereiraAinda não há avaliações
- Simulado de FísicaDocumento5 páginasSimulado de FísicaEdson SactorumAinda não há avaliações
- Comandos C, variáveis e algoritmosDocumento3 páginasComandos C, variáveis e algoritmosLucas LopesAinda não há avaliações
- Microondas Philco 18 LitrosDocumento24 páginasMicroondas Philco 18 LitrosJose Luiz da SilvaAinda não há avaliações
- CA 9 Ano Vol 1 - Aluno MatemáticaDocumento33 páginasCA 9 Ano Vol 1 - Aluno MatemáticaGabriela UlianAinda não há avaliações
- Sistema Web para Gestao Academica Do ComDocumento68 páginasSistema Web para Gestao Academica Do ComChēëzy Ğäşpāř100% (1)
- Problemas de MatemáticaDocumento4 páginasProblemas de MatemáticaFelipe AlmeidaAinda não há avaliações
- D7 3° Ano Ensino Médio Matemática RespostaDocumento4 páginasD7 3° Ano Ensino Médio Matemática RespostaAugusto SoaresAinda não há avaliações
- Características Das Águas SubterrâneasDocumento42 páginasCaracterísticas Das Águas SubterrâneasLeandroAinda não há avaliações
- Atualização do catálogo de compressores FarjDocumento24 páginasAtualização do catálogo de compressores FarjMartins Ismael100% (1)
- Regulador de tensão contínua para lâmpadas e pequenos motoresDocumento1 páginaRegulador de tensão contínua para lâmpadas e pequenos motoresCorreia FernandoAinda não há avaliações
- Fluxo de Caixa para Clínicas e ConsultóriosDocumento223 páginasFluxo de Caixa para Clínicas e Consultóriosjosenato1970Ainda não há avaliações
- Algebra Linear Exercicios OlimpoDocumento16 páginasAlgebra Linear Exercicios Olimpoanon_788064665Ainda não há avaliações
- Questionários para Seminários - Preparacao para Teste 1Documento4 páginasQuestionários para Seminários - Preparacao para Teste 1joaquim mequeAinda não há avaliações
- Motor elétrico: transforma energia elétrica em mecânicaDocumento28 páginasMotor elétrico: transforma energia elétrica em mecânicaISRAEL HOLESAinda não há avaliações
- Manual Multímetro - Fluke 26 Series IIIDocumento12 páginasManual Multímetro - Fluke 26 Series IIIa.diedrichsAinda não há avaliações
- Material Intensivo MatematicaDocumento511 páginasMaterial Intensivo MatematicaMirlaineAinda não há avaliações
- Teores de CorteDocumento6 páginasTeores de CorteDavisson M. Francisco100% (3)
- 1 - AntenasDocumento3 páginas1 - AntenasbarbosamanddaAinda não há avaliações
- Roteiro Estruturas de MadeiraDocumento10 páginasRoteiro Estruturas de MadeiraBryan AlmeidaAinda não há avaliações
- EbookDocumento18 páginasEbookAndré DuarteAinda não há avaliações
- Catálogo de Peças - Space VanDocumento218 páginasCatálogo de Peças - Space VanRafael Fávaro100% (1)
- Análise de Redes ElétricasDocumento307 páginasAnálise de Redes Elétricasemilio antonio arteta romanAinda não há avaliações
- Catálogo de Produtos 2021Documento12 páginasCatálogo de Produtos 2021José Arnaldo SilvaAinda não há avaliações
- Colaborar - Av1 - Linguagem de ProgramaçãoDocumento3 páginasColaborar - Av1 - Linguagem de ProgramaçãoFabricia LimaAinda não há avaliações