Escolar Documentos
Profissional Documentos
Cultura Documentos
E Stereo Qui Mica
E Stereo Qui Mica
Enviado por
InhaSilvaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
E Stereo Qui Mica
E Stereo Qui Mica
Enviado por
InhaSilvaDireitos autorais:
Formatos disponíveis
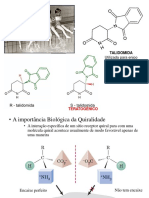
QUMICA ORGNICA AVANADA
UNIDADE 1: ESTEREOQUMICA
1.1. Isomerismo Molecular
1.2. Simetria em Compostos Orgnicos
1.3. Estereoisomerismo
1.4. Nomenclatura de Estereoismeros
1.5. Estereoqumica com Heterotomos
1.6. Estereoqumica sem tomos Quirais
1.7. Topicidade e Prostereoisomerismo
1.8. Topicidade e Espectroscopia de RMN de
1
H
1.9. Atividade ptica e Quiralidade
1.10. A Projeo de Fischer
1.11. Configurao Absoluta
1.12. Mtodos de Determinar a Configurao Absoluta
1.13. Sntese Assimtrica
1.14. Confrmeros Acclicos e Cclicos
Bibliografia Sugerida:
1. Eliel, E. L. and Wilen, S. H. Stereochemistry of Organic Compounds; John Wiley &
Sons, Inc.: New York, 1994.
2. Buxton, S. R.; Roberts, S. M. A Guide to Organic Stereochemistry; Longman,
Edinburgh, Inglaterra, 1996.
3. Romero, J. R. Fundamentos de Estereoqumica dos Compostos Orgnicos. Editora
Holos, Ribeiro Preto, SP, 1998.
* Os itens de 1.1 a 1.8 foram baseados totalmente no material didtico desenvolvido pelo
Prof. Sergio Pinheiro da Universidade Federal Fluminense.
2
1.1 - ISOMERISMO MOLECULAR
Estereoqumica estuda a geometria espacial das molculas
Importncia: nas propriedades fsicas das molculas, no curso
e no mecanismo de reaes, na espectroscopia, etc.
Estereoismeros: so ismeros espaciais
Geomtricos (cis-trans)
(trans) (cis)
(cis) (trans)
Confrmeros interconvertveis por rotao
em torno de ligao simples .
Cl
Cl
H
H
H
Cl
H
Cl
Molculas iguais
(em equilbrio)
Conformaes
diferentes
Configuracionais (pticos) tomos tm arranjos
espaciais diferentes
b
a
c
d
b
a
d
c
e
Configuraes diferentes
No so a mesma molcula
Se interconvertem por
quebra de ligaes
Hommeros so a mesma molcula. Tm frmulas moleculares iguais
e mesmo arranjo dos tomos.
Ismeros so molculas diferentes. Tm frmulas moleculares iguais
e diferentes arranjos dos tomos.
3
1.2 - SIMETRIA EM COMPOSTOS ORGNICOS
Quiralidade um fenmeno molecular. Est associada presena de
elementos de simetria nas estruturas dos compostos.
Elemento de simetria uma operao que interconverte certas partes de
uma molcula em outras, de tal modo que a estrutura final seja idntica ao
desenho original.
1.2.1- Elementos de simetria
a) Eixo Prprio (Cn)
o eixo de ordem n tal que quando uma molcula rodada de 360
o
/ n ao
redor desse eixo Cn faz com que a nova molcula seja idntica original.
ATENO ! Molculas lineares tm eixo C
C1 ocorre em todas as molculas (no eixo de simetria)
Br H
H Br
180
o
Br H
H Br
360
o
/ 180
o
= 2 (eixo C
2
)
N
H
H
H
120
o
N
H
H
H
360
o
/ 120
o
= 3 (eixo C
3
)
C
6
C
2
C
2
Eixo principal: o eixo de maior
ordem n
Exerc.: Identificar todos os eixos
Cn da molcula ao lado.
Et Me
C
oo
4
b) Plano de Simetria ()
o plano que divide a molcula em duas pores idnticas.
c) Centro de Simetria (inverso) (Ci)
um ponto Ci da molcula tal que as retas que passam por Ci cortam
pontos equivalentes na mesma distncia dos dois lados de Ci.
d) Eixo Imprprio ou Alternado (Sn)
Elemento consiste de rotao de n graus sobre um eixo e reflexo no
plano perpendicular a esse eixo.
com reflexo
com rotao ou
Tanto faz comear
(elemento S
2
)
360
o
/ 180
o
= 2
Ph
H
H
Ph
180
o
H
Ph
Ph
H
H
Ph
Ph
H
180
o
Ph
H
H
Ph
Ci
Ph
H
H
Ph
H
HO
2
C
CO
2
H
H
Ci
C
6
C
2
C
2
(h)
H
H
H
H
(v)
C
2
(h)
(v)
(v) (vertical) plano
que contm o eixo principal.
(h) (horizontal) plano
perpendicular ao eixo principal.
5
ATENO ! Qualquer molcula pode ser classificada atravs das
operaes de simetria.
1.2.2- Simetria e quiralidade
A presena de pelo menos um dos elementos de simetria de reflexo
(, Sn ou Ci) faz com que a molcula seja sobreponvel, ponto a ponto,
sua imagem especular: molcula aquiral
a
b
c
c
a
b
c
c
180
o
(tem e C
2
)
b
a a
b
(tem e S
2
)
H
H
, C
2
2 planos
1 eixo C
2
N
H
H
H
C
3
3 planos
1 eixo C
3
Cl
Cl
C
2
1 eixo C
2
Molcula
quiral
- no sobreponvel, ponto a ponto,
sua imagem especular.
- no tem , Sn nem Ci
a
b
C
d
e
b
a
C
e
d
* *
(no sobreponveis)
C* carbono assimtrico
[]
D
0
o
6
PPh
2
PPh
2
O
O
(R,R)-DIOP
C
2
CO
2
Et
CO
2
Et HO
HO
H
H
C
2
(+)-DET
OH
OH
(R)-BINAFTOL
C
2
Molculas quirais (tipos)
- assimtrica no tem elementos de simetria; geralmente tem C*
O
D-(+)-cnfora
CN
Br
Cl
H
- dissimtrica tem eixo de simetria Cn
Cl
Cl
C
2
Cl
Cl
180
o
enantimeros
C
2
o eixo Cn mais importante !
Cl
Cl
L-(-)-cnfora
O
enantimeros
NC Cl
Br
H
enantimeros
CO
2
H
CO
2
H
H
HO
OH
H
cido (-)-tartrico
C
2
7
GRUPOS PONTUAIS
Grupo pontual de simetria o grupo de todas as molculas que
contm o mesmos elementos de simetria.
H H
O
C
2
Cl
Cl
H
C
H
C
2
2 planos
1 eixo C
2
2 planos
1 eixo C
2
Grupo pontual
C
2v
C
2v
C
2
eixo de maior n
Cv
plano contm o
eixo de maior n
H
N
H
H
H
Cl
Cl
Cl
C
Grupo pontual
, C
3
3 planos
1 eixo C
3
, C
3
3 planos
1 eixo C
3
3V
8
Exemplos: molculas quirais
CH
3
OH
H
Ph
Grupo pontual C
1
No h elementos de simetria
OH
OH
C
2
H
Cl
Cl
H
H
Cl
Cl H
C
2
Grupo pontual Cn
Molculas com eixo prprio Cn (dissimtricas)
O
OH
NO
2
Cl
NO
2
Cl
NO
2
Cl
C
2
alenos com padro abC=C=Cab
NO
2
Cl
Grupo pontual Dn Molculas com n eixos C
2
ao eixo principal Cn.
O
O
bifenilas em ponte
nas posies ,'
C
2
(Grupo pontual C
2
)
(Grupo pontual D
2
)
Cn = C
2
Cn = C
2
C
2
bifenilas com substituintes iguais em posies orto (Grupo pontual C
2
)
(Grupo pontual D
2
)
Molculas assimtricas
9
Determinao do grupo pontual:
Grupos pontuais que contm molculas quirais: C
1
, Cn e Dn
C
n
no
S
2n
sim
com Cn ?
H Sn colinear
no
C
nv
sim
eixo principal ?
contendo o
H n planos
no
D
n
D
nd
no
sim
ngulos entre C
2
?
que biseccionam
H n planos
no
D
nh
sim
Cn ?
H plano
sim
H n eixos C
2
Cn ?
Selecionar o maior Cn;
S
2 ~
~
C
i
C
l
sim
no
H centro C
i
?
no
C
s
sim
H plano ?
no
sim
H eixo Cn ?
no
O
h
sim
octaedro ?
Molcula
no
T
d
sim
regular ?
tetraedro
Molcula
Molculas
assimtricas
Molculas
dissimtricas
Molculas
dissimtricas
assimtricas e
10
Exemplos: Molculas aquirais
Grupo T
d
Cl
Cl
Cl
Cl
molculas
com alta simetria
Si
F
F
F
F F
F
Grupo Oh molculas
com alta simetria
(octaedros e cubos)
Grupo Cs molculas
com plano de simetria e
Cl
Br
H H
H Cl
O
CHO
H
OH
H
H
CR
2
XY
RCHO
sem eixode simetria
Grupo Ci = S
2
no tm eixo de simetria
CO
2
H
CO
2
H
H
HO
H
OH
N
N
H O
O H
no tm plano de simetria
tm centro de simetria
H CO
2
Me
O=C=O
Grupo D
ooh
compostos com
simetria cilndrica
11
Grupo D
nh
tm eixo Cn (principal)
tm plano de simetria
Cl
Cl
tm n eixos C2 perpendi-
culares ao eixo principal
perpendicular ao
eixo principal
(D
2h
) (D
2h
)
(D
3h
) (D
3h
)
(D
6h
)
Grupo D
nd
(D
2d
) (D
2d
)
(D
3d
)
tm eixo principal e n eixos
C
2
perpendiculares a ele
existem n planos que inter-
ceptam o eixo principal
Grupo C
2V
(C
2V
)
Br
H H
O
(C
2V
) (C
2V
)
molculas
com um eixo Cn e
n planos de simetria
12
1.3- ESTEREOISMEROS
Enantimeros estereoismeros em que um a imagem especular e no
sobreponvel, tomo por tomo, do outro.
ATENO ! Mistura racmica (par d,l) opticamente inativa.
= - 42,9
o
D
27
[]
= + 42,9
o
D
27
[]
CH
3
HO
Ph
H
CH
3
OH
Ph
H
+
(1 mol)
(1 mol)
Ph
OH
= 0
o
D
27
[]
Se um dos
enantimeros
for predominante
na mistura, essa
opticamente
ativa.
CUIDADO !
CH
3
OH
H
Ph
HO
CH
3
Ph
H
[]
D
= + 42,9
27
[]
D
= - 42,9
27
Uma molcula s pode ter um enantimero
Em meio aquiral, dois enantimeros s
diferem pelo sinal do [].
Cada enantimero quiral
C
2
Em enantimeros: todos os centros quirais so invertidos
CO
2
H
CO
2
H
H
HO
OH
H
cido (-)-tartrico
CO
2
H
CO
2
H
OH
H
H
HO
Ph
CO
2
Me
OH
Ph
CO
2
Me
OH
Enantimeros: podem ser assimtricos ou dissimticos
CO
2
H
CO
2
H
H
HO
OH
H
CO
2
H
CO
2
H
OH
H
H
HO
OH
OH
par (d,l) assimtricos
cido (+)-tartrico
(d, l) ou (R, S) ou
+
_
dissimtricos par (d,l)
13
Diastereoismeros estereoismeros em que um no a imagem
especular do outro. Um ou ambos podem ser
opticamente ativos.
Cl Me
2 C*
2
2
= 4 estereoismeros possveis
2
2
/2 = 2 pares (d,l) possveis
Cl Me Cl Me
Cl
Me
Cl Me
(d,l) (d,l)
diastereoismeros
(todos so quirais: no tm , Ci nem Sn)
H OH
H OH
HO H
H OH
meso (aquiral)
H OH
HO H
(d,l)
enantimeros
(quirais)
diastereoismeros
diastereoismeros
(aquirais: tm plano )
14
Alguns termos importantes:
Meso estereoismero que tem um nmero igual de grupos identicamente
ligados e enantiomricos e nenhum outro grupo quiral. aquiral
Epmeros diastereoismeros que diferem entre si pela configurao de
apenas um dos centros quirais.
Anmeros so epmeros no carbono anomrico.
H OH
H H
OH H
H
Ph
H
Ph
Formas meso sempre
tm plano de simetria
O
OH
HO
HO
HO
HO
O
OH
HO
HO
HO
HO
(-D-glicose) (-D-glicose)
O
Cl
Bu
t
(anmero )
O
Cl
Bu
t
(anmero )
Et Et
15
1.4- NOMENCLATURA DE ESTEREOISMEROS
1.4.1- Para configurao relativa
2
o
modo: eritro-treo
Usada para sistemas acclicos com 2 centros quirais onde dois
dos substituintes so iguais e o terceiro diferente.
Usar projees de Fischer ou formas em cavalete eclipsadas!
Y
Z
W
X
W
X
Y
X W
X W
Z
eritro substituintes iguais
do mesmo lado
(Ateno! Se Y = Z meso)
Y
Z
X
W
W
X
Y
X W
W X
Z
treo substituintes iguais
em lados diferentes
(Ateno! Se Y = Z d,l)
Ex: D,L; R,S; (+) / (-)
da molcula. d a geometria espacial - absoluta
Ex: cis-trans, eritro-treo, syn-anti
(quirais ou no). diferentes centros
d a relao entre tomos ligados a - relativa
Configurao
1
o
modo: cis-trans
Et
Et
cis
trans cis trans
Et
Et
Z E
16
ficam no plano.
Prioridade: maiores cadeias de carbono
em
zig-zag !
CO
2
Me
H
Me
Ph
H
HO
syn
dos C
CO
2
Me
H
Me
Ph
HO
H
Usar forma
3
o
modo: syn-anti
Mais usada para sistemas acclicos com 2 ou mais centros quirais.
anti
OH e Me em lados
diferentes
Y
N
Z
X
N
Z
X Y
(syn) (anti)
X Y Z
prioridade
Cahn-Ingold-Prelog
17
1.4.2- Para configurao absoluta
prioridade
A B C D
S: sentido anti-horrio
A
C
B
D
R: sentido horrio
A
B
C
D
Nomenclatura atual: baseada no sistema Cahn-Ingold-Prelog.
2
o
modo: Nomenclatura R,S
H
i-Pr H
R
S
Bu
t
Et
R
R
N
Ph
H
H
R
Atualmente: s usada para carboidratos e aminocidos.
1
o
modo: Nomenclatura D,L
Nomenclatura antiga: baseada nos enantimeros do gliceraldedo.
CHO
OH H
CH
2
OH
CHO
H HO
CH
2
OH
D-(+) L(-)
gliceraldedo
(acares naturais: srie D)
CO
2
H
NH
2
H
CH
3
CO
2
H
H H
2
N
CH
3
L(-) D-(+)
glicina
(aminocidos naturais: srie L )
18
ATENO! Carbono pseudo-assimtrico um carbono quiral contido
em uma molcula aquiral.
Br
OH OH
Br
OH OH
Br
OH OH
Br
OH OH
Br
OH OH
H OH
H Br
H OH
H OH
Br H
H OH
Br
OH OH
Br
OH OH
Ex.:
2
3
4
C
3
pseudo-assimtrico
assimetria depende das
configuraes de C
2
e de C
4
2
4
1
o
caso
2
4
C
3
: r C
3
: s
(molculas diferentes)
prioridade: R S
Br C
2
C
4
prioridade
molcula aquiral
C
2
: R; C
4
: S
C
3
pseudo-
assimtrico
Cahn-Ingold-Prelog:
r s
2
o
caso
2
4
molculas quirais
C
3
aquiral
C
2
: R; C
4
: R
no
nem C
2
2
4
C
2
: S; C
4
: S
no
nem C
2
Molculas so
assimtricas
enantimeros
(molculas diferentes)
19
1.5- ESTEREOQUMICA COM HETEROTOMOS
Estereoisomerismo ocorre em tomos centrais diferentes do carbono.
a) Substncias com tomos assimtricos trivalentes
b) Substncias com outros tomos assimtricos tetravalentes
no P muito lenta !
Inverso do guarda-chuva
(d,l)
P
Ph
Et
Me
P
Ph
Et
Me opticamente ativos
Fosfinas, sais de sulfnio
e no enantimeros.
Molculas so iguais,
N
Ph
Et
Me
N
Ph
Et
Me
(inverso do guarda-chuva)
equilbrio rpido leva perda da quiralidade Aminas e NH
3
e sulfxidos so
(d,l)
S
O
Et
Me
S
O
Et
Me
Br Br
S
Ph
Et
Me
S
Ph
Et
Me
(d,l)
N
Et
Me
Pr
O
N
Et
Me
Pr
O
(d,l)
Br
Br
N
Et
Me
Pr
H
N
Et
Me
Pr
H
(d,l)
compostos de Si,
(d,l)
H
Si
Ph
Bu
t
Me
H
Si
Ph
Bu
t
Me
sais de amnio e N-xidos
20
1.6- ESTEREOQUMICA SEM TOMOS QUIRAIS
Certas substncias podem ser opticamente ativas mesmo sem possuir
centros quirais.
Principais casos: rotao restrita origina planos dissimtricos e perpendi-
culares. Pertencem ao grupo pontual Cn (dissimtricas).
diferentes em orto bifenilas com substituintes volumosos e
O
2
N
Et
Me
NO
2
Et
NO
2
Me
NO
2
(d,l)
ATROPISMEROS so
confrmeros que so separveis
devido a rotao reatrita em C-C
Ex.:
Ex.: alenos dos tipos abC=C=Cab e abC=C=Cde
Me
Et
Et
Me
Et
Me
Me
Et
(d,l)
Ex.: certos alquilidenocicloalcanos
certos espiranos substituidos
Ex.:
H
CO
2
H
H
Me
(d,l)
H
HO
2
C
H
Me
Et Me
Me
Et
Me Et
Me
Et
H
Cl
H
Me
H
Cl
H
Me
(d,l)
21
1.6.1. "MOLECULAR PROPELLERS" E "GEARS"
"Molecular Propellers"
So molculas anlogas s hlices de barcos e avies e so um caso
especial de atropisomerismo. As "palhetas" da hlice so torcidas no mesmo
sentido, sendo constituidas de grupos planares (geralmente anis aromticos
com substituintes diferentes), que no so coplanares entre si. A no
coplanaridade devida a rotao impedida nas ligaes simples.
Se os 3 anis forem perpendiculares ao plano sp
2
do boro h 4 pares (d, l): os
substituintes X, Y e Z ficam acima e abaixo do plano trigonal do boro.
OBS: Se os anis forem torcidos (e no perpendiculares ao plano sp
2
do B),
h helicidade. Anis torcidos p/ a direita e p/ a esquerda do 8 pares (d, l).
B Y
Z
X
B
X
Z
Y
(d, l)
B Y
Z
B
Z
Y
(d, l)
X X
B Y
X
B
X
Y
(d, l)
Z
Z
B
Z
X
B
X
Z
(d, l)
Y
Y
B
X
Z
Y
B
um "propeller" no um "propeller"
quiral; grupo C
1
(assimtrica)
quiral; grupo Dn
X = Y = Z
X = Y = Z
22
O tomo central da hlice do "propeller" pode ser assimtrico.
Ex.: carbono assimtrico
Os estereoismeros dos "molecular propellers" podem ser interconvertidos
atravs de mecanismos em "flip" envolvendo 0, 1, 2 ou os 3 anis.
Conseqncia no espectro de
1
H-RMN:
X
Z
Y H
16 pares (d, l)
X
Z
Y H
8 pares (d, l)
X
Y
Z
(h eixos C
2
)
Presena de eixos C
2
nos anis diminui o
nmero de pares (d, l)
0 anis
1 anel
2 anis
3 anis
flip
flip
flip
flip
N
Ph
X
X = CO
2
CH
3
1
H-RMN (CD
2
Cl
2
) a -40
o
C: h duplicidade de sinais
(h mistura de dois diastereoismeros)
1
H-RMN (CD
2
Cl
2
) a 25
o
C: sinais
dos dois
diastereoismeros coalescem
Barreira de energia para interconverso dos
diastereoismeros relativamente baixa a 25
o
C
(17,8 kcal/ mol)
23
Gears
So engrenagens ("gears") observadas em molculas aquirais onde a
rotao impedida em torno de ligaes simples decorrente de tenses de
van der Waals entre grupos no ligados.
H
H
H
H
H
Grupo pontual
C
6h
H
H
3
C
H
3
C
H
H
3
C
CH
3
H
CH
3
H
3
C
H
CH
3
CH
3
Grupo pontual
C
2h
"Gears" estticos
H conformaes
preferenciais em C-C
Rotao restrita
em torno de C-C
H
Grupos isopropila so iscronos
24
1.7- TOPICIDADE E PROSTEREOISOMERISMO
D as relaes entre tomos, grupos e faces em uma dada molcula.
1. Para tomos e grupos
As relaes entre dois tomos (ou grupos) so dadas pela substituio de um
deles por um terceiro tomo (ou grupo). O conceito usado principalmente
para distingir dois tomos de hidrognio presentes no mesmo carbono.
1
o
CASO Molculas do tipo CH
2
X
2
H
1
H
2
X
X
H
1
X D
H
2
X D
D
H
2
X
X
H
1
D
X
X
rotao
Produtos so iguais
H
1
e H
2
iguais
(HOMOTPICOS)
2
o
CASO Molculas do tipo CH
2
XY
H
1
H
2
X
Y
H
1
X D
H
2
X D
D
H
2
X
Y
H
1
D
X
Y
rotao
Produtos so
enantimeros
H
1
e H
2
so
ENANTIOTPICOS
Hidrognios homotpicos e enantiotpicos no so diferenciados
por
1
H-RMN sob condies de simetria (ex.: CDCl
3
na ausncia de
reagentes de deslocamento quirais).
25
ATENO! PR-QUIRAL termo usado para grupo (ou molcula)
que tem dois tomos (ou grupos) enantiotpicos. A substituio
por um terceiro tomo (ou grupo) produz uma molcula quiral!
Ph
CO
2
Me
H
1
H
2
centro
pr-quiral
1. LDA, THF
2. CH
3
I
Ph
CO
2
Me
H
1
CH
3
centro quiral
molcula quiral
molcula aquiral
(pr-quiral)
H
1
e H
2
: so pr-quirais
(enantiotpicos)
Posio benzlica
tambm pr-quiral
Ph
CO
2
Me
H
1
H
2
centro
pr-quiral
OBS:
3
o
CASO Molculas do tipo XH
2
C-C*
H
1
X D
H
2
X D
Produtos so
diastereoismeros
H
1
e H
2
so
DIASTEREOTPICOS
Hidrognios diastereotpicos so diferenciados por
1
H-RMN
sob condies de simetria.
X
H
1
H
2
R
1
R
2
R
3
C* = centro quiral
C*
X
D
H
2
R
1
R
2
R
3
X
H
1
D
R
1
R
2
R
3
26
Ateno!!! O centro quiral pode estar afastado, mas os hidrognios
continuam sendo diastereotpicos.
Nomenclatura de tomos e grupos pr-quirais: sistema Cahn-Ingold-Prelog
(nomenclatura R, S)
O
H
1
H
2
Et Bu
t
H
1
e H
2
so diastereotpicos
Os H em cada CH
2
so
diastereotpicos entre si.
O
H
2
H
1
(pr-quiral)
H
1
x D
H
2
x D
O
H
2
D
O
D H
1
R (quiral)
S (quiral)
R
S
H
1
e H
2
: pr-quirais
(enantiotpicos)
H
1
pr-R (H
R
)
H
2
pr-S (H
S
)
27
2. Para faces
Tambm existe topicidade em faces de molculas trigonais.
1
o
CASO Molculas do tipo
Produtos so iguais
(HOMOTPICAS)
2
o
CASO Molculas do tipo
rotao
Produtos so
enantimeros
ENANTIOTPICAS
R R
X
R R
O
Nu
_
Nu
_
ataque
por trs
ataque
pela frente
R R
Nu OH
R R
Nu OH
H
3
O
+
H
3
O
+
R R
O
faces iguais
R R
1
X
rotao R R
1
O
Nu
_
Nu
_
ataque
por trs
ataque
pela frente
R R
1
Nu OH
R R
1
Nu OH
H
3
O
+
H
3
O
+
R R
1
O
faces so
(PR-QUIRAIS)
28
3
o
CASO Molculas do tipo
Produtos so
diastereoismeros
DIASTEREOTPICAS
R R*
X
Nu
_
Nu
_
ataque
por trs
ataque
pela frente
H
3
O
+
H
3
O
+ R R*
O
faces so
R* = grupo contendo
centro quiral
R
O
R
1
R
2
R
3
R
R
1
R
2
R
3
Nu OH
R
R
1
R
2
R
3
Nu OH
ATENO ! O estereocentro pode estar afastado da C=X.
Ph
O
H
1
H
2
H
3
H
4
Et
estereocentro
faces de C=O so diastereotpicas
H
1
e H
2
so diastereotpicos
H
3
e H
4
so diastereotpicos
29
Nomenclatura de faces pr-quirais (enantiotpicas): usar o sistema
Cahn-Ingold-Prelog (nomenclatura R, S)
Y Z
X
face Si
Z Y
X
face Re
Prioridade: X Y Z
(na nomenclatura R, S)
Ateno! X sempre o de
maior prioridade
(X = O, S, NR, etc)
Exemplo:
Et Me
O
Nu
_
face Re
Nu
_
Nu
_
H
3
O
+
H
3
O
+
face Si
_
Nu
Et Me
HO Nu
Et Me
HO Nu
30
1.8- TOPICIDADE E ESPECTROSCOPIA DE
1
H-RMN
Hidrognios homotpicos e enantiotpicos no acoplam entre si e no
so diferenciveis ( iguais)
no espectro de
1
H-RMN.
Ex.: hidrognios homotpicos
Ex.: hidrognios enantiotpicos
N N
Ha
Hb
Ha e Hb: homotpicos
1
H RMN (300 MHz, CDCl
3
)
Ha e Hb: 3,20 ppm (s, 2H)
Ha e Hb
N OCH
3
Ha
Hb
Ha e Hb: enantiotpicos
Ha e Hb: 3,44 ppm (s, 2H)
1
H RMN (300 MHz, CDCl
3
)
Ha e Hb
31
Hidrognios diastereotpicos acoplam entre si e so diferenciveis
(diferentes ) no espectro de
1
H-RMN.
Ex.:
Ex.:
O
O
CO
2
CH
3
Ha Hb
carbono
quiral
+
_
Ha: 2,98 ppm (d, 1H, J
HaHb
= 15 Hz)
Hb: 2,66 ppm (d, 1H, J
HbHa
= 15 Hz)
Padro AB:
1
H RMN (100 MHz, CDCl
3
)
Hb
N
O
Ha Hb
H
3
Ha: 2,68 (dd, J
HaHb
= 12,6 Hz e J
HaH3
= 3,0 Hz)
Hb: 2,38 (dd, J
HaHb
= 12,6 Hz e J
HaH3
= 7,2 Hz)
1
H RMN (300 MHz, CDCl
3
)
Ha
32
1.9- ATIVIDADE PTICA E QUIRALIDADE
Jean Baptiste Biot, fsico francs - 1815: Ele descobriu que algumas substncias
naturais (glicose, nicotina, sucrose, ) giravam o plano da luz polarizada e outras
no.
Qualquer molcula que gira o plano da luz polarizada dito ser opticamente
ativa. Se uma substncia pura opticamente ativa, a molcula no superponvel
na sua imagem especular. Se a molcula superponvel na sua imagem especular a
substncia no gira o plano da luz polarizada, e ela ento opticamente inativa.
Enantimeros somente podem ser discriminados na presena de um agente
quiral. O plano da luz polarizada um agente quiral. Se uma luz normal passada
atravs de um filtro polarizador, tal como um polaride, o vetor de campo eltrico,
associado com a propagao da luz, oscila num plano nico perpendicular direo
de propagao.
Fi l me Pol ar oi d
Luz
pol ar i zada
Este plano de luz polarizada pode ser descrito como sendo composto de duas
ondas em hlice, enantiomricas, circulando em torno do eixo de propagao em
direes opostas. Cada hlice tem um vetor campo eltrico associado, e as duas
ondas esto em fase de tal forma que a qualquer tempo as contribuies dos dois
33
vetores campo eltrico para a propagao se cancelam exceto no plano de
propagao.
Os campos eltrico e magntico de um raio de luz ordinria em um plano.
(T.W.G. Solomons Organic Chemistry, John Wiley & Sons, Inc. 1996, 6th Ed.)
Quando a luz plano polarizada passada atravs de uma soluo contendo
uma substncia quiral h uma interao diastereoisomrica. As molculas quirais
refrataro uma hlice mais que outra; cada componente ter um ndice de refrao
diferente num meio quiral. Se as molculas quirais so todas de mesma
configurao, ou um enantimero est em excesso, o plano da luz polarizada ser
girado em relao ao plano original.
E
< '
E
L
X
E
R
Y
Este fenmeno forma a base da anlise de enantimeros pela suas rotaes
ticas. Um aparelho chamado polarmetro usado para estudar rotaes ticas
34
passando luz plano-polarizada monocromtica (usualmente a linha D do sdio a 589
nm) atravs de uma clula de comprimento fixo e medindo sua rotao. A rotao
numa direo horria, em relao ao observador, olhando atravs da soluo em
direo a fonte de luz, registrado como positiva (+) e uma rotao anti-horria
negativa (-).
Um enantimero com uma rotao positiva algumas vezes descrito como d
(destro) (no confundir com D!) e um com uma rotao negativa como l (levo).
A quantidade de rotao no uma constante para um dado enantimero,
ela depende do comprimento do vidro da amostra, da temperatura, do solvente e
concentrao (para solues), da presso (para gases), e do comprimento de onda
da luz.
O O Pol ar met r o Pol ar met r o
chemi st r y
ner d
sampl e cel l
pol ar i zer pol ar i zer
Na l a mp
pl ane i s
r ot at ed
anal yzer anal yzer
pl ane -pol ar i zed
l i ght
obser ved
r ot at i on
0
0
0
0
0
0
0
0
0
0
r ot at e t o nul l
35
Rotao especfica ( )
[ ] =
lc
( para solues ) e [ ] =
ld
( para substncias puras )
- rotao observada
l- comprimento da clula (decmetros)
c- concentrao (g/mL)
d- densidade
[]
D
rotao foi medida com a luz D de sdio (= 589 nm).
Pureza ptica
A pureza ptica uma medida do excesso de um enantimero sobre outro
em uma amostra opticamente ativa. Um composto opticamente puro 100% de um
enantimero. Uma mistura racmica 0% em pureza ptica (j que os 50% de um
enantimero cancela a atividade ptica dos 50% do outro enantimero).
Por outro lado, uma amostra opticamente ativa que contenha 75% de um
enantimero dextrgiro (+) e 25% do levgiro (-) ser somente 50% opticamente
pura. Isto : 25% do enantimero (+) cancelar a atividada ptica dos 25% de
enantimero (-), sobrando 50% do enantimero (+) responsvel pela rotao do
plano de luz polarizada.
A porcentagem de pureza ptica se mede comparando a rotao especfica
da amostra, com aquela do estereoismero puro o []
max
e aplicando a seguinte
equao:
% Pureza Optica =
[]
D
muestra
t
0
C
[]
D
enantimero puro
t
0
C
x 100
Por exemplo, para cada enantimero de cido lctico as rotaes especficas
a 15
0
C so respetivamente:
Acido-(-)-lctico
[]
D
=
3.82
0 15
0
C
Acido-(+)-lctico
[]
D
=
3.82
0 15
0
C
36
Ento, uma amostra de cido lctico com 50% de pureza ptica produz uma
rotao especfica de +1.91
0
ou -1.91
0
(0.5 x 3.82) dependendo de qual enantimero
se encontra em excesso.
Assumindo que h uma relao linear entre a rotao especfica [] e a
concentrao dos enantimeros (o qual certo para a maioria dos casos), a pureza
ptica tambm igual porcentagem em excesso de um enantimero sobre o outro:
% Pureza Optica = porcentagem em excesso =
[ ( ) ] [ ( ) ]
x 100
[ ( ) ] [ ( ) ]
= % [ ( ) ] % [ ( ) ]
Obs: com o advento da cromatografia quiral a determinao da pureza ptica pelo
mtodo acima ficou totalmente obsoleto, pois atravs da cromatografia quiral pode-
se obter rapidamente as propores entre os enantimeros e conseqentemente a
pureza ptica de maneira incontestvel.
37
Quais Tipos de Molculas Mostram Atividade tica?
A descoberta de Pasteur (Louis Pasteur 1848, Sorbonne, Paris)
HOOC C H CH COOH
OH OH
OOC CH C H COO
OH OH
N H
4
Na
+ +
2-
cido tartrico
Tartarato de amnio e sdio
( Obt i do ndust r i al ment e)
Pasteur cristalizou esta
substncia num dia frio.
Pasteur encontrou dois diferentes cristais. Louis Pasteur separou esses
cristais e os encaminhou para Biot medir a atividade ptica de cada um deles.
(+) (-)
Resul tado de Bi ot :
Faces hemi-hedral
Pasteur decidiu que as molculas que faziam os cristais, assim como os
cristais, deveriam tambm ser imagens especulares uma da outra. Cada cristal,
portanto, deveria conter um simples tipo de enantimero.
38
A descoberta de Pasteur do enanciomerismo e sua demonstrao de que a
atividade ptica das duas formas do cido tartrico era uma propriedade das
molculas levou, em 1874, proposta da estrutura tetradrica do carbono por vant
Hoff e Le Bel.
Somente a geometria tetradirca pode l evar as
Mol cul as serem i magens especul ares:
C
C C
Carbono
tetradrico
Vant Hoff e
LeBel (1874)
Molculas possuindo um plano de simetria so sempre oticamente inativas,
mas existem uns poucos casos nos quais molculas no tm um plano de simetria e
so contudo inativas. Tais molculas possuem um centro de simetria, tal como o
cido -truxlico (exemplo c), ou um eixo alternado de simetria como no exemplo d
(subunidade 1.2, pgina 4). Um centro de simetria um ponto dentro de um objeto
tal que uma linha reta desenhada de qualquer parte ou elemento do objeto para o
centro e estendida a uma distncia igual no outro lado encontra uma parte igual. Um
eixo de simetria alternado de ordem n um eixo tal que quando um objeto contendo
tal eixo girado por 360
o
/n em torno do eixo e ento uma reflexo efetuada
transversalmente a um plano em ngulo reto ao eixo, um novo objeto obtido que
indistinguvel daquele original (veja mais detalhadamente na subunidade 1.2).
Uma molcula que contm somente um carbono quiral (definida como um
tomo de carbono conectado quatro grupos diferentes; tambm chamado de
tomo de carbono assimtrico) sempre quiral e da oticamente ativo. Contudo, a
presena de um carbono quiral no uma condio nem necessria e nem
suficiente para atividade tica, uma vez que atividade tica pode estar presente em
39
molculas sem tomo quiral (veja a subunidade 1.6) e uma vez que molculas com
dois ou mais tomos de carbono quiral so superponveis sobre suas imagens
especulares e da inativas (subunidade 1.3).
Rot aes Espec f i cas Par a Al guns Compost os Rot aes Espec f i cas Par a Al guns Compost os Bi ol o Bi ol o - -
gi cament e gi cament e At i vos At i vos
cholesterol -31.5
cocaine -16
morphine -132
codeine -136
heroin -107
epinephrine -5.0
progesterone +172
testosterone +109
sucrose +66.5
-D-glucose +18.7
-D-glucose +112
oxacillin +201
COMPOSTOS COMPOSTOS [ [ ] ]
D D
Quadro Retirado do site: http://www.chem.wwu.edu/dept/facstaff/pavia/paviacourses.shtml
40
1.10- A PROJEO DE FISCHER
Para um entendimento completo de estereoqumica til examinar modelos
moleculares. Contudo, no praticvel quando estamos escrevendo no papel ou no
quadro. Em 1891 Emil Fischer serviu grandemente os interesses da qumica
inventando a projeo de Fischer, um mtodo de representar carbonos tetradricos
no papel. Por esta conveno, o modelo mantido de tal forma que as duas
ligaes na frente do papel horizontal e aquelas atrs do papel so verticais.
CHO CHO
HOCH
2
HOCH
2
H
OH
OH H
CHO CHO
CH
2
OH CH
2
OH
H
CH
2
OH
CHO
OH
Pr oj eo de Fi scher
Pr oj e o c av al et e
Veja com modelos moleculares:
41
O R I E N T A O D A
CA DE I A P RI NCI P A L
E D OS S U B S T I T U I N T E S
N A P R O J E O
D E F I S C H E R
cont i nuao
da cadei a pr i nci pal
CH
3
OH H
OH H
OH H
CH
3
OH
OH
OH
H
H
H
Como obter a projeo de Fischer a partir de outras projees:
a)
H H
CH
3
CH
3
Cl Br
H H
CH
3
CH
3
Cl Br
CH
3
CH
3
H
H
Cl
Br
Cl
CH
3
Br
CH
3
Cadei a pr i nci pal em ver mel ho
Col ocar a cadei a pri nci pal
verticalmente
Converter
Para a
Proj eo de
Fischer
rotate
90
o
Br
Cl
CH
3
H
H
42
b)
H
OHC
OH
CH
2
OH
HO
H
CH
2
OH
CHO
HO
OH
H
H
H
CHO
HO
CH
2
OH
HO
H
CH
2
OH
CHO
H OH
HO H
CHO
CH
2
OH
HO H
H OH
180
o
De forma a obter resultados adequados atravs destas frmulas, deveria ser
relembrado que elas so projees e devem ser tratadas diferentemente de modelos
quando testamos superponibilidade. Todo plano superponvel na sua imagem
especular; da com estas frmulas devemos fazer algumas restries.
Restries para as frmulas de Fischer:
1. No devem ser retiradas do plano do papel ou quadro;
2. Elas no podem ser giradas de 90
o
, embora 180
o
permitido:
180
o
CHO
OH
OH
CH
2
OH
CH
2
OH
HO
HO
CHO
.
3. permitido manter qualquer grupo fixo e girar os outros trs nos sentido
horrio ou anti-horrio:
CHO
H
HO H
HO CH
2
OH
CHO
CH
2
OH
HO H
H OH
43
C H
3
CH
2
OH CH
C
OH
O
C HO COOH
C
O
H
C
O
OH
AUMENTANDO O ESTADO DE OXI DAO AUMENTANDO O ESTADO DE OXI DAO
Estado de oxi dao cresce
Na pr oj e o de Fi s her a c adei a pr i nc i pal or i ent ada de manei r a q u e o g r u p o
c o m o ma i o r e s t a d o d e o x i d a o f i q u e n o t o p o d o d e s e n h o .
C = O o n c a r b o n- 2 i nc r eas es
t he pr i or i t y of C - O H
Rotaes podem ser usados para comparaes.....
3
A
A e A* so enantimeros ?
C
H
3
B r
B r
C H
C H
1) reflexo
A*
3
B r
B r
C H
3
C H
1) reflexo
A*
3
B r
B r
C H
3
H C
2) giro
3
B r
B r
C H
3
H C
2) giro
3
B r
B r
C H
3
3) comparao 3) comparao
44
COOH
OH
OH
OH
OH
COOH
F U R T H E R H OME S T U D Y
Fi nd al l of t he st er eoi somer s f or t hi s c ompound . Gr oup al l enant i omer s in pai r s . Ar e t her e any
me s o st er eoi somer s ?
Wi l l y ou f i nd 1 6 ( 2
4
= 1 6 )
st er eoi somer s? Wh y o r
why not ?
45
1.11- CONFIGURAO ABSOLUTA
Suponha que temos dois tubos de ensaio, um contendo (-)-cido ltico e o
enantimero (+).
Um tubo contm I e o outro II.
H
HO
2
C
OH
CH
3
(-)-cido ltico
[]
25
o
C
D = -3,8
H
HO
2
C
CH
3
OH
(+)-cido ltico
[]
25
o
C
D = +3,8
Tubo I
Tubo II
Como ns saberemos qual qual? Qumicos no incio do sculo ponderaram
sobre este problema e decidiram que eles no podiam saber - para o cido ltico ou
qualquer outra substncia. Portanto Rosanoff props que uma substncia fosse
escolhida como padro e uma configurao fosse arbitrariamente atribuda a ele. A
substncia escolhida foi o gliceraldedo por causa de sua relao com acares. Ao
ismero (+) foi atribuda a configurao mostrada em III e dado o rtulo D
(atualmente R pelo sistema R/S). O ismero (-), designado para ser IV, foi dado o
rtulo L (S).
Exemplo:
CHO
CH
2
OH
H OH
(+)- Gliceraldedo
D
III
CHO
CH
2
OH
HO H
(-)- Gliceraldedo
L
IV
46
Por exemplo, (+)-gliceraldedo, oxidado com xido de mercrio, fornece (-)-
cido glicrico:
CHO
CH
2
OH
H OH
(+)- Gliceraldedo
CO
2
H
CH
2
OH
H OH
(-)- cido glicrico
HgO
Uma vez que altamente improvvel que a configurao do tomo de
carbono central seja alterada, pode-se concluir que (-)-cido glicrico tem a mesma
configurao que (+)-gliceraldedo e portanto (-)-cido glicrico tambm chamado
D. Este exemplo enfatiza que molculas com a mesma configurao no precisam
girar o plano da luz polarizada na mesma direo.
Uma vez que a configurao dos cidos glicricos foi conhecida (em relao
aos gliceraldedos), foi ento possvel relacionar outras substncias a um ou outro
destes, e cada vez que uma nova substncia foi relacionada, outras poderiam ser
relacionadas a ela. Desta maneira centenas de substncias foram relacionadas,
indiretamente, ao D- ou L-gliceraldedo, e foi determinado que III, o qual tem a
configurao D, o ismero que gira o plano da luz polarizada para a direita.
Mesmo substncias sem tomos assimtricos, tais como bifenilas e alenos,
tm sido colocados nas sries D ou L. Quando uma substncia era colocada nas
sries D ou L, sua configurao absoluta era dita ser conhecida.
Em 1951 tornou-se possvel determinar se a suposio de Rosanoff estava
correta. Cristalografia de raios-X comum no pode distinguir entre um ismero D ou
L, mas pelo uso de uma tcnica especial, Bijvoet foi capaz de examinar tartarato de
sdio e rubdio e descobriu que Rosanoff tinha feito a escolha correta. Foi
historicamente adequado que a primeira configurao absoluta tivesse sido
determinada num sal de cido tartrico, uma vez que Pasteur fez suas grandes
descobertas num outro sal deste cido.
47
Resumindo:
48
O Sistema Cahn-Ingold-Prelog
1) Especificao de Configurao: a mais comum origem da dissimetria
molecular em molculas orgnicas a presena de um ou mais centros quirais (ou
centros assimtricos), ou seja, tomos de carbono saturado sustentando quatro
diferentes substituintes.
A configurao de um centro quiral atualmente especificada pelo sistema
Cahn-Ingold-Prelog.
Sistema Cahn-Ingold-Prelog: os ligantes do centro quiral so assinalados
numa ordem de prioridade:
1. Quanto maior o nmero atmico do tomo diretamente ligado, maior a
prioridade;
2. Se dois tomos so istopos, aquele com maior massa atmica tem maior
prioridade;
3. Um par de eltrons no compartilhados tratado como um tomo ligante
de nmero atmico zero;
4. Se dois tomos ligados so os mesmos, os tomos ligados a eles so
comparados, e assim por diante, at a prioridade puder ser estabelecida;
5. Ligaes mltiplas so trocadas por ligaes simples, com ambos tomos
considerados para serem duplicados ou triplicados.
Visualiza-se a molcula ao longo da ligao do centro quiral para o grupo de
mais baixa prioridade, com o centro quiral na frente do grupo de baixa prioridade. Se
os grupos restantes, partindo da mais alta prioridade para a mais baixa, esto
arranjados no sentido horrio, o centro R; se so anti-horrio, S.
2
c l oc k wi s e
c o u n t e r
c l oc k wi s e
( r ect us )
( s i ni s t er)
1
2
4
3
C
C
1
4
3
R S
49
6. Grupos prximos tomam preferncia sobre todos os distantes.
Usando a projeo de Fischer para denotar a configurao
absoluta pelo sistema R/S:
Exemplo:
Coloque o grupo ou tomo com prioridade = 4 em uma das posies verticais
e olhe para os outros 3 restantes:
H
CH
2
OH
CHO
OH
H
OH
OHC CH
2
OH
1
2
3
4
1
2
3
4
R
alternativamente:
H
CH
2
OH
CHO
OH
1
2
3
4
HOCH
2
CHO
OH
2
1
4
3
H
R
#4 no topo #4 no topo
#4 em bai xo #4 em bai xo
AMBOS D
O MESMO
RESUL TADO
Você também pode gostar
- Exercícios - Quiralidade e EstereoisomeriaDocumento3 páginasExercícios - Quiralidade e Estereoisomeriamaria fernanda alvesAinda não há avaliações
- Injeção Eletrônica - SensoresDocumento35 páginasInjeção Eletrônica - Sensoresguilhermediasdemarchi691695% (20)
- OXIDOSDocumento38 páginasOXIDOSjparatyAinda não há avaliações
- Teoria X BarraDocumento10 páginasTeoria X BarraFabiola ZdepskiAinda não há avaliações
- Biofisica PDFDocumento192 páginasBiofisica PDFMyrtes Fabiana Miranda100% (1)
- 0000 PDFDocumento241 páginas0000 PDFneivaprojetosAinda não há avaliações
- Aula 8 EstereoquímicaDocumento58 páginasAula 8 EstereoquímicaThiago TakeoAinda não há avaliações
- Resumo Sobre EstereoquímicaDocumento7 páginasResumo Sobre EstereoquímicaRobson Timoteo DamascenoAinda não há avaliações
- Listas de Exercícios de Reações Orgânicas - 1-1Documento10 páginasListas de Exercícios de Reações Orgânicas - 1-1João BalbinoAinda não há avaliações
- Estereoquímica PDFDocumento44 páginasEstereoquímica PDFRonaldo RochaAinda não há avaliações
- Estudo Do Grupo Do Grupo 16Documento6 páginasEstudo Do Grupo Do Grupo 16Dimas BritoAinda não há avaliações
- Práticas de Química OrgânicaDocumento18 páginasPráticas de Química OrgânicaLeonardoAinda não há avaliações
- c6 Curso A Prof QuimicaDocumento20 páginasc6 Curso A Prof QuimicaTiago RodriguesAinda não há avaliações
- 09 - Cadeias Carbônicas e HidrocarbonetosDocumento8 páginas09 - Cadeias Carbônicas e HidrocarbonetosJulio CesarAinda não há avaliações
- Química - Estudo Dos GasesDocumento31 páginasQuímica - Estudo Dos GasesKaaueAinda não há avaliações
- Noções Gerais de RedoxDocumento14 páginasNoções Gerais de RedoxAna Paula Oliveira MartinsAinda não há avaliações
- Apostila SoluçõesDocumento31 páginasApostila Soluçõessardinha2Ainda não há avaliações
- Funções Inorgânicas ApostilaDocumento11 páginasFunções Inorgânicas ApostilaPriscila Tibúrcio100% (1)
- Química Orgânica 1Documento11 páginasQuímica Orgânica 1Maria Eduarda FontAinda não há avaliações
- EletroquimicaDocumento25 páginasEletroquimicaMARCIA FERREIRA BINIAinda não há avaliações
- Resumo Sobre Estereoquímica - VDocumento7 páginasResumo Sobre Estereoquímica - VRobson Timoteo DamascenoAinda não há avaliações
- ISOMERIADocumento17 páginasISOMERIAPalloma Almeida100% (2)
- Microsoft Word - Des Fisicas-Exercicios ResolvidosDocumento3 páginasMicrosoft Word - Des Fisicas-Exercicios ResolvidosFábio De Pádua FerreiraAinda não há avaliações
- Reacoes OrganicasDocumento62 páginasReacoes OrganicasLarissa SantosAinda não há avaliações
- Reações de Eliminação E1 & E2-V2Documento27 páginasReações de Eliminação E1 & E2-V2Eti SilvaAinda não há avaliações
- Aula Simetria Molecular PDFDocumento20 páginasAula Simetria Molecular PDFGuilherme Camelier Almeida100% (3)
- 2023 Química 2 Série Aula 03 Número de OxidaçãoDocumento15 páginas2023 Química 2 Série Aula 03 Número de OxidaçãoRodrigo de Souza RochaAinda não há avaliações
- LISTA DE EXERCÍCIOS - FUNÇÕES OXIGENADAS R - 2º TRIMESTREDocumento4 páginasLISTA DE EXERCÍCIOS - FUNÇÕES OXIGENADAS R - 2º TRIMESTREkakayolimaAinda não há avaliações
- Massa Molar Viscosimétrica 1 Determinação Da Massa Molar Viscosimétrica (M VDocumento9 páginasMassa Molar Viscosimétrica 1 Determinação Da Massa Molar Viscosimétrica (M VThiago CunhaAinda não há avaliações
- Ter - Equi - A08 - As Propriedades Das Misturas SimplesDocumento28 páginasTer - Equi - A08 - As Propriedades Das Misturas SimplesNaty BarbosaAinda não há avaliações
- Lei de Hess - Exercícios de Revisão PDFDocumento7 páginasLei de Hess - Exercícios de Revisão PDFGeliane RochaAinda não há avaliações
- Familia Dos Halogenios 1Documento26 páginasFamilia Dos Halogenios 1Augusto ManuelAinda não há avaliações
- Leis PonderaisDocumento14 páginasLeis PonderaisJorge Henrique DiasAinda não há avaliações
- 25 20mol 20e 20massa 20molarDocumento28 páginas25 20mol 20e 20massa 20molarGustavoAinda não há avaliações
- ProblemasDocumento36 páginasProblemaschipausckis132100% (1)
- Aula 8 - Geometria MolecularDocumento32 páginasAula 8 - Geometria MolecularCliciane PeixotoAinda não há avaliações
- Apostila QUIMICA ORGANICADocumento73 páginasApostila QUIMICA ORGANICAJoiceRodolphoAinda não há avaliações
- Massa Molecular, Mol e Massa Atomica.Documento6 páginasMassa Molecular, Mol e Massa Atomica.Zalex Ribb'sAinda não há avaliações
- A1Documento31 páginasA1Rafael Brognoli Recco100% (1)
- Química PPT - Reações de SubstituiçãoDocumento26 páginasQuímica PPT - Reações de SubstituiçãoQuímica PPT100% (2)
- Apostila de QuimicaDocumento29 páginasApostila de QuimicaAndré MirandaAinda não há avaliações
- Balanceamento Por OxirreduçãoDocumento4 páginasBalanceamento Por OxirreduçãoSimone Teixeira LozanoAinda não há avaliações
- Modulo 1 Quimica 2023 AtualizadoDocumento32 páginasModulo 1 Quimica 2023 AtualizadoThaynara BarrosAinda não há avaliações
- Lista Exercícios - Equilíbrios QuímicosDocumento4 páginasLista Exercícios - Equilíbrios QuímicosDaiane CambriaiAinda não há avaliações
- Propriedades Coligativas PDFDocumento22 páginasPropriedades Coligativas PDFMichelle PradosAinda não há avaliações
- (Apostila) Química Orgânica - CETEBDocumento110 páginas(Apostila) Química Orgânica - CETEBEduardo Bandeira50% (2)
- Balanceamento de Equações QuímicasDocumento2 páginasBalanceamento de Equações Químicas130702jv100% (1)
- Ligações Quimicas - Quimica GeralDocumento52 páginasLigações Quimicas - Quimica GeralYurick Wênio Melo de QueirozAinda não há avaliações
- Química 04 - Tabela Periódica PDFDocumento5 páginasQuímica 04 - Tabela Periódica PDFJonathan AraújoAinda não há avaliações
- Exercícios+isomeriaDocumento9 páginasExercícios+isomeriaBruno SantosAinda não há avaliações
- Química - Pré-Vestibular Impacto - Tabela Periódica - Classificação Dos Elementos IIDocumento2 páginasQuímica - Pré-Vestibular Impacto - Tabela Periódica - Classificação Dos Elementos IIQuímica Qui100% (1)
- Aula - GasesDocumento48 páginasAula - Gasesisrael silvaAinda não há avaliações
- Quimica Organica Mecanismos de ReacaoDocumento136 páginasQuimica Organica Mecanismos de Reacaotoraqk5297100% (1)
- Simetria EQDocumento37 páginasSimetria EQLucas ScheuerAinda não há avaliações
- Aula 2 Simetria MolecularDocumento86 páginasAula 2 Simetria MolecularKarla Isa100% (1)
- Elementos de Simetria - UfsmDocumento9 páginasElementos de Simetria - UfsmMariana SilvaAinda não há avaliações
- APOSTILA - Teoria de Grupo e SimetriaDocumento45 páginasAPOSTILA - Teoria de Grupo e SimetriajosemeriAinda não há avaliações
- Aula 2 Simetria Molecular e Teoria de GrupoDocumento85 páginasAula 2 Simetria Molecular e Teoria de GrupoLaiselpAinda não há avaliações
- Teoria de Grupos e EspectroDocumento12 páginasTeoria de Grupos e EspectroDouglas AlonsoAinda não há avaliações
- Teoria de GruposDocumento66 páginasTeoria de GruposGabriella Gaby100% (1)
- Simetria Molecular - FundamentosDocumento36 páginasSimetria Molecular - FundamentosCelyna IasminAinda não há avaliações
- Ebook MBDocumento101 páginasEbook MBHenrique CorreiaAinda não há avaliações
- Aula 8 - 7º MAT - Expressões AlgébricasDocumento10 páginasAula 8 - 7º MAT - Expressões AlgébricasJeane SilvaAinda não há avaliações
- Código Da Placa de Diagnóstico Da PlacaDocumento8 páginasCódigo Da Placa de Diagnóstico Da PlacaBRTech Soluções em TecnologiasAinda não há avaliações
- Zeros Funcoes AplicacoesDocumento2 páginasZeros Funcoes AplicacoesJoão Lucas Souza GuimarãesAinda não há avaliações
- Ficha de Revisã 7 Classe.Documento2 páginasFicha de Revisã 7 Classe.Evaristo Das Mangas0% (1)
- Relatorio de Densidade - Fisica ExperimentalDocumento11 páginasRelatorio de Densidade - Fisica ExperimentalrockminasgeraisAinda não há avaliações
- PCM - Aula 04 - Árvore de AtivosDocumento29 páginasPCM - Aula 04 - Árvore de AtivosDenis O. Guedes100% (1)
- Rede Predial de ÁguaDocumento33 páginasRede Predial de ÁguaRui Gavina100% (1)
- Lista HiperestáticaDocumento2 páginasLista HiperestáticaAn100% (1)
- Genie - PlataformasDocumento17 páginasGenie - PlataformascaquirinoAinda não há avaliações
- Cap 10Documento40 páginasCap 10Lucio MacedoAinda não há avaliações
- Ok - 3 001 011008 Transmissão W20eDocumento27 páginasOk - 3 001 011008 Transmissão W20enicholasyureAinda não há avaliações
- Gasometria Arterial SanarDocumento14 páginasGasometria Arterial Sanarfrente.gas.aracariguamaAinda não há avaliações
- Thunderbird InstructionsDocumento2 páginasThunderbird InstructionsBackes BAinda não há avaliações
- Apostila Saberes MatemticaDocumento20 páginasApostila Saberes Matemticajaspernambuco6741Ainda não há avaliações
- Aula 7 - Descrição de Circuitos LógicosDocumento33 páginasAula 7 - Descrição de Circuitos LógicosIsrael Isaac LopesAinda não há avaliações
- O Que É Física - Brasil EscolaDocumento25 páginasO Que É Física - Brasil EscolaEduardo Luís MüllerAinda não há avaliações
- Aula 2b - Resoluà à o Da PL-gráficaDocumento6 páginasAula 2b - Resoluà à o Da PL-gráficaIstéfani RamalhoAinda não há avaliações
- Integrais Duplas - Revisão Integrais SimplesDocumento6 páginasIntegrais Duplas - Revisão Integrais SimplesGilson BragaAinda não há avaliações
- Atron 2324 (Modulo SCR)Documento3 páginasAtron 2324 (Modulo SCR)asantana_36882Ainda não há avaliações
- 3EM-Consumo de Energia EletricaDocumento2 páginas3EM-Consumo de Energia EletricaEnilton Sousa AlvesAinda não há avaliações
- Manual de Instalações Elétricas Residenciais Part1Documento9 páginasManual de Instalações Elétricas Residenciais Part1walterAinda não há avaliações
- 4 Lista de Exercício de Cálculo AvançadoDocumento2 páginas4 Lista de Exercício de Cálculo AvançadoNayanderson RibeiroAinda não há avaliações
- Clean Code - JavascriptDocumento12 páginasClean Code - JavascriptDouglas Lira100% (1)
- 443 Analise Comparativa Entre Lajes Macicas e Lajes Nervuradas para EdificDocumento15 páginas443 Analise Comparativa Entre Lajes Macicas e Lajes Nervuradas para EdificMarcelo OliveiraAinda não há avaliações