Escolar Documentos
Profissional Documentos
Cultura Documentos
Exercícios - Quiralidade e Estereoisomeria
Enviado por
maria fernanda alvesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Exercícios - Quiralidade e Estereoisomeria
Enviado por
maria fernanda alvesDireitos autorais:
Formatos disponíveis
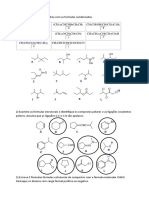
5.33 Quais dos seguintes compostos são quirais e, portanto, grupos metila representados por Me).
Dê a configuração (R/S) do
capazes de existir como enantiômeros? enantiômero que você desenhou.
(a) 1,3-Diclorobutano
(b) 1,2-Dibromopropano
(c) 1,5-Dicloropentano
(d) 3-Etilpentano
(e) 2-Bromobiciclo[1.1.0]butano
(f) 2-Fluorbiciclo[2.2.2]octano 5.37 (a) Escreva a estrutura do 2,2-diclorobiciclo[2.2.1]heptano.
(b) Quantos centros de quiralidade ele contém? (c) Quantos
(g) 2-Clorobiciclo[2.1.1]hexano estereoisômeros são previstos pela regra do 2n? (d) Apenas um
(h) 5-Clorobiciclo[2.1.1]hexano par de enantiômeros é possível para o 2,2-
diclorobiciclo[2.2.1]heptano. Explique.
5.34 (a) Quantos átomos de carbono um alcano (que não seja um
cicloalcano) precisa ter para ser capaz de existir em formas 5.38 A seguir, são mostradas fórmulas de projeção de Newman
enantioméricas? (b) Dê nomes corretos para dois conjuntos de para (R,R)-, (S,S)- e (R,S)-2,3-diclorobutano. (a) Qual é qual? (b)
enantiômeros com esse número mínimo de átomos de carbono. Que fórmula corresponde a um composto meso?
5.35 Dê a configuração (R) ou (S) de cada centro de quiralidade
nas moléculas vistas a seguir.
5.39 Desenhe fórmulas estruturais adequadas para (a) uma
molécula cíclica que é um isômero constitucional do ciclo-hexano,
5.36 Albuterol (ou salbutamol), mostrado ao lado, é um (b) moléculas com a fórmula C 6 H 12 que contenham um anel e
medicamento comumente prescrito contra a asma. Para cada que sejam enantiômeros entre si, (c) moléculas com a fórmula
enantiômero do albuterol, desenhe uma fórmula tridimensional, C 6 H 12 que contenham um anel e que sejam diastereoisômeros
usando cunhas sólidas e tracejadas para as ligações que não entre si, (d) moléculas com a fórmula C 6 H 12 que não contenham
estão no plano do papel. Escolha uma perspectiva que permita anéis e que sejam enantiômeros entre si e (e) moléculas com a
que o maior número possível de átomos de carbono fique no fórmula C 6 H 12 que não contenham anéis e que sejam
plano do papel e mostre todos os pares de elétrons não diastereoisômeros entre si.
compartilhados e os átomos de hidrogênio (exceto aqueles dos
5.40 Considere cada um dos pares de estruturas vistos a seguir. 5.42 Estabeleça se os compostos de cada par são enantiômeros,
Dê a configuração (R,S) de cada centro de quiralidade e, também, diastereoisômeros, isômeros constitucionais ou não são isômeros.
a relação isomérica entre eles, como sendo enantiômeros,
diastereoisômeros, isômeros constitucionais ou duas moléculas
do mesmo composto. Use um kit de montagem de modelos
moleculares para conferir suas respostas.
5.43 Um composto D com fórmula molecular C 6 H 12 é
opticamente inativo, mas pode ser resolvido em enantiômeros.
Por hidrogenação catalítica, D é convertido em E (C 6 H 14 ) e E é
opticamente inativo. Proponha estruturas para D e E.
5.44 Um composto F com fórmula molecular C 5 H 8 é opticamente
ativo. Por hidrogenação catalítica, F é convertido em G (C 5 H 12 ) e
G é opticamente inativo. Proponha estruturas para F e G.
5.45 Um composto H com fórmula molecular C 6 H 10 é
opticamente ativo. Por hidrogenação catalítica, H é convertido em
I (C 6 H 12 ) e I é opticamente inativo. Proponha estruturas para H e
I.
5.46 O aspartame é um adoçante artificial. Dê a configuração
(R,S) para cada centro de quiralidade do aspartame.
5.41 Discuta a estereoquímica de cada um dos compostos vistos
a seguir.
processo do item (a) para o cis-1,2-dietilciclo-hexano. (e) Essas
estruturas são sobreponíveis? (f) Elas são interconversíveis?
5.50 (Use modelos para resolver este problema.) (a) Desenhe
uma estrutura tridimensional para a conformação mais estável do
trans-1,4-dietilciclo-hexano e desenhe sua imagem especular. (b)
Essas estruturas são sobreponíveis? (c) Elas representam um par
de enantiômeros? (d) O trans-1,4-dietilciclo-hexano tem um
estereoisômero e, em caso afirmativo, qual? (e) Esse
estereoisômero é quiral?
5.51 (Use modelos para resolver este problema.) Desenhe
5.47 Existem quatro isômeros dimetilciclopropano. (a) Desenhe estruturas conformacionais para todos os estereoisômeros do 1,3-
fórmulas tridimensionais para esses isômeros. (b) Quais isômeros dietilciclo-hexano. Identifique os pares de enantiômeros e os
são quirais? (c) Se uma mistura consistindo em 1 mol de cada um compostos meso, caso existam.
desses isômeros fosse submetida à cromatografia em fase
gasosa simples (um método analítico que pode separar PROBLEMAS DE DESAFIO
compostos de acordo com o ponto de ebulição), quantas frações
5.52 O ácido tartárico [HO 2 CCH(OH)CH(OH)CO 2 H] foi um
seriam obtidas e quais compostos cada fração conteria? (d)
composto importante na história da estereoquímica. Duas formas
Quantas dessas frações seriam opticamente ativas?
de ocorrência natural do ácido tartárico são opticamente inativas.
5.48 Considerando a molécula a seguir, desenhe seu enantiômero Uma forma opticamente inativa tem ponto de fusão de 210–212
e um de seus diastereoisômeros. Dê a configuração (R,S) para °C, a outra, ponto de fusão de 140 °C. O ácido tartárico inativo
cada centro de quiralidade. com ponto de fusão de 210–212 °C pode ser separado em duas
formas opticamente ativas de ácido tartárico com o mesmo ponto
de fusão (168–170 °C). Um ácido tartárico opticamente ativo tem
, e o outro, . No caso do outro ácido tartárico
inativo (ponto de fusão = 140 °C), todas as tentativas para separá-
lo em compostos opticamente ativos falharam. (a) Desenhe a
estrutura tridimensional para o ácido tartárico com ponto de fusão
5.49 (Use modelos para resolver este problema.) (a) Desenhe
de 140 °C. (b) Desenhe estruturas para os ácidos tartáricos
uma estrutura tridimensional para a conformação mais estável
opticamente ativos com pontos de fusão de 168–170 °C. (c) A
dotrans-1,2-dietilciclo-hexano e desenhe sua imagem especular.
partir das fórmulas em (b), é possível determinar qual ácido
(b) Essas duas moléculas são sobreponíveis? (c) Elas podem ser
tartárico tem rotação positiva e qual tem rotação negativa? (d)
interconvertidas por interconversão de cadeira? (d) Repita o
Qual é a natureza da forma do ácido tartárico com ponto de fusão
de 210–212 °C?
Você também pode gostar
- Estereoquímica exercíciosDocumento8 páginasEstereoquímica exercíciosIndi Assis RodriguesAinda não há avaliações
- Estereoquímica exercícios propostosDocumento4 páginasEstereoquímica exercícios propostosAna AraújoAinda não há avaliações
- EstequiometriaDocumento49 páginasEstequiometriafernando AndradeAinda não há avaliações
- Lista Cap07 20231o - GabaritoDocumento7 páginasLista Cap07 20231o - GabaritoPedro Henrique100% (1)
- Fundamentos teóricos das reações orgânicasDocumento136 páginasFundamentos teóricos das reações orgânicasrbeckert100% (4)
- Aula 02 - Ligações Químicas Nos Complexos de Metais de TransiçãoDocumento56 páginasAula 02 - Ligações Químicas Nos Complexos de Metais de TransiçãoRaiana Canzian Lima100% (2)
- Aula Simetria Molecular PDFDocumento20 páginasAula Simetria Molecular PDFGuilherme Camelier Almeida100% (3)
- Estudo dos Gases e suas Propriedades TermodinâmicasDocumento19 páginasEstudo dos Gases e suas Propriedades TermodinâmicasGuilhermeAinda não há avaliações
- SistInsConjDocumento69 páginasSistInsConjPedro Morais100% (1)
- Cinética QuímicaDocumento29 páginasCinética QuímicaProfessoraGianiAinda não há avaliações
- Isomerização ácido malêico fumáricoDocumento1 páginaIsomerização ácido malêico fumáricoPaulo Henrique Neri CamposAinda não há avaliações
- Aula 2 Simetria MolecularDocumento86 páginasAula 2 Simetria MolecularKarla Isa100% (1)
- Cap 17Documento53 páginasCap 17danieleportuAinda não há avaliações
- Quimica Organica Exercicios Classificacao Nomenclatura GabaritoDocumento26 páginasQuimica Organica Exercicios Classificacao Nomenclatura GabaritoRones DiasAinda não há avaliações
- Quimica - Organica II Reação EliminaçãoDocumento54 páginasQuimica - Organica II Reação EliminaçãoQuímica Qui100% (6)
- Geometria ÁtomoDocumento4 páginasGeometria Átomoemarchesi2012Ainda não há avaliações
- Listas de Exercícios de Reações Orgânicas - 1-1Documento10 páginasListas de Exercícios de Reações Orgânicas - 1-1João BalbinoAinda não há avaliações
- Lista de Exercicios 1 PDFDocumento11 páginasLista de Exercicios 1 PDFElisangela CabralAinda não há avaliações
- Cálculo Estequiométrico - Massa - 118 QuestõesDocumento46 páginasCálculo Estequiométrico - Massa - 118 QuestõesItarralyss HericoAinda não há avaliações
- Reações Químicas: Tipos e ClassificaçãoDocumento42 páginasReações Químicas: Tipos e Classificaçãomagno garciaAinda não há avaliações
- Teoria de Grupos e Espectroscopia: Simetria em Mecânica QuânticaDocumento66 páginasTeoria de Grupos e Espectroscopia: Simetria em Mecânica QuânticaGabriella Gaby100% (1)
- Química de CoordenaçãoDocumento5 páginasQuímica de CoordenaçãoAnderson Ribeiro100% (2)
- Vichagas-Exercícios ComplexosDocumento3 páginasVichagas-Exercícios Complexoscarlos201412Ainda não há avaliações
- Aula - Simetria Molecular 2016Documento80 páginasAula - Simetria Molecular 2016Joao Mesquita100% (1)
- Lista de Exercícios de Esterquiometria da Faculdade Oswaldo CruzDocumento8 páginasLista de Exercícios de Esterquiometria da Faculdade Oswaldo CruzJean Cesar BenassiAinda não há avaliações
- Exercícios Infravermelho 2013 Parte 1Documento10 páginasExercícios Infravermelho 2013 Parte 1Fernando Alves BarbozaAinda não há avaliações
- A1Documento31 páginasA1Rafael Brognoli Recco100% (1)
- Isomeria: conceitos e classificação emDocumento18 páginasIsomeria: conceitos e classificação emLaize ZaramelloAinda não há avaliações
- Solução tampão de pH 3,0 a partir de ácido acético e acetato de sódioDocumento6 páginasSolução tampão de pH 3,0 a partir de ácido acético e acetato de sódioAcisseid SaidAinda não há avaliações
- Lista de Exercícios - Ácidos Carboxílicos e DerivadosDocumento6 páginasLista de Exercícios - Ácidos Carboxílicos e DerivadosBiancaBeloAinda não há avaliações
- Lista de Exercicios 08 - Estereoisomeria BCTDocumento4 páginasLista de Exercicios 08 - Estereoisomeria BCTEdja TainaraAinda não há avaliações
- Química Orgânica - CASD - Aula12 Reações Orgânicas - IntroduçãoDocumento2 páginasQuímica Orgânica - CASD - Aula12 Reações Orgânicas - IntroduçãoQuímica Caderno de Resoluções100% (1)
- Quimica Analitica ApostilaDocumento114 páginasQuimica Analitica ApostilaMelissa AndradeAinda não há avaliações
- Quimica Organica Experimental - Relatorio 5 e 6 - Cristalização e Sublimação PDFDocumento9 páginasQuimica Organica Experimental - Relatorio 5 e 6 - Cristalização e Sublimação PDFMad ElefanteAinda não há avaliações
- Classificação de reações orgânicasDocumento20 páginasClassificação de reações orgânicasDarcy Alves0% (1)
- Apontamento 12 AnoDocumento19 páginasApontamento 12 AnoJoaquim BandeiraAinda não há avaliações
- Energias de Ligações em Compostos IônicosDocumento5 páginasEnergias de Ligações em Compostos IônicosS.V.W.M ELÉTRICAAinda não há avaliações
- Coletânea de Provas - IME/QuímicaDocumento40 páginasColetânea de Provas - IME/QuímicaFelipe MonteAinda não há avaliações
- Ácidos carboxílicos e derivadosDocumento23 páginasÁcidos carboxílicos e derivadosAngelique ViannyAinda não há avaliações
- Resolução de questões de química inorgânica ITA 1982-1983Documento151 páginasResolução de questões de química inorgânica ITA 1982-1983Diego VidalAinda não há avaliações
- Introdução aos Complexos de CoordenaçãoDocumento49 páginasIntrodução aos Complexos de CoordenaçãoMarco Aurélio100% (1)
- Explorando estereoquímica através de exercícios de reconhecimento de estruturas 3DDocumento3 páginasExplorando estereoquímica através de exercícios de reconhecimento de estruturas 3DJéssica Martins Do PradoAinda não há avaliações
- Lista de Exercicios 3Documento7 páginasLista de Exercicios 3Fabricio Dutra0% (1)
- Isômeros quirais e configuração absolutaDocumento3 páginasIsômeros quirais e configuração absolutaGenecy NazárioAinda não há avaliações
- Exercícios Química OrgânicaDocumento14 páginasExercícios Química OrgânicagoncaloabrAinda não há avaliações
- Lista de exercícios de química orgânica I sobre estereoquímicaDocumento18 páginasLista de exercícios de química orgânica I sobre estereoquímicaThais Eliel De SouzaAinda não há avaliações
- Lista de Exercícios Introdução Aos Compostos Orgânicos e ConformaçãoDocumento4 páginasLista de Exercícios Introdução Aos Compostos Orgânicos e ConformaçãoVinicius Lima0% (1)
- Lista de exercícios de estereoquímicaDocumento4 páginasLista de exercícios de estereoquímicaRafael GrossoAinda não há avaliações
- Aval FinalDocumento4 páginasAval FinalPilar Emina EminaAinda não há avaliações
- QFL-2349 - 2016 Aula 01 DienosDocumento45 páginasQFL-2349 - 2016 Aula 01 DienosMarcos Henrique Da Silva PassosAinda não há avaliações
- Lista de Exercícios de Química Orgânica IDocumento4 páginasLista de Exercícios de Química Orgânica IRokcclaneAinda não há avaliações
- Atividade 3 - EstereoquímicaDocumento12 páginasAtividade 3 - EstereoquímicacrystopharagoguiAinda não há avaliações
- Isomeria emDocumento13 páginasIsomeria emLeilanny VitoriaAinda não há avaliações
- Exercícios de Isomeria Plana Geométrica e EspacialDocumento4 páginasExercícios de Isomeria Plana Geométrica e EspacialnicolasAinda não há avaliações
- Isomeria geométrica cis-transDocumento11 páginasIsomeria geométrica cis-transFernando AMAinda não há avaliações
- Teste1 2015Documento2 páginasTeste1 2015orlando de pinaAinda não há avaliações
- Exercicios Grupos Funcionais IDocumento6 páginasExercicios Grupos Funcionais IFabricio Dutra100% (2)
- null-1Documento9 páginasnull-1Joaquim CumbaneAinda não há avaliações
- Exercícios extras de estrutura químicaDocumento4 páginasExercícios extras de estrutura químicajlopesscridbAinda não há avaliações
- Aulas Estatà SticaiDocumento56 páginasAulas Estatà SticaiJoão Paulo JPAinda não há avaliações
- Aula - Grupos Funcionais, Análise Conformacional, EstereoquimicaDocumento72 páginasAula - Grupos Funcionais, Análise Conformacional, Estereoquimicamaria fernanda alvesAinda não há avaliações
- Lista de Exercícios 8 - Cálculo IIDocumento1 páginaLista de Exercícios 8 - Cálculo IImaria fernanda alvesAinda não há avaliações
- Mapa de Risco - SSTDocumento1 páginaMapa de Risco - SSTmaria fernanda alves100% (1)
- Atividade 1 - Rotulagem de Produtos e Materiais PerigososDocumento4 páginasAtividade 1 - Rotulagem de Produtos e Materiais Perigososmaria fernanda alvesAinda não há avaliações
- Projeto FachadasDocumento1 páginaProjeto Fachadasmaria fernanda alvesAinda não há avaliações
- Exercicios Resolvidos Capitulo 5 SolomonsDocumento13 páginasExercicios Resolvidos Capitulo 5 SolomonsJaimeSilvaAinda não há avaliações
- Lista de Revisão - 3 Série - Teste - 3º Trim - 2023Documento5 páginasLista de Revisão - 3 Série - Teste - 3º Trim - 2023zuannyAinda não há avaliações
- Talidomida: teratogênica e proibidaDocumento2 páginasTalidomida: teratogênica e proibidaEvaldo XimenesAinda não há avaliações
- Aula12 Quimica3 ExercíciosDocumento16 páginasAula12 Quimica3 ExercíciosVivi BatistaAinda não há avaliações
- Isomeria em FármacosDocumento4 páginasIsomeria em FármacosJacqueline SouzaAinda não há avaliações
- Sebenta Farm 1 PDFDocumento158 páginasSebenta Farm 1 PDFMargarida MachadoAinda não há avaliações
- Lista de Exercícios 3 de Química Orgânica da UFPIDocumento3 páginasLista de Exercícios 3 de Química Orgânica da UFPISamuca LustosaAinda não há avaliações
- Nocoes de Quimica Organica 2015Documento125 páginasNocoes de Quimica Organica 2015carlosAinda não há avaliações
- VOD-Isomeria Espacial Geométrica e Optica-2019Documento22 páginasVOD-Isomeria Espacial Geométrica e Optica-2019Ysadora DônioAinda não há avaliações
- Aula 06 - EsterioquimicaDocumento26 páginasAula 06 - EsterioquimicaPenha TozziAinda não há avaliações
- Isomeria geométrica e óptica em compostos orgânicosDocumento8 páginasIsomeria geométrica e óptica em compostos orgânicosCarolina PortesAinda não há avaliações
- EstereoquímicaDocumento10 páginasEstereoquímicaLuiz Eduardo100% (2)
- Unidade - 1 - Livro - Bioquimica Basica e MetabolismoDocumento69 páginasUnidade - 1 - Livro - Bioquimica Basica e MetabolismoFabiodeangelis AngelisAinda não há avaliações
- Lista de Química Orgânica - UtfprDocumento4 páginasLista de Química Orgânica - UtfprEstela RibasAinda não há avaliações
- Farmacodinamica AlunosDocumento53 páginasFarmacodinamica AlunosMarcos DanielAinda não há avaliações
- Química Orgânica I - Lista de ExercíciosDocumento3 páginasQuímica Orgânica I - Lista de Exercícios______aAinda não há avaliações
- Isomerias: propriedades de compostos orgânicos iguaisDocumento78 páginasIsomerias: propriedades de compostos orgânicos iguaisPaulo RobertoAinda não há avaliações
- Química Orgânica: Contextualização Conhecimentos PréviosDocumento9 páginasQuímica Orgânica: Contextualização Conhecimentos Préviosanaluizainda2311Ainda não há avaliações
- Estereoquimica - 3 Unidade 2017Documento37 páginasEstereoquimica - 3 Unidade 2017Giulia EspositoAinda não há avaliações
- Química Orgânica Teórica 1B - EstereoquímicaDocumento50 páginasQuímica Orgânica Teórica 1B - EstereoquímicaCaic FigueiredoAinda não há avaliações
- 58 20isomeria 20espacial 20e 20 C3 B3ptica PDFDocumento11 páginas58 20isomeria 20espacial 20e 20 C3 B3ptica PDFRoney A. Gomes GomesAinda não há avaliações
- Farmacologia Gincana Opioides AnestésicosDocumento24 páginasFarmacologia Gincana Opioides AnestésicosAna EmíliaAinda não há avaliações
- Aula 4 - Química Orgânica - Estereoquímica-2 PDFDocumento45 páginasAula 4 - Química Orgânica - Estereoquímica-2 PDFCaic FigueiredoAinda não há avaliações
- 8 Aula Estereoquimica Parte 2Documento23 páginas8 Aula Estereoquimica Parte 2Felipe MorganAinda não há avaliações
- Estereoisomeria e propriedades químicas de compostos quiraisDocumento70 páginasEstereoisomeria e propriedades químicas de compostos quiraisbobtiAinda não há avaliações
- Estereoquímica: Isomeria e EnantiômerosDocumento27 páginasEstereoquímica: Isomeria e EnantiômerosEstefania Da Costa AquinoAinda não há avaliações
- Questions - Quimica - Isomeria - Isomeria Geometrica e Isomeria OpticaDocumento13 páginasQuestions - Quimica - Isomeria - Isomeria Geometrica e Isomeria OpticaJoão Victhor Alves De BritoAinda não há avaliações
- 3 Aula PolarimetriaDocumento19 páginas3 Aula PolarimetriajohnnatandfAinda não há avaliações
- Resumo Sobre EstereoquímicaDocumento7 páginasResumo Sobre EstereoquímicaRobson Timoteo DamascenoAinda não há avaliações
- Lista de exercícios de química orgânica I sobre estereoquímicaDocumento18 páginasLista de exercícios de química orgânica I sobre estereoquímicaThais Eliel De SouzaAinda não há avaliações