Escolar Documentos
Profissional Documentos
Cultura Documentos
Arq 665
Enviado por
kjoplin1711Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Arq 665
Enviado por
kjoplin1711Direitos autorais:
Formatos disponíveis
Estereoqumica At este ponto, vimos molculas inicialmente em duas dimenses e temos dado pouca ateno a qualquer consequncia que
possa provir do arranjo espacial de tomos em molculas. Agora hora de adicionarmos uma terceira dimenso aos nossos estudos. A estereoqumica o ramo da qumica que concerne com os aspectos tridimensionais da molcula. Vimos em muitas ocasies nas aulas anteriores que a estrutura tridimensional correta de uma molcula crucial pra determinar sua propriedade, particularmente seu comportamento biolgico. Conformao do Eteno Vimos que a rotao da ligao simples carbono-carbono, em uma molcula de cadeia aberta, como o etano, ocorre livremente mudando constantemente a rotao geomtrica dos hidrognios sobre um carbono com aqueles sobre o outro carbono.
H H C H
H C
H H C H C H
H H
Os diferentes arranjos de tomos que resultam dessa rotao so chamados conformao, e uma conformao especfica denominada ismero conformacional (ou estereoqumica). Ao contrrio, dos ismeros constitucionais, os quais possuem diferentes conexes de tomos.
H H H C C OH H H
H H
H H H
H C O C
Os diferentes ismeros conformacionais tm as mesmas conexes de tomos e no podem, geralmente, ser isolados porque eles se convertem muito rapidamente.
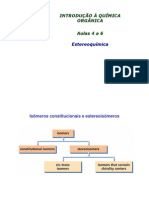
Isomerismo: Ismeros constitucionais e estereoismeros
Ismeros so compostos diferentes que tm a mesma frmula molecular. O organograma abaixo apresenta as classificaes dos ismeros:
Ismeros
Constitucionais: (ismero cujos tomos tm conectividade diferentes)
Estereoismeros: (ismeros que tm a mesma conectividade, mas diferem no arranjo de seus tomos no espao)
Enantimeros: (estereoismeros que so imagens especulares um do outro, que no se superpem)
Diastermeros: (estereoismeros que no so imagens especulares um do outro)
Ismeros Constitucionais so ismeros que diferem porque seus tomos esto conectados em uma ordem diferente. Frmula molecular C4H10 C3H7Cl
CH3CH2CH2Cl e
Ismeros constitucionais
CH3 CH3CH2CH2CH3 e CH3CH2CH3 Cl CH3CHCH3
CH3OCH3
C2H6O
CH3CH2OH e
Os
ismeros
constitucionais
como
so
compostos
diferentes
possuem
propriedades fsicas diferentes como ponto de ebulio e fuso, solubilidade. Estereoismeros so ismeros que diferem apenas no arranjo de seus tomos no espao.
Cl C C Cl
Cl C C
Cl
Cis-1,2-dicloroeteno
Trans-1,2-dicloroeteno
Os dois compostos t6em a mesma frmula molecular (C 2H2Cl) mas, so diferentes. Estereoismeros no so ismeros constitucionais porque a ordem de conexo dos tomos em ambos os compostos a mesma. Consequntemente as propriedades fsicas como P.E., P.F., solubilidade so as mesmas. Dentro dos estereoismeros podemos dividir em dois tipos: os diasteremero e enantimero. Diastermeros: so ismeros cujas molculas no so imagens especulares umas das outras.
espelho Cl C C Cl H H H H C C Cl Cl molcula especular Cl C C H Cl Cl H H C C H H Cl giro Cl giro Cl C C H mesma molcula Cl C C Cl H H
No so estereoismeros
Cl C C Cl
Cl C C
Me H
Me H
Me H
H Me
Cl
Diasteremeros No so imagens especulares um do outro
Diasteremeros No so imagens especulares um do outro
Enantimeros: so estereoismeros cujas molculas so imagens especulares umas das outras, que no se superpem.
espelho H X C Y Z H C X Z Y molcula especular
H C Y Z X H C X Z Y Compostos diferentes
Enantimeros
Enantimeros e molculas quirais
Enantimeros ocorrem apenas com compostos cujas molculas so quirais. Uma molcula quiral definida como uma que no idntica a sua imagem no espelho. Observe as molculas do tipo CH3X, CH2XY e CHXYZ.
espelho H H C H X H H C Y X H Z C Y X X H C H X H H C H X Y H C Y Z Enantimeros Compostos diferentes, as molculas no se sobrepem No so estereoismeros As molculas so idnticas so a mesma molcula quando giradas
Os enantimeros so o resultado da presena de um carbono tetradrico ligado a quatro substituintes diferentes. Por exemplo, o cido ltico (cido 2-hidroxipropanico). Ele existe como um par de enantimeros porque possui 4 grupos diferentes ligados ao tomo de carbono central.
H H3C C OH CO2H (S)
H C CH 3 CO2H OH
cido ltico (R) Produzido pelos msculos
Leite azedo
Razo para a quiralidade em molculas
Molculas que no se sobrepem com suas imagens especulares originando duas formas enantimeras so chamadas moleculas quirais (do grego no). Como prever se uma molcula ou no quiral? Uma molcula no quiral se ela contm um plano de simetria. Um plano de simetria aquele que passa pelo meio de um objeto (ou uma molcula) de forma que a metade desse objeto seja a imagem especular da outra. Por exemplo:
H C
H C H R
bola Garrafa Possui plano de simetria Molcula aquiral
H C
H C OH R
No possui plano de simetria Molcula quiral
A causa mais comum da quiralidade em uma molcula orgnica ainda que no seja a nica, a presena de um tomo de carbono ligado a quatro grupos diferentes. Esses carbonos so denominados centros de quiralidade. Por exemplo: Carbono quiral Br * CH3CH2CH2CH2CH2CCH 2 CH2CH2CH3 H Se substituir o H por:
Br CH2CH2CH2CH3 CH2CH2CH2CH2CH3 Torna a molcula aquiral
CH3
H *
CH3 O
No possui carbono quiral
Possui um carbono quiral
Os tomos de carbono nos grupos CH2-, -CH3, -C=C-, C=O e CC no podem ser centros de quiralidade.
Tpicos: Nomenclatura de enantimeros: simetria (R-S)
Os dois enantimeros do 2-butanol so os seguintes: CH3 HO C H CH2 CH3 2-butanol CH3 H C OH CH2 CH3
Se nomearmos estes dois enantimeros usando apenas o sistema de nomenclatura IUPAC, que j vimos, eles tero o mesmo nome : 2-butanol (ou lcool secbutlico). Isso indispensvel porque cada composto deve ter seu prprio nome. Cahn-Ingold-Prelog desenvolveram o sistema (R-S) para solucionar esse problema. As configuraes R e S so atribudas com base no seguinte procedimento: 1) Observe os quatro tomos ligados ao centro de quiralidade e atribua prioridades em ordem decrescente de nmero atmico. O tomo co nmero atmico mais alto o primeiro da srie e o de menor nmero atmico o quarto. 2) Se no for possvel determinar a prioridade pela aplicao da regra 1, compare os nmeros atmicos dos tomos sguintes de cada substituinte e assim por diante. 3) Os tomos com ligaes multiplas so equivalentes ao mesmo nmero de tomos com ligaes simples: H C O = H C O O C 4) Tendo decidido a ordem dos grupos ligados ao carbono quiral, posicionamos o grupo (4) apontado para trs, afastado do observador. Em seguida, atribumos setas curvas do grupo (1) para as demais, definindo o sentido de rotao. Exemplo:
H H5C2 C CH 3 HO H (4) (2) H5C2 C CH (3) 3 HO (1) Regras 2 e 3) No necessrio aplicalas. H3C Regra 1)
H C HC 5 2 OH (4) H (3) H3C C H C (2) 5 2 OH (1)
No necessrio aplicalas.
H H5C 2 C CH 3 HO Posicionando o "4" para trs
Regra 4) (2) (1) C2H5 OH H C (4) H C C HC H CH 5 2 CH 33 (3) H3C H5HO C2 OH (3) (1) (2) Rotao sentido horrio Rotao sentido anti-horrio nomenclatura (s) nomenclatura (R) Posicionando o "4" para trs
C C H H (4) (3) H3C H3C OH 2 (3) H5C (1) (2) Rotao sentido Anti-horrio Rotao sentido horrio nomenclatura nomenclatura (R) (S)
(1) C H 2 5 OH
(2)
Exemplo de carbonos quirais:
O CH3 H3C C CH2 Carvona leo de Hortel nootkatona * O CH3 CH3 * * * CH2 C CH3 H * HO * * H H3C CH3 CH3
mentol
8.2. Importncia biolgica da quiralidade
A origem das propriedades biolgicas relacionadas quiralidade frequntemente comparada especificidade de nossas mos com suas respectivas luvas; a especificidade para uma molcula quiral (como uma mo) em um stio de recepo quiral (uma luva). Se tanto a molcula quanto o receptor no combinam perfeitamente no ocorrer a reao.
X X H receptor H receptor
Estas ligaes No ocorrem
8.3. Atividade ptica
O estudo da esterequmica tem sua origem no trabalho do qumico francs Jean Baptiste Biot, no sculo XIX, que investigou a natureza da luz-plana polarizada.
ngulo
luz
Fonte de luz
Polarizador Seleciona a O feixe de radiao
amostra
Anteparo graduado
Figura 13. Equipamento para verificar a atividade tica, Polarmetro.
Biot observou que algumas substncias poderiam alterar a rotao da luz polarizada (EX. aucar ou cnfora). Nem todas as substncias apresentam essa propriedade mas, as que fazem so denominadas opticamente ativas. A partir da observao das substncias no polarmetro, podemos tirar informaoes como o ngulo de rotao das substncias e tambm o sentido. Horrio, chamado de dextrgiro ou anti-horrio, chamado de levgiro . Por conveno a rotao anti-horria recebe o sinal (-) e a rotao horria o sinal (+). HOH2C CH3 H C C2H5 (R)-(+)-2-metil-1-butanol dextrgira H CH3 HOH2C C C2H5 (S)-(-)-2-metil-1-butanol Levgiras
Você também pode gostar
- Desinfeccao e Esterilizacao Quimica Capitulo08Documento63 páginasDesinfeccao e Esterilizacao Quimica Capitulo08DogaaaAinda não há avaliações
- Atomistic ADocumento5 páginasAtomistic Akjoplin1711Ainda não há avaliações
- 401 - Especialista em Regulação e Vigilância Sanitária - Área 1 - Prova A - Específico (Tarde)Documento14 páginas401 - Especialista em Regulação e Vigilância Sanitária - Área 1 - Prova A - Específico (Tarde)Max CarvalhoAinda não há avaliações
- Bacteria 3Documento40 páginasBacteria 3kjoplin1711Ainda não há avaliações
- Aula 1 Ferramentas Da QualidadeDocumento0 páginaAula 1 Ferramentas Da Qualidadekjoplin1711Ainda não há avaliações
- Exercicios Resolvidos Capitulo 5 SolomonsDocumento13 páginasExercicios Resolvidos Capitulo 5 SolomonsDavidson Henrique SantosAinda não há avaliações
- Exercicos Respostas ConformaçõesDocumento6 páginasExercicos Respostas ConformaçõesJuliana AraujoAinda não há avaliações
- Exercício de Estreoquímica PleDocumento3 páginasExercício de Estreoquímica PleMikaele Da Rocha RibeiroAinda não há avaliações
- 2 Lista de Exercícios - Quím. Orgânica - Com Gabarito - FA2NDocumento9 páginas2 Lista de Exercícios - Quím. Orgânica - Com Gabarito - FA2NIsabelly VicenteAinda não há avaliações
- Isomeria - Compostos de CoordenaçãoDocumento16 páginasIsomeria - Compostos de CoordenaçãoCarlos SilvaAinda não há avaliações
- 04 - Aula Farmacos QuiraisDocumento43 páginas04 - Aula Farmacos Quiraismariajussara499Ainda não há avaliações
- 1 Avaliao - 1 Trimestre - 3 Ano - InformticaDocumento3 páginas1 Avaliao - 1 Trimestre - 3 Ano - InformticaMarília Armanda BellotAinda não há avaliações
- Estereoquimica Eritro TreoDocumento15 páginasEstereoquimica Eritro Treobiel1916Ainda não há avaliações
- Isomeria Geometrica e Optica e ExerciciosDocumento11 páginasIsomeria Geometrica e Optica e ExerciciosWallyson Carvalho100% (1)
- Isomeria OpticaDocumento4 páginasIsomeria OpticaProf-Alexsandro Ferreira0% (1)
- IsomeriaDocumento24 páginasIsomeriaWilson NascimentoAinda não há avaliações
- Isomeria Óptica 3Documento42 páginasIsomeria Óptica 3Junior DuarteAinda não há avaliações
- Organica 1 (Estereoquimica)Documento46 páginasOrganica 1 (Estereoquimica)Gisa Jacques100% (1)
- Isomeria EspacialDocumento34 páginasIsomeria EspacialReginaldo SalesAinda não há avaliações
- ESTEREOQUÍMICADocumento8 páginasESTEREOQUÍMICAMikaele Da Rocha RibeiroAinda não há avaliações
- Aula - 8 - EstereoquímicaDocumento32 páginasAula - 8 - EstereoquímicaRaquel BastosAinda não há avaliações
- AULA 7 Estereoquimica - Q ORGANICA I PDFDocumento26 páginasAULA 7 Estereoquimica - Q ORGANICA I PDFYann LinsAinda não há avaliações
- Aula 11 - Isomeria Espacial - Cis TransDocumento11 páginasAula 11 - Isomeria Espacial - Cis TransPedro Henrique Fileti KuhnAinda não há avaliações
- 6 - Estereoquímica (Slide)Documento25 páginas6 - Estereoquímica (Slide)jojojAinda não há avaliações
- Lista de Química Orgânica - UtfprDocumento4 páginasLista de Química Orgânica - UtfprEstela RibasAinda não há avaliações
- Org 16Documento15 páginasOrg 16Yanna CarolinaAinda não há avaliações
- Aula 02 - Isomeria de Compostos Orgânicos RENANDocumento27 páginasAula 02 - Isomeria de Compostos Orgânicos RENANTomás Fortes GiffoniAinda não há avaliações
- BX 03 Spe Er19 em v11 Qui Livativ PFDocumento28 páginasBX 03 Spe Er19 em v11 Qui Livativ PFDavi KaczAinda não há avaliações
- Estereoquímica PDFDocumento44 páginasEstereoquímica PDFRonaldo RochaAinda não há avaliações
- Quimica Dos Compostos Organicos I Aula 4Documento24 páginasQuimica Dos Compostos Organicos I Aula 4Catarina MatosAinda não há avaliações
- Isomeria Plana e EspacialDocumento31 páginasIsomeria Plana e EspacialCamila de PaivaAinda não há avaliações
- Aulas 4 A 6 - Estereoquimica - AtualDocumento50 páginasAulas 4 A 6 - Estereoquimica - AtualFelipe MorganAinda não há avaliações
- ISOMERIADocumento44 páginasISOMERIAKauã PaulinoAinda não há avaliações
- Isomeria Espacial 14Documento7 páginasIsomeria Espacial 14Rhuan MendesAinda não há avaliações
- Isomeria de CadeiaDocumento9 páginasIsomeria de Cadeiaorlando de pinaAinda não há avaliações