Escolar Documentos
Profissional Documentos
Cultura Documentos
MS 104468 Transformações Gasosas
Enviado por
João MárioDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
MS 104468 Transformações Gasosas
Enviado por
João MárioDireitos autorais:
Formatos disponíveis
Transformações Gasosas
Prof. Vogt
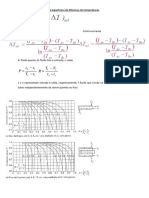
1a lei da termodinâmica Observação: Sinais
Por conservação de energia Sistema aquece: ∆U > 0
temos: Sistema esfria: ∆U < 0
Q = ∆U + τ Sistema a temperatura constante: ∆U = 0 (trans. isotérmica)
τ ∆U = Q – τ Sistema recebe calor: Q > 0
Sistema cede calor: Q < 0
trabalho Sistema não troca calor: Q = 0 (transformação adiabática)
∆U calor
Variação
da energia
calor
Sistema realiza trabalho: τ > 0
interna
Realiza-se trabalho sobre o sistema: τ < 0
Q Sistema não troca trabalho: τ = 0 (transformação isocórica)
1. Isotérmica (T = constante) 2. Isobárica (P = constante)
isotermas
P isoterma
P
A A B
PA PA = PB
TB
PB B
N TA = TB N
TA
τ = área τ = área
VA VB V VA VB V
∆U = Q – τ N
τ = P.∆V = área
Como ∆T = 0 , temos ∆U = 0 0=Q–τ
Q=τ ∆U = Q – τ
3. Isocórica (V = constante) 4. Adiabática (Q = 0)
isotermas isotermas
Êmbolo travado
P P adiabática
Transformação
rápida (não há
troca de calor)
PA A A
PA
TA TA
PB B B
PB
TB
N
τ = área TB
τ=0
VA VB V
VA = VB V ∆U = Q – τ
∆U = Q – τ ∆U = 0 – τ τ > 0 > ∆U < 0
(expande) (esfria)
Como τ = 0 , temos ∆U = Q – 0 ∆U = – τ
∆U = Q τ < 0 > ∆U > 0
(comprime) (aquece)
Você também pode gostar
- Gases e Termodinamica Com Cor Parte 1 PDFDocumento1 páginaGases e Termodinamica Com Cor Parte 1 PDFWhisllay Maciel Bastos Jr.Ainda não há avaliações
- CH 2 Solutions SalinasDocumento12 páginasCH 2 Solutions SalinasGabriel Henrique BatistaAinda não há avaliações
- Aulas Fluidos CompressiveisDocumento24 páginasAulas Fluidos CompressiveisRosana TavaresAinda não há avaliações
- Estabilidade e Instabilidade Do ArDocumento7 páginasEstabilidade e Instabilidade Do ArPaulo AguiarAinda não há avaliações
- Relatório 1 - Processo de Esvaziamento em Regime Não-EstacionárioDocumento15 páginasRelatório 1 - Processo de Esvaziamento em Regime Não-EstacionárioLuanna Steindorff Guandalini SoaresAinda não há avaliações
- Lista4 - Primeira e Segunda Lei Da TermodinâmicaDocumento3 páginasLista4 - Primeira e Segunda Lei Da TermodinâmicaGabriel Barbosa0% (1)
- Gases e Termodinamica Com Cor Parte 1 PDFDocumento1 páginaGases e Termodinamica Com Cor Parte 1 PDFGeorge SenaAinda não há avaliações
- Gases e Termodinamica Com Cor Parte 1Documento1 páginaGases e Termodinamica Com Cor Parte 1Nathan RodriguesAinda não há avaliações
- Gases e Termodinamica Com Cor Parte 1Documento1 páginaGases e Termodinamica Com Cor Parte 1Camila RibeiroAinda não há avaliações
- Apostila 4 2º Ano Física CompletoDocumento56 páginasApostila 4 2º Ano Física CompletoAnonymous CU1C9HwX100% (4)
- Física IIDocumento2 páginasFísica IIalice cracassoAinda não há avaliações
- Química PPT - Gases PerfeitosDocumento13 páginasQuímica PPT - Gases PerfeitosQuímica PPT100% (1)
- FisicaDocumento56 páginasFisicaRicardo PatrickAinda não há avaliações
- Termo Av1 Presence 22Documento5 páginasTermo Av1 Presence 22wilson hugoAinda não há avaliações
- Exerc Cios de Fixa o - 1Documento1 páginaExerc Cios de Fixa o - 1Paulo SantanaAinda não há avaliações
- Formulario ClimatizacaoDocumento2 páginasFormulario ClimatizacaoBeCrDamasoAinda não há avaliações
- Relatório de Fisico-Química Experimental I - Princípios de Avogrado e A Lei Dos Gases PerfeitosDocumento11 páginasRelatório de Fisico-Química Experimental I - Princípios de Avogrado e A Lei Dos Gases PerfeitosThiago LopesAinda não há avaliações
- Vest 2010 Fis Farias Aula 12Documento2 páginasVest 2010 Fis Farias Aula 12Pedro ColenAinda não há avaliações
- Química SM11 San MarcosDocumento5 páginasQuímica SM11 San MarcosHéctor Freddy Diaz MoscolAinda não há avaliações
- Questõesdeestática 1Documento6 páginasQuestõesdeestática 1Silva HenriquesAinda não há avaliações
- Aula 6 - Potências em Regime Alternado Sinusoidal Teorema de Poynting Compensação Do Fator de Potência PDFDocumento14 páginasAula 6 - Potências em Regime Alternado Sinusoidal Teorema de Poynting Compensação Do Fator de Potência PDFGonçalo DiasAinda não há avaliações
- Relações de Maxwell - ResumoDocumento10 páginasRelações de Maxwell - ResumoJanaina LeitinhoAinda não há avaliações
- Propriedades de Fluidos PurosDocumento34 páginasPropriedades de Fluidos PurosAna Clara GalluzzoAinda não há avaliações
- Leis Básicas de Transferência de CalorDocumento4 páginasLeis Básicas de Transferência de CaloreupasseiAinda não há avaliações
- 2.0 - Termologia - Termodinamica IiDocumento2 páginas2.0 - Termologia - Termodinamica IiJorge José BackAinda não há avaliações
- 1.9 - Termologia - Termodinamica IDocumento2 páginas1.9 - Termologia - Termodinamica IJorge José BackAinda não há avaliações
- Formulário Permutadores de CalorDocumento2 páginasFormulário Permutadores de CalorSara FernandesAinda não há avaliações
- Apresentação 06 - TermodinâmicaDocumento9 páginasApresentação 06 - TermodinâmicaThalison TgeaAinda não há avaliações
- Física 1 - Módulo 6Documento15 páginasFísica 1 - Módulo 6Karoline MontilaresAinda não há avaliações
- Fórmulas Física 2Documento3 páginasFórmulas Física 2Alexandre MarchioteAinda não há avaliações
- II Gases IdeaisDocumento7 páginasII Gases IdeaisVanessa Maria Sacalema EliseuAinda não há avaliações
- Aula 3 - Termodinâmica - Professor Jeferson ArenzonDocumento10 páginasAula 3 - Termodinâmica - Professor Jeferson ArenzonWilian Bauer BaumAinda não há avaliações
- Sistema GasosoDocumento7 páginasSistema GasosoEraclitoSL100% (3)
- Física - CASD - Capítulo 05 - TermodinâmicaDocumento10 páginasFísica - CASD - Capítulo 05 - TermodinâmicaFísica Caderno de Resoluções67% (3)
- Módulo 13Documento4 páginasMódulo 13Marisaa MartinsAinda não há avaliações
- 1° Lei Da TermodinâmicaDocumento1 página1° Lei Da TermodinâmicaAmanda Queiroz DantasAinda não há avaliações
- Aula 03Documento3 páginasAula 03hugosjiAinda não há avaliações
- Qui115 Primeira Lei Termodinâmica 2 2021 2Documento13 páginasQui115 Primeira Lei Termodinâmica 2 2021 2Tulio RodriguesAinda não há avaliações
- PMT2305 4a Pot TermodDocumento14 páginasPMT2305 4a Pot TermodFelipe Girondi DenardinAinda não há avaliações
- Propriedades Variáveis Que Descrevem o Estado Do Gás.: A) Quantidade de Matéria (N) N 6,02x1023Documento6 páginasPropriedades Variáveis Que Descrevem o Estado Do Gás.: A) Quantidade de Matéria (N) N 6,02x1023Isa BritoAinda não há avaliações
- FormulárioDocumento9 páginasFormulárioGabriel QuinhonesAinda não há avaliações
- Lista11 ResolucaoDocumento5 páginasLista11 ResolucaoxotunredmailtopAinda não há avaliações
- Aula 9 - Condução em Regime TransienteDocumento17 páginasAula 9 - Condução em Regime TransienteJosy SouzaAinda não há avaliações
- Aula 06Documento17 páginasAula 06Pedro Altero ParraAinda não há avaliações
- Kit Formulas FisicaDocumento16 páginasKit Formulas FisicaThiffanyAinda não há avaliações
- TQA2 - 1S2023: Carlos Dos Santos Cássio CastilhoDocumento13 páginasTQA2 - 1S2023: Carlos Dos Santos Cássio CastilhoFlavia Gomes ValenteAinda não há avaliações
- Gases e Termodinâmica 2017 PDFDocumento3 páginasGases e Termodinâmica 2017 PDFWesley Ferreir de OliveiraAinda não há avaliações
- Mapa Mental Fisico-Quimica 1Documento1 páginaMapa Mental Fisico-Quimica 1Ariele MorelliAinda não há avaliações
- Atividade de Revisão RefrigeraçãoDocumento6 páginasAtividade de Revisão RefrigeraçãoMatheus Barbosa LeiteAinda não há avaliações
- Ecaps21 22Documento6 páginasEcaps21 22Macchi_RJAinda não há avaliações
- Tsala 2Documento9 páginasTsala 2g207133Ainda não há avaliações
- Ficha de Apoio Sobre Gases e TermDocumento9 páginasFicha de Apoio Sobre Gases e TermMelshim Marcelo LopesAinda não há avaliações
- Relatório - ManometriaDocumento7 páginasRelatório - ManometriaFernanda NogueiraAinda não há avaliações
- Expansibilidade e Compressilibidade 2024Documento21 páginasExpansibilidade e Compressilibidade 2024thallisson fernandesAinda não há avaliações
- Formulas e EspecificaçõesDocumento1 páginaFormulas e EspecificaçõesRenan Marré BiazattiAinda não há avaliações
- 8 - Máquinas Térmicas e RefrigeradoresDocumento4 páginas8 - Máquinas Térmicas e Refrigeradoresfontana refrigeraçaoAinda não há avaliações
- Problemas Física2 - TermodinâmicaDocumento24 páginasProblemas Física2 - TermodinâmicaAndré AntunesAinda não há avaliações
- NyquistDocumento8 páginasNyquistRodrigo FilhoAinda não há avaliações
- Planilha Flash Multicomponente (ABEQ)Documento10 páginasPlanilha Flash Multicomponente (ABEQ)Lucas AraújoAinda não há avaliações
- Transf de Calor Tubos - Slide 23Documento49 páginasTransf de Calor Tubos - Slide 23Alex VianaAinda não há avaliações
- A4 Margens e LegendaDocumento1 páginaA4 Margens e LegendaJoão MárioAinda não há avaliações
- Ajuda Traçado PranchetaDocumento8 páginasAjuda Traçado PranchetaJoão MárioAinda não há avaliações
- Aula12 Desenhos em CorteDocumento74 páginasAula12 Desenhos em CorteJoão MárioAinda não há avaliações
- Semi Lousa Ciclo Carnot Seg Lei e Rendimento 2018 ThunderDocumento2 páginasSemi Lousa Ciclo Carnot Seg Lei e Rendimento 2018 ThunderJoão MárioAinda não há avaliações
- Evolução EstelarDocumento93 páginasEvolução EstelarJoão Mário100% (1)
- Curso 12168 Aula 08 v1Documento49 páginasCurso 12168 Aula 08 v1Gerson GersonAinda não há avaliações
- Lista de Exercicío Segunda e Terceira Leis Da Termodinâmica - Fqti - 2021 - 1Documento4 páginasLista de Exercicío Segunda e Terceira Leis Da Termodinâmica - Fqti - 2021 - 1HiêldoAinda não há avaliações
- Relações Termodinâmicas para Sistemas SimplesDocumento11 páginasRelações Termodinâmicas para Sistemas SimplesThg747100% (3)
- Lista2 fscIIIEDocumento2 páginasLista2 fscIIIEJonathas BarrosoAinda não há avaliações
- Termodinamica Primeira Lei PDFDocumento3 páginasTermodinamica Primeira Lei PDFpriscilaborgesAinda não há avaliações
- 1 - Termodinamica Exercicios MicDocumento27 páginas1 - Termodinamica Exercicios MicSimone PinheiroAinda não há avaliações
- Thermodynamics - Felix Sharipov PDFDocumento120 páginasThermodynamics - Felix Sharipov PDFJohn DoeAinda não há avaliações
- NBR11956 - Coque - Determinação Do Porder Calorifico SuperiorDocumento6 páginasNBR11956 - Coque - Determinação Do Porder Calorifico SuperiorSilviaMonicaAinda não há avaliações
- Revisão Unicamp Unesp Fuvest 2 Fase JuracyrDocumento15 páginasRevisão Unicamp Unesp Fuvest 2 Fase Juracyrjulio.dasilva.tellesAinda não há avaliações
- TermodinâmicaDocumento35 páginasTermodinâmicaJúlio Cézar MonteiroAinda não há avaliações
- Propriedades de Fluidos PurosDocumento34 páginasPropriedades de Fluidos PurosAna Clara GalluzzoAinda não há avaliações
- Termodinâmica Química TC Farias BritoDocumento2 páginasTermodinâmica Química TC Farias BritoDaniel Dias100% (1)
- Resoluà à o 1 Fase - Ciclo 6 - ITAv2Documento40 páginasResoluà à o 1 Fase - Ciclo 6 - ITAv2heydrianchristian34100% (1)
- Lista Fisica Geral2Documento3 páginasLista Fisica Geral2Maria ZzzAinda não há avaliações
- Termo DanielDocumento37 páginasTermo DanielSk1lzAinda não há avaliações
- 2a Lei Termodinâmica e Funções AuxiliaresDocumento4 páginas2a Lei Termodinâmica e Funções AuxiliaresMax CarvalhoAinda não há avaliações
- Respostas 4Documento17 páginasRespostas 4ellensilveira_7173Ainda não há avaliações
- PDF ITA QuímicaDocumento17 páginasPDF ITA QuímicaEtrooGamesAinda não há avaliações
- Módulo 19 - QuestõesDocumento1 páginaMódulo 19 - Questõespatricia olivenseAinda não há avaliações
- Prova Objetiva 2013 - Todas EngenhariasDocumento8 páginasProva Objetiva 2013 - Todas EngenhariasAlexandre LimaAinda não há avaliações
- Lista de Exercícios - GasesDocumento2 páginasLista de Exercícios - GasesjulianosmaAinda não há avaliações
- 2° Lista de Máquinas TérmicasDocumento9 páginas2° Lista de Máquinas TérmicascarlosAinda não há avaliações
- Exercicio de FisicaDocumento4 páginasExercicio de FisicailoveyouianAinda não há avaliações
- Física - CASD - Capítulo 05 - TermodinâmicaDocumento10 páginasFísica - CASD - Capítulo 05 - TermodinâmicaFísica Caderno de Resoluções67% (3)
- 6C-SE 1a Serie pm4 Gabarito ErrataDocumento10 páginas6C-SE 1a Serie pm4 Gabarito ErrataThalles Eduardo Silva MotaAinda não há avaliações
- Solutions Callen H B Exercicios ResolvidDocumento61 páginasSolutions Callen H B Exercicios ResolvidLaila AdrielleAinda não há avaliações