Escolar Documentos
Profissional Documentos
Cultura Documentos
Deq503 1a Avaliacao Parte I 2012.1
Enviado por
Gilson Medeiros0 notas0% acharam este documento útil (0 voto)
6 visualizações2 páginasTítulo original
deq503_1a_avaliacao_parte_I_2012.1
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
6 visualizações2 páginasDeq503 1a Avaliacao Parte I 2012.1
Enviado por
Gilson MedeirosDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 2
Universidade Federal do Rio Grande do Norte - UFRN
Departamento de Engenharia Química - DEQ
1ª Avaliação, Parte 1/2, de Termodinâmica Química - DEQ 503
Data: 19 de março de 2012; Prof.: Osvaldo Chiavone Filho
Nome: Matrícula:
1. O comportamento volumétrico do metano está descrito no diagrama v-P (volume
específico-pressão) a seguir no sistema inglês de unidades. Três condições podem ser
extraídas do diagrama: (a) crítica; (b) subcrítica na saturação à P=100psia e (c)
supercrítica à P=1500psia e T=0ºF. Determine graficamente os valores do ponto
crítico (Pc e v c), das densidades molares do líquido e vapor saturado na condição b; e
finalmente o valor do volume molar (v sc,molar à P=1500psia e T=0ºF) na condição c.
Todos estes resultados devem ser convertidos para o Sistema Internacional de
unidades. Assuma a massa molar do metano igual a 16g/mol. (1 ponto)
t(ºF)=1,8t(ºC)+32; T(K)= t(ºC)+273,15;
1 bar=14,5038 psia; 1 m=3,28084 ft; 1 kg = 2,20462 lbm.
2. Determine o número de graus de liberdade das condições a, b e c da questão anterior,
justificando do ponto vista de prático, ou de aplicação na operação de um
equipamento, e de caracterização do estado termodinâmico do sistema. F=2-P+N-R
(1 ponto)
3. Ar sintético gasoso está confinado num cilindro por um pistão de 12 cm de diâmetro, no
qual está assentado um peso. A massa do pistão e do peso, em conjunto, é 50 kg. A aceleração
local da gravidade é 9,80 m s-2 , e a pressão atmosférica é 101,3 kPa.
a. Qual é a força exercida sobre o gás pela atmosfera, pelo pistão e pelo peso, em N,
assumindo que não há atrito entre o pistão e o cilindro? (0,3 ponto)
b. Qual é a pressão do ar sintético em kPa? (0,3 ponto)
c. No caso em que o ar é aquecido, ele expande, elevando o pistão. Se o conjunto pistão/peso
foi elevado 40 cm, determine o trabalho em kJ realizado pelo ar sintético? (0,4 ponto)
P=F/A; A=3,14D2 /4; F=mg; EP=mgz; Wrev=-PdV
1 N = 1 kg m s-2 ; 1 J = 1 N m = 1 m3 Pa; 1 Pa = 1 N m-2
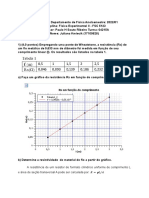
4. Um mol de gás em um sistema fechado sofre quatro processos fechando um ciclo
termodinâmico. Use os dados na Tabela a seguir para determinar os valores das quantidades
que estão faltando (0,8 ponto). 1ª lei da termodinâmica sistema fechado: ΔU = Q + W.
Processo ΔU (J) Q (J) W (J)
12 -200 ? -6000
23 ? -3800 ?
34 ? -800 300
41 4700 ? ?
12341 ? ? -1400
Explique o porque do valor da variação de energia interna obtido no ciclo completo (12341),
cite o gráfico a seguir na explicação. (0,2 ponto).
Você também pode gostar
- Termodinâmica química II - problemasDocumento26 páginasTermodinâmica química II - problemaskffgkgigl24Ainda não há avaliações
- Questões Petrobras Ciclos PotênciaDocumento5 páginasQuestões Petrobras Ciclos PotênciaSantos WilliamsAinda não há avaliações
- 2 - Lista CineticaDocumento4 páginas2 - Lista CineticaLilian PaesAinda não há avaliações
- Circuitos Com CapacitoresDocumento17 páginasCircuitos Com CapacitoresNath BarbosaAinda não há avaliações
- Lista de Exercícios 1 de Termodinâmica Aplicada IIDocumento4 páginasLista de Exercícios 1 de Termodinâmica Aplicada IIju_dominAinda não há avaliações
- Exercicios Resolvidos Aula 2 EnviadosDocumento6 páginasExercicios Resolvidos Aula 2 EnviadosWagner LemeAinda não há avaliações
- Lista de exercícios de termodinâmica com problemas de ciclos, propriedades de vapor e misturas bifásicasDocumento2 páginasLista de exercícios de termodinâmica com problemas de ciclos, propriedades de vapor e misturas bifásicasWilson TadeuAinda não há avaliações
- Circuito RCDocumento7 páginasCircuito RCVinicius FreitasAinda não há avaliações
- Aquecimento global reduz gelo do ÁrticoDocumento10 páginasAquecimento global reduz gelo do ÁrticoSara Pereira100% (1)
- Física - Questoes Discursivas - Modulo de Revisao - GabaritoDocumento11 páginasFísica - Questoes Discursivas - Modulo de Revisao - Gabaritofernandapmferreira94Ainda não há avaliações
- Química: Raio atômico, reatividade e pares galvânicosDocumento9 páginasQuímica: Raio atômico, reatividade e pares galvânicosKelita CoimbraAinda não há avaliações
- Resolução de Questões de Termodinâmica Petrobras Eng Equipamentos JR MecanicaDocumento5 páginasResolução de Questões de Termodinâmica Petrobras Eng Equipamentos JR MecanicaLuis Omena75% (4)
- Prova Física e Química com 15 questõesDocumento12 páginasProva Física e Química com 15 questõesYasmine HajarAinda não há avaliações
- Prova 2009Documento4 páginasProva 2009Wilkins BarrosAinda não há avaliações
- l1 Qui117 2016-1Documento4 páginasl1 Qui117 2016-1Derik FerrazAinda não há avaliações
- Questões Objetivas CinéticaDocumento10 páginasQuestões Objetivas CinéticaMônica Cecato100% (1)
- Folha 2 de Cinética Química-IME-ITADocumento3 páginasFolha 2 de Cinética Química-IME-ITAHelton MoreiraAinda não há avaliações
- L1 Qui117 2015-1Documento4 páginasL1 Qui117 2015-1Isabella SeneAinda não há avaliações
- Exercicios de Fixacao Aulas 13 e 14 - 2023 - 1Documento9 páginasExercicios de Fixacao Aulas 13 e 14 - 2023 - 1Kamily SoaresAinda não há avaliações
- Análise de Circuitos Elétricos I - Prova de RecuperaçãoDocumento174 páginasAnálise de Circuitos Elétricos I - Prova de RecuperaçãoIzah GarciaAinda não há avaliações
- Prova Fisica 2 Ufrj 2010.1 p2 Com GabaritoDocumento4 páginasProva Fisica 2 Ufrj 2010.1 p2 Com GabaritoPedro FerreiraAinda não há avaliações
- Refrigeração, Ventilação e Ar-condicionado - Avaliação P1Documento4 páginasRefrigeração, Ventilação e Ar-condicionado - Avaliação P1Ricardo BrunnerAinda não há avaliações
- (Lista de exercícios) Introdução a cálculos de EngenhariaDocumento4 páginas(Lista de exercícios) Introdução a cálculos de EngenhariaJúlia MacielAinda não há avaliações
- 1 Pe 19 20 Emd Eena-6Documento3 páginas1 Pe 19 20 Emd Eena-6Pedro RussoAinda não há avaliações
- Prova de Conhecimento em Química para Ingresso na Pós-Graduação do DQ/UFMGDocumento16 páginasProva de Conhecimento em Química para Ingresso na Pós-Graduação do DQ/UFMGAnanda DiasAinda não há avaliações
- Aula 3 - Exemplos de SCVSEDocumento28 páginasAula 3 - Exemplos de SCVSEFranz BlunkAinda não há avaliações
- Aula Prática 2 - Simulação PDFDocumento3 páginasAula Prática 2 - Simulação PDFRichard De Medeiros CastroAinda não há avaliações
- Pressão em ponto submerso em tanque de águaDocumento84 páginasPressão em ponto submerso em tanque de águaNicole Zequim BealAinda não há avaliações
- Lista03 QB76K 2s 2017 PDFDocumento2 páginasLista03 QB76K 2s 2017 PDFsakurachanfanAinda não há avaliações
- Termodinâmicos e parâmetros para MMADocumento7 páginasTermodinâmicos e parâmetros para MMAAlessandra LacksAinda não há avaliações
- Exercícios Lista2 2024Documento1 páginaExercícios Lista2 2024thallisson fernandesAinda não há avaliações
- Cinética Decomp H2O2Documento7 páginasCinética Decomp H2O2Mayke Cezar Wippel100% (1)
- Seleção Pós-Graduação em Física (UFSC) - 2013.1Documento23 páginasSeleção Pós-Graduação em Física (UFSC) - 2013.1rsfernanderAinda não há avaliações
- Trabalho Antigo - ModelagemDocumento24 páginasTrabalho Antigo - ModelagemThales TrindadeAinda não há avaliações
- Reações químicas resolvidasDocumento20 páginasReações químicas resolvidasmuralha17Ainda não há avaliações
- Gabarito Comentado Engenharia Química (Qui) - Versão ADocumento16 páginasGabarito Comentado Engenharia Química (Qui) - Versão AMaisa Paraguassu100% (1)
- ConvecçãoDocumento34 páginasConvecçãoErnon FilipeAinda não há avaliações
- LISTADocumento5 páginasLISTAAcássio PaivaAinda não há avaliações
- Lista de exercícios de circuitos elétricos com soluções em fasoresDocumento3 páginasLista de exercícios de circuitos elétricos com soluções em fasoresPatricAinda não há avaliações
- Lista Termo02 2024Documento2 páginasLista Termo02 2024thallisson fernandesAinda não há avaliações
- Prova 3 Engenharia QuimicaDocumento3 páginasProva 3 Engenharia QuimicaFlavia Gerjoi BezerraAinda não há avaliações
- Lista de Exercícios de Química Geral com Reações de VelocidadeDocumento2 páginasLista de Exercícios de Química Geral com Reações de VelocidadePedro MarizAinda não há avaliações
- Prova1-Resolucao Transcal Ufrj CharllesDocumento5 páginasProva1-Resolucao Transcal Ufrj CharllesFelipe Di Napoli GarciaAinda não há avaliações
- Cinética Química UFCEDocumento3 páginasCinética Química UFCEPaulo GonçalvesAinda não há avaliações
- Atividade 134 Termodinâmica 10.10 12hDocumento6 páginasAtividade 134 Termodinâmica 10.10 12hPolyanaAinda não há avaliações
- Termodinâmica das Soluções e Equações de EstadoDocumento32 páginasTermodinâmica das Soluções e Equações de Estadodai_anefAinda não há avaliações
- Cinetica Quimica Com GabaritoDocumento7 páginasCinetica Quimica Com GabaritoCésar Augusto100% (4)
- Eear Física 70 128Documento59 páginasEear Física 70 128pessoal.chmoAinda não há avaliações
- Exercícios Sobre Termodinâmica e GasesDocumento4 páginasExercícios Sobre Termodinâmica e GasesElisabete LimaAinda não há avaliações
- Primeira Lei Da Termodinamica IntermediaDocumento3 páginasPrimeira Lei Da Termodinamica IntermediaÁlisson MichaelsenAinda não há avaliações
- FT 6a Fqa11Documento4 páginasFT 6a Fqa11Ana BernardoAinda não há avaliações
- 1 Pe 22 23-5Documento3 páginas1 Pe 22 23-5Pedro RussoAinda não há avaliações
- Formulário de Reatores CompletoDocumento7 páginasFormulário de Reatores CompletoCaroline Jacobs100% (1)
- Prova 1Documento5 páginasProva 1Juliana KmiecikAinda não há avaliações
- TMD 2223SI 1TDocumento7 páginasTMD 2223SI 1TMiguel SousaAinda não há avaliações
- Deq503 2a Avaliacao 2015 2 EntropiaDocumento1 páginaDeq503 2a Avaliacao 2015 2 EntropiaGilson MedeirosAinda não há avaliações
- Dessulfurização GNDocumento11 páginasDessulfurização GNGilson MedeirosAinda não há avaliações
- Introdução à desidratação de gás natural com peneiras molecularesDocumento54 páginasIntrodução à desidratação de gás natural com peneiras molecularesGilson MedeirosAinda não há avaliações
- Deq503 2a Avaliacao 2015 1 EntropiaDocumento1 páginaDeq503 2a Avaliacao 2015 1 EntropiaGilson MedeirosAinda não há avaliações
- Exercício - Ciclo de LiquefaçãoDocumento1 páginaExercício - Ciclo de LiquefaçãoGilson MedeirosAinda não há avaliações
- Apostila - Processamento GN - Parte 1Documento32 páginasApostila - Processamento GN - Parte 1Gilson MedeirosAinda não há avaliações
- Introdução à desidratação de gás natural com peneiras molecularesDocumento54 páginasIntrodução à desidratação de gás natural com peneiras molecularesGilson MedeirosAinda não há avaliações
- Liquefação - Destilação Criogênica - Inclusive GNDocumento106 páginasLiquefação - Destilação Criogênica - Inclusive GNGilson MedeirosAinda não há avaliações
- Apostila UFRN - Processamento GN - Parte 2 (2011)Documento27 páginasApostila UFRN - Processamento GN - Parte 2 (2011)Antonio Carlos AraujoAinda não há avaliações
- Polímeros - GGMDocumento24 páginasPolímeros - GGMGilson MedeirosAinda não há avaliações
- Introdução à desidratação de gás natural com peneiras molecularesDocumento54 páginasIntrodução à desidratação de gás natural com peneiras molecularesGilson MedeirosAinda não há avaliações
- ANP Marco Antonio Fidelis Classificação de DutosDocumento13 páginasANP Marco Antonio Fidelis Classificação de DutosGilson MedeirosAinda não há avaliações
- Apostila de Parceira Rural e ArrendamentoDocumento7 páginasApostila de Parceira Rural e ArrendamentoGilson MedeirosAinda não há avaliações
- Introdução à desidratação de gás natural com peneiras molecularesDocumento54 páginasIntrodução à desidratação de gás natural com peneiras molecularesGilson MedeirosAinda não há avaliações
- Alfabeto Ecologico - Ebook FINALDocumento121 páginasAlfabeto Ecologico - Ebook FINALGilson MedeirosAinda não há avaliações
- Ciclo CombinadoDocumento6 páginasCiclo CombinadoGilson MedeirosAinda não há avaliações
- Alfabeto Ecologico - Ebook FINALDocumento121 páginasAlfabeto Ecologico - Ebook FINALGilson MedeirosAinda não há avaliações
- Teoria Do UrbanismoDocumento141 páginasTeoria Do UrbanismoGilson MedeirosAinda não há avaliações
- Aula de Contrato de Representação DramaticaDocumento5 páginasAula de Contrato de Representação DramaticaGilson MedeirosAinda não há avaliações
- Gas ConstantDocumento1 páginaGas ConstantSankar SasmalAinda não há avaliações
- Vou-Me Embora Pra Pasárgada de Manuel BandeiraDocumento6 páginasVou-Me Embora Pra Pasárgada de Manuel BandeiraGilson MedeirosAinda não há avaliações
- Apostilha Sobre MatrimônioDocumento39 páginasApostilha Sobre MatrimônioGilson MedeirosAinda não há avaliações
- Processo de Execução CivilDocumento9 páginasProcesso de Execução CivilGilson MedeirosAinda não há avaliações
- Boletim Anual de Exploração e Produção de Petróleo e Gás Natural - Base 2015 PDFDocumento20 páginasBoletim Anual de Exploração e Produção de Petróleo e Gás Natural - Base 2015 PDFGilson MedeirosAinda não há avaliações
- Termodinâmica Química - EquaçõesDocumento1 páginaTermodinâmica Química - EquaçõesGilson MedeirosAinda não há avaliações
- 6 Dissertação Cibele - Souza - Lopes UFSC 2007 PDFDocumento96 páginas6 Dissertação Cibele - Souza - Lopes UFSC 2007 PDFnaldomaedaAinda não há avaliações
- Compressores: tipos e aplicaçõesDocumento10 páginasCompressores: tipos e aplicaçõesGilson MedeirosAinda não há avaliações
- Correlações Generalizadas, Misturas e Eq Virial de PitzerDocumento20 páginasCorrelações Generalizadas, Misturas e Eq Virial de PitzerGilson Medeiros100% (1)
- Smar Instrumentacao Controle AvancadoDocumento187 páginasSmar Instrumentacao Controle AvancadoGilson MedeirosAinda não há avaliações
- Os Pensadores-JHON LockeDocumento307 páginasOs Pensadores-JHON LockeJosenilde Reis CostaAinda não há avaliações
- Semana Da Arte Moderna- TropicalismoDocumento44 páginasSemana Da Arte Moderna- TropicalismospetanierisAinda não há avaliações
- Direitos Fundamentais dos IdososDocumento31 páginasDireitos Fundamentais dos IdososDenisson Gonçalves Chaves100% (1)
- Dicionário Etimológico da Mitologia Grega OnlineDocumento321 páginasDicionário Etimológico da Mitologia Grega OnlinevictorAinda não há avaliações
- Atividade - Docxeletrolie ClaraDocumento6 páginasAtividade - Docxeletrolie ClaraElany PereiraAinda não há avaliações
- Formula para Criar e Monetizar SitesDocumento22 páginasFormula para Criar e Monetizar SitesCarlos Júnior UchôaAinda não há avaliações
- Marketing para RestauranteDocumento34 páginasMarketing para RestauranteLivia SilvaAinda não há avaliações
- Limite de velocidade à noite com base no alcance dos faróisDocumento6 páginasLimite de velocidade à noite com base no alcance dos faróisRaphael MartelloAinda não há avaliações
- Traditional Chinese Medicine Factors in São Paulo EstablishmentDocumento242 páginasTraditional Chinese Medicine Factors in São Paulo EstablishmentAna BarbaraAinda não há avaliações
- Portfólio Individual Projeto de Extensão I - Negócios Imobiliários 2023 - Programa de Ação e Difusão CulturalDocumento1 páginaPortfólio Individual Projeto de Extensão I - Negócios Imobiliários 2023 - Programa de Ação e Difusão CulturalAlex NascimentoAinda não há avaliações
- Ficha 1Documento2 páginasFicha 1gonçaloAinda não há avaliações
- Concepção Dialógica e As Ntics - A Educomunicação e Os Ecossistemas ComunicativosDocumento15 páginasConcepção Dialógica e As Ntics - A Educomunicação e Os Ecossistemas ComunicativosSandra Marques100% (1)
- DA. Sistemas AdministrativosDocumento6 páginasDA. Sistemas Administrativospatricio Valentin100% (3)
- Desenho TécnicoDocumento62 páginasDesenho TécnicoEmmanuel Van Putten OliveiraAinda não há avaliações
- Senso ComumDocumento37 páginasSenso Comumroseane17Ainda não há avaliações
- II Ativ, Saúde e Tecnol, DronesDocumento5 páginasII Ativ, Saúde e Tecnol, DronesMárcio Henrique Da Conceição SousaAinda não há avaliações
- Interdisciplinaridade entre Biologia, História e GeografiaDocumento9 páginasInterdisciplinaridade entre Biologia, História e Geografiakatiana alencarAinda não há avaliações
- Aula 2021 - Brasil ColonizaçãoDocumento60 páginasAula 2021 - Brasil ColonizaçãoAnderson AmorimAinda não há avaliações
- D2 (9º ANO - Mat.) - Blog Do Prof. WarlesDocumento6 páginasD2 (9º ANO - Mat.) - Blog Do Prof. WarlesANA PAULA DA SILVA FERREIRAAinda não há avaliações
- Diogo Portugues 1Documento4 páginasDiogo Portugues 1SusanaDelindroAinda não há avaliações
- CasaMaringá - Lista Eletronica e PerfumariaDocumento41 páginasCasaMaringá - Lista Eletronica e Perfumaria-Foemalord-Ainda não há avaliações
- Gabarito preliminar concurso público Rio Novo MGDocumento5 páginasGabarito preliminar concurso público Rio Novo MGLuiz Philip SimãoAinda não há avaliações
- Poema Oitavo de O Guardador de Rebanhos - NatalDocumento2 páginasPoema Oitavo de O Guardador de Rebanhos - NatalmdlramosAinda não há avaliações
- Ele Vai Te Pedir em Namoro em 30 DiasDocumento152 páginasEle Vai Te Pedir em Namoro em 30 DiasGabriela Gomes100% (11)
- O que é o Ministério PúblicoDocumento5 páginasO que é o Ministério PúblicoG.H.Ainda não há avaliações
- Análise de Risco Tarefa PlanejamentoDocumento10 páginasAnálise de Risco Tarefa PlanejamentoWeltonibe CarvalhoAinda não há avaliações
- Dia Do Disco de VinilDocumento1 páginaDia Do Disco de Vinilmonica meloAinda não há avaliações
- Instrumentação Virtual e AnalíticaDocumento4 páginasInstrumentação Virtual e AnalíticaDalton InacioAinda não há avaliações
- Prova Eletrônica - Fundamentos Da AdministraçãoDocumento9 páginasProva Eletrônica - Fundamentos Da Administraçãonelsonsl18100% (3)
- Os termos Hinayana e Mahayana: uma análiseDocumento1 páginaOs termos Hinayana e Mahayana: uma análiserodrigo6ferreira-10Ainda não há avaliações